

小编推荐会议:2018基因编辑与基因治疗国际研讨会
基因疗法最近经历了一次复兴,该技术同时正在逐渐被许多艾滋病研究人员所接受。由于CCR5基因在艾滋病抗药性中起着重要作用,所以研究人员操控基因(尤其是CCR5)的能力,可能有助于解决多年来一直困扰HIV治疗领域的问题。通常,即使患者对抗逆转录病毒治疗反应良好,但是它们往往将HIV“储存库”藏匿,该潜伏的病毒储存库,随时都可以恢复。

最近,西雅图弗莱德哈钦森癌症研究中心的科学家们从一项动物实验中得出了令人信服的结果:从患者骨髓中提取的基因编辑过的干细胞可以解决艾滋病病毒的蓄积问题。在一项有关感染嵌合猿猴/人免疫缺陷病毒(SHIV)猕猴的研究中,基因编辑后的从骨髓中提取的干细胞似乎减少了病毒储存量。
CCR5首次引起艾滋病研究人员的注意是在2007年,当时一位名叫Timothy Brown的HIV阳性患者通过骨髓移植而治愈。后来科学家发现他的骨髓供者含有CCR5突变,使他的细胞对HIV感染产生抵抗力。
弗莱德哈钦森小组此前曾证明,可以从猕猴骨髓中取出干细胞,并编辑它们的基因,使其具有抗艾滋病病毒的突变。当他们把这些细胞移植回动物体内时,这些细胞会重新增殖。
在这项新的研究中,研究小组分析了从动物身上采集的组织样本,发现被编辑的细胞侵入了HIV“储存库”。但根据论文,在其中两种动物中,这些储存库是无法探测到的。
就在两个月前,凯斯西储大学和Sangamo Therapeutics 的科学家宣布了一项人类试验的计划,该试验将评估基因编辑的T细胞对HIV的治疗效果。他们将使用一种名为锌指核酸酶基因编辑技术,从病人血液中剔除CCR5细胞。这项试验预计将招募20名患者。
近年来,艾滋病研究人员已经取得了进展,揭开了艾滋病毒储存库的神秘面纱。去年,北卡罗莱纳大学的科学家发现,这些储存库可以存在于称为巨噬细胞的白细胞中,这种白细胞不同于T细胞,可以存在于身体的许多区域,包括骨髓。
弗莱德哈钦森小组发现,随着时间的推移,猕猴只有4%的白细胞中还含有CCR 5的编辑,不使用抗逆转录病毒药物就不足以维持SHIV的缓解。他们现在正致力于提高编辑技术的效率,希望能提高这一治疗性基因的比例。(新浪医药编译/David)
文章、图片参考来源:Gene editing shows promise in combating HIV reservoirs
2018年5月17日 讯 /生物谷BIOON/ –多年以来,科学家们一直知道,基因EAK-7在确定线虫生存时间上扮演着重要的角色,但研究人员并不清楚是否该基因在人类机体中有相似的版本,如果有的话,该基因在人类机体中又是如何发挥作用的?近日,一项刊登在国际杂志Science Advances上的研究报告中,来自加利福尼亚大学的研究人员通过研究首次描述了人类机体中名为EAK-7(mEAK-7)的基因的作用机制。
图片来源:www.phys.org
文章中,研究者发现,mEAK-7基因能够调节一种特殊的代谢途径,而该途径能够调节细胞生长和人类机体的发育,这些过程的破坏是诱发癌症、神经性障碍等其它疾病的原因之一,本文研究中,研究人员希望能够通过减缓或阻断mEAK-7基因的分子过程来帮助开发新型疗法,从而控制引发疾病的细胞生长和扩散过程。
2013年研究人员开始对线虫机体中的EAK-7基因进行研究,通过阐明该基因对于线虫的重要性,研究人员就想理解是否该基因在人类机体生物学中是否扮演着关键角色,同时他们还想阐明为何某些特定的人类细胞会转变成为干细胞。研究者Joe Nguyen表示,我们无意中发现,线虫体内的EAK-7基因或许与人类体内相同的基因之间存在一定关联。当研究者鉴别出人类细胞中的mEAK-7基因后,他们对多种类型的细胞进行了筛选,希望能更好地理解该基因的工作机制,这些细胞包括胚胎干细胞和成纤维细胞(成纤维细胞能够形成结缔组织并且帮助促进伤口愈合)。
研究者表示,我们并未在任何样本中发现mEAK-7的存在,但当我们对多种癌细胞中的mEAK-7进行检测时发现,mEAK-7基因的水平非常高;随后研究人员对人类细胞进行了一系列实验来观察mEAK-7如何对细胞的mTOR信号产生反应,该信号能够调节人类细胞的代谢、生长、复制和生存等过程。据研究者介绍,mEAK-7基因实际上能够激活其它的生物过程,即旁路途径,该途径并不像mTOR一样在分子水平上容易被理解。
Krebsbach说道,随着mEAK-7基因激活旁路途径被发现,我们还发现,细胞的代谢、分裂和迁移或许都依赖于细胞的类型,如果我们能够找到一种方法来控制诱发疾病的细胞的复制和迁移,那么我们就有机会开发出治疗疾病的新型疗法。随后研究人员通过抑制人类细胞中的mEAK-7基因,来检测该基因在细胞增殖和迁移过程中的重要性,当促进该基因突变或从细胞中移除该基因后,相关的信号过程就会明显下降,此外研究者还检测了是否mEAK-7基因在细胞中会过度表达,结果发现,随着其过度表达,细胞的增殖也会明显加快。
最后研究者Jin Koo Kim表示,本文中我们发现,mEAK-7基因对于细胞中mTOR信号非常重要,同时也是细胞增殖和迁移所必需的,通过靶向作用mEAK-7基因,我们就能够通过旁路途径来拦截mTOR信号,从而实现有效控制疾病进展的目的。(生物谷Bioon.com)
原始出处:
Joe Truong Nguyen, Connor Ray, Alexandra Lucienne Fox, et al. Mammalian EAK-7 activates alternative mTOR signaling to regulate cell proliferation and migration. Science Advances 09 May 2018, DOI: 10.1126/sciadv.aao5838
2018年6月2日/生物谷BIOON/—随着科学家们深入了解哪些基因可以促进疾病产生,他们正在追求解答下一个合乎逻辑的问题:能够开发出基因编辑技术来治疗甚至治愈这些疾病吗?大部分研究工作都集中在开发诸如CRISPR/Cas9(一种基于蛋白的基因编辑系统)之类的技术。
在一项新的研究中,美国斯克里普斯研究所化学系的Matthew D. Disney博士及其团队采取了一种不同的方法,开发出一种基于小分子的工具,这种方法作用于RNA上,从而选择性地剔除某些基因产物。这就进一步证实RNA确实是开发药物的一种可行的靶标。
Disney团队开发出的这种剔除工具为开发作为药丸加以服用来校正遗传疾病—通过破坏有毒的基因产物和化学控制身体的防御机制—的药物提供了可能。相关研究结果于2018年5月24日在线发表在Journal of the American Chemical Society期刊上,论文标题为“Small Molecule Targeted Recruitment of a Nuclease to RNA”。
RNA是细胞内存在的一组不同的分子,它们读取、调节和表达DNA的遗传指令。在我们的细胞内,RNA始终在运动中。它们聚集在一起,履行职责,然后被RNA降解酶降解进行循环利用。RNA降解酶是切割RNA分子的化学剪刀。
Disney说,尽管大约2%的人类基因组编码蛋白,但是70%到80%的人类基因组经转录后产生RNA,这就潜在地提供更多的药物靶标。然而,直到最近,大多数人认为RNA是无药可靶向的(undruggable),这是因为它们具有较小的尺寸且相对地缺乏稳定性。
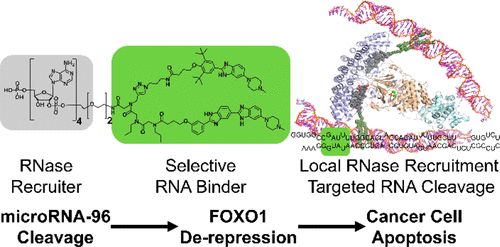
Disney的创新之处在于将一种类似药物的小分子—一种经设计后能够精确和有选择性地结合特定RNA的分子—与一种常见的RNA降解酶结合在一起。设计出的这种小分子/酶复合物结合到不需要的基因产物上并将它摧毁。Disney将这种技术命名为RIBOTAC,即“核糖核酸酶靶向嵌合体(ribonuclease-targeting chimeras)”的缩写。
为了测试RIBOTAC技术,Disney选择了RNA降解酶RNase L,它是人类抗病毒免疫反应的一个关键部分。RNase L在每个细胞中都有少量存在,通常在遭受病毒感染时,它就大量产生来破坏病毒RNA并战胜疾病。
针对RIBOTAC复合物的另一个部分,即药物类似分子,Disney选择了Targaprimir-96,这是他的实验室在2016年设计的一种分子,用于与一种已知促进癌细胞增殖(特别是在很难治疗的三阴性乳腺癌中)的microRNA致癌基因(即miRNA-96)结合。
论文第一作者、Disney实验室研究生Matthew G. Costales说,通过增加FOXO1基因表达破坏miRNA-96会导致癌细胞固有的自毁程重新激活,最终促使这些恶性肿瘤细胞死亡。
Costales说,“将我们之前针对Targaprimir-96的研究与靶向招募RNase L结合在一起,我们能够对这种RIBOTAC方法进行编程以便仅降解高度表达miRNA-96致癌基因的细胞,因而允许FOXO1发出选择性破坏三阴性乳腺癌细胞的信号。”
Disney说,激活人体利用细胞的RNA降解系统杀死自身癌症的能力提供了一种新的方法来攻击癌症。他说,这种RIBOTAC技术也可能广泛应用于癌症和其他的由基因触发的疾病。
Disney实验室花费了多年时间开发出一种被称作Inforna的计算方法,将具有足够稳定性和特定结构的RNA与能够结合它们的药物类似小分子匹配在一起。这种技术导致了Disney团队开发出Targaprimir-96和多种其他的疾病修饰性化合物,其中一些化合物如今正迈向临床开发。(生物谷 Bioon.com)
参考资料:
Matthew G. Costales†, Yasumasa Matsumoto†, Sai Pradeep Velagapudi et al. Small Molecule Targeted Recruitment of a Nuclease to RNA. Journal of the American Chemical Society, Published online:May 24, 2018, doi:10.1021/jacs.8b01233

今年4月,诺华(Novartis)公司宣布拟以87亿美元收购基因疗法公司AveXis,并获取其治疗脊髓性肌萎缩(SMA)的创新基因疗法。作为此项收购的后续,今日,诺华向生物技术新锐REGENXBIO支付1亿美元,获得了其基因疗法技术平台的独家许可。
REGENXBIO是一家处于临床阶段的生物技术公司,旨在通过基因疗法改善患者健康。其核心技术是NAV技术平台,它包含了超过100种腺相关病毒(AAV)载体,可以用于基因疗法的递送。之前,这家公司与AveXis达成协议,提供技术许可,用于SMA基因疗法的研发。
收购AveXis后,诺华向REGENXBIO支付了6000万美元的每年使用费,以及4000万美元的里程碑费用。而根据协议,诺华将获得使用NAV技术平台开发SMA疗法的独家许可。这包括了使用AAV9载体开发的AVXS-101疗法。
这意味着诺华将全力推动AVXS-101的研发。作为导致婴儿死亡的头号遗传病因,SMA是一种严重的疾病,90%的病儿寿命不足2岁。即便能够存活,也需要终身依赖呼吸机才能生存。但在去年,AVXS-101基因疗法在15名儿童患者中取得了堪称“奇迹”的疗效。在20个月时,这些患者无一死亡,也不需要持续使用呼吸机。相比之下,通常罹患这种疾病的婴儿无事件生存率仅为8%。
目前美国FDA已经授予AVXS-101孤儿药资格和突破性疗法认定。这款创新基因疗法也有望在今年递交上市申请。
我们期待研究人员们能进一步加速这款创新疗法的上市,造福更多患者。(生物谷Bioon.com)

7月8日,Axovant Sciences宣布该公司已获得Benitec Biopharma公司用于治疗眼咽肌营养不良症(OPMD)的研究性沉默替代(Silence & Replace)基因治疗项目的全球独家权利,并已开展在神经系统疾病中另外五种基因治疗产品的研究合作。
沉默替代基因治疗技术旨在在单一载体构建体中实现DNA指导的RNA干扰(沉默)以及基因的功能性拷贝(替代)。该方法适用于各种遗传疾病的治疗,包括由核苷酸重复扩增引起的常染色体显性遗传疾病。
OPMD是一种神经肌肉疾病,由编码polyA结合蛋白核1(PABPN1)的基因突变引起,可形成肌内细胞病变的核内包涵体。眼咽肌营养不良患者可能会发生吞咽困难、营养不良和吸入性肺炎,甚至导致生命危险。据估计,眼咽肌营养不良在北美和欧洲至少影响了15,000名患者,并且市面上尚无批准用于治疗该疾病的产品。
此次合作的主要项目AXO-AAV-OPMD正处于临床前开发阶段,是一种一次性通过肌肉内给药递送的腺相关病毒(AAV)载体基因疗法,其可以沉默突变体PABPN1基因并通过功能性拷贝替代它。美国FDA和欧盟委员会已授予AXO-AAV-OPMD孤儿药指定用于治疗OPMD。Axovant计划于2019年开展安慰剂对照临床研究。
除此之外,两家企业另一合作项目——靶向C9orf72基因的研究基因治疗产品,将有机会改善肌萎缩侧索硬化症(ALS)和额颞叶痴呆(FTD)相关患者的症状。
根据协议条款,Axovant将向Benitec支付1000万美元的预付款,用于AXO-AAV-OPMD计划和另外五种研究基因治疗产品的权利,以及与开发、监管和商业销售里程碑相关的付款。此外,Benitec将获得全球AXO-AAV-OPMD销售净利润的30%,以及此次合作产生的其他基因治疗产品的分级版税。
Axovant首席技术官Fraser Wright博士认为,“沉默替换技术是一种独特的基因治疗方法,它使用单一载体抑制突变蛋白质的产生,同时恢复功能性蛋白质的表达,可能是解决常染色体显性遗传疾病最完美的解决方案,我们期待与Benitec的研究和制造团队合作,推动该疗法的进步,并为诊所和患者带来更多的治疗选择。”
今年6月6日,Axovant首付3000万美元,已从Oxford BioMedica获得一款帕金森病基因疗法AXO-Lenti-PD(曾用名OXB-102)及其前身产品ProSavin?的全球独家授权。Axovant预计将于今年底开始对晚期帕金森病患者进行AXO-Lenti-PD的1/2期剂量递增研究。(生物谷Bioon.com)