本文中,小编整理了多篇研究成果,共同解读肿瘤抑制基因研究领域的新成果,与大家一起学习!
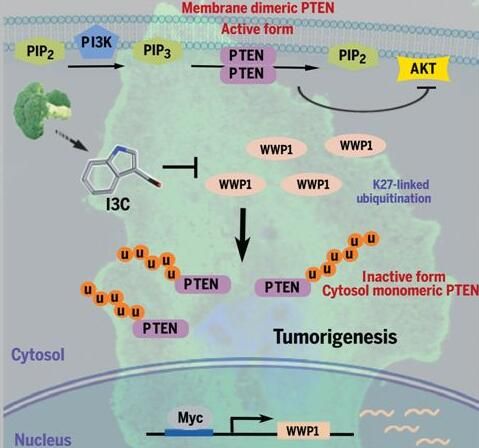
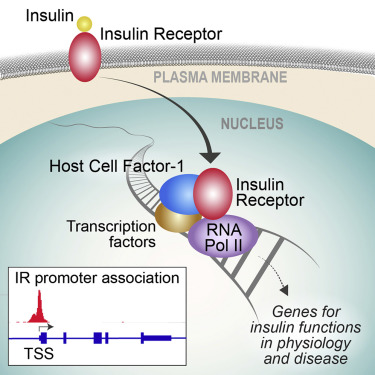
图片来源:Science, 2019, doi:10.1126/science.aau0159
【1】Science:揭示西兰花抗癌新机制!让肿瘤抑制基因再激活的新型抗癌疗法出炉
doi:10.1126/science.aau0159
在一项新的研究中,来自美国哈佛医学院等机构的研究人员证实利用在西兰花中发现的这种成分靶向这个称为WWP1的基因抑制易患癌症的实验室动物中的肿瘤生长,相关研究结果发表Science期刊上。
作为一个众所周知的强效的肿瘤抑制基因,PTEN是人类癌症中最常发生突变、缺失、下调或沉默的肿瘤抑制基因之一。某些遗传性PTEN突变可导致以癌症易感性和发育缺陷为特征的综合征。不过鉴于这个基因的完全丧失会触发一种不可逆转的强效的安全机制来阻止癌细胞增殖,这个基因的两个拷贝(人类的每个基因有两个拷贝,一个拷贝来自父本,另一个拷贝来自母本)很少同时受到影响。相反,肿瘤细胞表现出较低水平的PTEN,这就提出了一个问题,即将癌症环境中的PTEN活性恢复到正常水平是否能够激活这个基因的肿瘤抑制活性。
【2】Nature:操纵肿瘤抑制基因RB有望治疗肺癌
doi:10.1038/s41586-019-1172-9
在一项新的研究中,来自美国宾夕法尼亚大学的研究人员在已建立的致瘤KRAS驱动的小鼠肺腺癌进展和通路重新激活过程中模拟了RB丢失,相关研究结果发表在Nature期刊上。
这些研究人员发现RB丢失能够让癌细胞在肿瘤进展期间绕过两个不同的屏障。首先,RB丢失消除了在恶性进展期间对MAPK信号扩增的要求。他们鉴定RB的CDK2依赖性磷酸化作为MAPK信号转导的一种效应物,并且也作为对CDK4和CDK6的抑制产生抵抗性的关键调节物。其次,RB失活让细胞状态决定因子的表达失去调节,从而促进谱系失真(lineage infidelity)并加快了转移能力的获得。
【3】Science:揭示肿瘤抑制基因BAP1失活为何仅促进肿瘤在特定组织中形成
doi:10.1126/science.aav4902
在一项新的研究中,来自美国基因泰克公司的研究人员在一种BAP1诱导性癌症小鼠模型中,针对这种组织选择性如何作用于肿瘤抑制基因BAP1提供了一种相对简单的解释,相关研究结果发表在Science期刊上。
这些研究人员发现在包括小鼠胚胎干细胞、成纤维细胞、肝细胞和胰腺细胞在内的大多数细胞中,BAP1缺失会导致细胞凋亡,但是这不会诱导黑素细胞和间皮细胞凋亡。但是在形成肿瘤的组织中,即便BAP1不存在,具有抗凋亡作用的基因遭受的调节差异也会允许这些组织中的细胞存活下来。至少对这种肿瘤抑制基因而言,它的失活通常会导致细胞凋亡。然而,这种机制在一部分组织中失效了,从而允许这些组织中的细胞发生增殖并导致肿瘤产生。
【4】Cancer Cell:一种错误的编辑酶类或会促进肿瘤抑制基因缺失 并加速白血病进展
doi:10.1016/j.ccell.2018.11.017
近日,一项刊登在国际杂志Cancer Cell上的一篇研究报告中,来自加利福尼亚大学的科学家们通过研究发现,利用干细胞酶类ADAR1来检测“复制编辑”(copy editing)或能作为一种特殊的分子雷达来帮助进行恶性肿瘤的早期检测,同时还能为研究人员提供新型的治疗靶点帮助开发抑制癌细胞对化疗和放疗耐药的新型疗法。
ADAR1酶在20多种肿瘤类型中都处于活性状态,腺苷脱氨酶(Adenosine deaminases)是由ADAR基因编码的三种类型酶类家族,其代表着作用于RNA的腺苷脱氨酶,这些酶类能通过修饰双链RNA分子内部的核苷酸来调节基因的表达,同时也能在新的干细胞中充当“基础编辑”的角色。
【5】Nat Med:肿瘤抑制基因ARID1a或能作为免疫疗法疗效的新型生物标志物
doi:10.1038/s41591-018-0012-z
近日,一项刊登在国际杂志Nature Medicine上的研究报告中,来自德克萨斯大学MD安德森癌症中心的科学家们通过研究发现,一种频繁突变的肿瘤抑制基因—ARID1a的功能性缺失或会诱发正常DNA修复功能的缺失,并且促进肿瘤对免疫检查点抑制剂疗法变得敏感,前期研究结果表明,ARID1a的突变或能帮助有效预测免疫疗法的成功性。
文章中,研究人员首次阐明了ARID1a在调节DNA错配修复(MMR)上扮演的关键角色,DNA的错配修复时细胞纠正DNA损伤的正常过程;研究者指出,利用靶向作用PD-1的免疫检查点抑制剂疗法或能成功减轻机体的肿瘤负担,并且延长携带ARID1a缺失肿瘤的小鼠模型的寿命。ARID1a的突变频发于广泛的癌症类型中,尤其是在某些类型的癌症中常常突变频率较高(15%-50%),比如卵巢癌、子宫内膜癌、胃癌和膀胱癌等,然而大部分突变都会诱发ARID1a功能的缺失,从而就使其成为了一个不太理想的治疗靶点。
图片来源:commons.wikimedia.org
【6】JCO:肿瘤抑制基因突变对于白血病患者而言或是“双重灾难”
doi:10.1200/JCO.2017.75.5215
在关键肿瘤基因中所鉴别出的新型种系改变或许会促进儿童易患白血病,同时还会使其在后期有四分之一的概率患上第二种癌症,近日,来自圣犹大儿童医院的研究人员通过研究对3858名急性淋巴细胞白血病(ALL)患儿进行TP53肿瘤抑制基因的测序,最终鉴别出了11中高风险的种系突变,这些改变和基因活性下降明显相关,而且相比非患病儿童而言,这些突变在ALL患儿中的出现频率是前者的5倍多,相关研究刊登于国际杂志Journal of Clinical Oncology上。
种系突变通常会发生遗传,而且会在所有细胞的DNA中存在,并不仅仅存在于肿瘤细胞中的DNA,本文研究中,研究者发现,相比其它ALL患者而言,携带高风险TP53突变的26名患者因病死亡或出现相关并发症的可能性是前者的几乎4倍。研究者Jun J. Yang博士表示,这些种系突变对于携带者而言或许是双重打击,不仅会使得携带者患白血病的风险增加,还会促进其疾病复发或患上第二种癌症。
【7】Nature:揭示肿瘤抑制基因LATS控制人乳腺细胞命运机制
doi:10.1038/nature20829
乳腺癌为何产生?某些乳腺癌病人如何对常规疗法产生抵抗性?在一项新的研究中,来自瑞士巴塞尔大学的研究人员对乳腺组织中这些分子过程获得新的认识,他们鉴定出肿瘤抑制基因LATS在乳腺癌产生和治疗中发挥着关键性的作用,相关研究结果发表在Nature期刊上。
所有的乳腺癌都不是同样产生的。在高达70%的乳腺癌中,它们都有雌激素受体(estrogen receptor, ER)。如今,这些雌激素受体阳性乳腺癌能够相对较好地加以治疗。这些癌症需要雌激素才能生长,因此雌激素受体是许多药物的靶标。这些药物干扰雌激素表达、结合到雌激素受体上或者加快它的降解。
【8】Science:揭秘肿瘤抑制蛋白TP53突变的显性负面效应
doi:10.1126/science.aax3649
近日,一项刊登在国际杂志Science上题为“A dominant-negative effect drives selection of TP53 missense mutations in myeloid malignancies”的研究报告中,来自美国和德国多个研究机构的科学家们通过研究揭示了TP53突变或具有显性的负面效应(dominant negative effect),文章中,研究者描述了TP53基因突变及其发挥作用的分子机制,此外研究人员还通过对基因进行编辑来检测理论结果以及他们学到了什么。
肿瘤蛋白TP53是人类多种癌症中最常见的突变基因,大约40年前科学家们鉴别出了该基因,从那时候开始很多研究人员相继开始对该基因进行研究;其中一项研究就是,当该基因突变时,其会给予抑制肿瘤进展的蛋白添加新的功能。这项研究中,研究人员描述了TP53基因突变的显性负面效应,这种效应会导致野生型TP53的活性下降,野生型的TP53即为天然非突变的TP53形式,这种显性负面效应是指当基因发生突变时,其会导致基因产物反向影响相同细胞中野生型的基因产物。
【9】Nat Commun:科学家发现特殊的肿瘤抑制子或是乳腺癌细胞的致命弱点
doi:10.1038/s41467-018-05266-6
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自南卡罗莱纳医科大学等机构的科学家们通过研究发现,由于肿瘤抑制子和癌基因之间的失调,正常的乳腺细胞或能阻止乳腺癌的成功放疗效应。肿瘤抑制子常常能够扮演“车闸”的角色,其能阻断癌细胞失控生长,而癌基因则是癌症发生的加速器。
这项研究中,研究人员对名为PTEN的肿瘤抑制基因进行了研究,该基因在人类癌细胞中处于突变状态;研究者最初惊人地发现,在一些无癌的女性机体中,其机体间质或支持性的结缔组织中存在异常低水平的PTEN。研究者Michael C. Ostrowski教授表示,正常细胞中PTEN的缺失是一种特殊的生物标志物,其能帮助研究人员鉴别出哪些乳腺癌患者能因特殊抑制剂及标准放疗的联合疗法而获益。
【10】Nature:重磅!科学家在免疫细胞中鉴别出重要的肿瘤抑制子!
doi:10.1038/nature24649
近日,一项刊登在国际杂志Nature上的研究报告中,来自慕尼黑工业大学的研究人员通过研究在免疫系统T细胞中发现了一种“紧急关闭开关”(emergency shut-off switch),相关研究结果或有望帮助研究人员开发新型疗法抵御因免疫细胞缺陷而诱发的T细胞非霍奇金淋巴瘤。
在人类机体中,T细胞通常负责帮助检测并且杀灭癌细胞,然而但T细胞的基因组出现缺陷时问题就接踵而至了,如果这种缺陷影响了负责细胞生长的基因组区域(癌基因区域),那么T细胞就会转化成为一种失控的分裂肿瘤细胞,而且,机体抵御癌症的重要组成部分—T细胞就会失去功能。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!


 基因君官网
基因君官网