
资讯出处:New computational tool improves gene identification

资讯出处:New computational tool improves gene identification
2019年5月23日 讯 /基因宝jiyinbao.com/ –全基因组关联研究(GWAS)针对大量人群寻找有助于常见的多基因特征(如身高或肥胖)的基因。这些综合性研究经常发现大量微小的遗传变异,这些变异在高龄,肥胖等人群中更常发生。但这种相关性并不一定意味着因果关系的存在。
虽然有许多计算算法可用于帮助提取GWAS结果,但很难知道选择哪一种。研究人员在《American Journal of Human Genetics》杂志上发表的文章称Benchmarker一种可靠的对GWAS数据进行挖掘的算法。

“我们有不同的优先级算法,但我们实际上并不知道如何确定哪一个是最好的,”该文章主要作者Rebecca Fine说 “我们不想依赖先前的’黄金标准’或引入除原始GWAS数据之外的任何其他内容。”
借助“交叉验证”的机器学习概念,Benchmarker使调查人员能够将GWAS数据本身作为自己的控制。我们的想法是采用GWAS数据集并挑出一条染色体。然后,基准测试的算法使用来自剩余的21条染色体(除X和Y之外的所有染色体)的数据来预测单个染色体上的哪些基因最有可能对所研究的性状有贡献。由于依次对每个染色体重复该过程,因此汇集算法标记的基因。然后通过将这组优先基因与原始GWAS结果进行比较来验证该算法。
“首先在GWAS上训练算法,并保留一条染色体,然后返回到该染色体,并询问这些基因是否与原始GWAS结果中的强p值相关联,”Fine解释说。 “虽然这些p值并不能代表确切的”正确答案“,但它们确实可以告诉我们一些真正的遗传关联。最终产品是对每种算法执行情况的评估。
Fine,Hirschhorn及其同事通过应用得出的结论是,结合多种策略通常可以获得最佳结果。他们还发现了某些算法在寻找某些特征的基因时表现最佳的证据。
“我们希望在GWAS之后开发更多算法来回答关键的下一个问题:哪些基因和变异与人类特征和疾病有因果关系,”Hirschhorn说。 “benchmarker可以作为一种无偏见的方法来确定用于回答这个问题的算法。”(生物谷Bioon.com)
资讯出处:After GWAS studies, how to narrow the search for genes?
原始出处:Rebecca S. Fine, Tune H. Pers, Tiffany Amariuta, Soumya Raychaudhuri, Joel N. Hirschhorn. Benchmarker: An Unbiased, Association-Data-Driven Strategy to Evaluate Gene Prioritization Algorithms. The American Journal of Human Genetics, 2019; DOI: 10.1016/j.ajhg.2019.03.027
2019年6月6日 讯 /基因宝jiyinbao.com/ –进化生物学中的一个关键问题是新基因是如何产生和演化的。瑞典研究人员揭示了细菌如何从随机DNA序列中选择有利于细菌的新基因。结果发表在科学期刊《mBio》杂志上。
新基因和功能蛋白如何产生和发展是进化生物学中最基本的问题之一。目前已经提出了两种不同类型的机制:(1)具有新功能的新基因来自现有基因,和(2)新基因和蛋白质从随机DNA序列进化,现有基因和蛋白质没有相似性。在本研究中,研究人员探索了后一种机制:来自随机DNA序列的新基因和蛋白质的进化 – 称为de novo evolution。
在该实验中,研究者们选择了一个包含大约5亿随机基因序列的大型文库,并且将随机基因序列置于质粒上并过表达。科学家们随后调查了他们是否可以给细菌一种特定的特定属性。例如,他们是否能够赋予细菌抗生素抗性?他们发现了几种短肽(22-25个氨基酸长)可以使细菌对氨基糖苷类抗生素产生了高度抗性。
通过遗传和功能实验的结合,科学家们能够证明这些肽通过将自身附着在细菌细胞膜上并影响膜上的质子电位而产生抗性。质子电位的破坏导致抗生素摄取减少,使细菌产生抗性。
“这项研究很重要,因为它表明完全随机的氨基酸序列可以产生新的有利功能,并且这种从头进化的过程可以在实验室中通过实验进行研究,”作者说道。(生物谷Bioon.com)
、
资讯出处:New genes out of nothing
2019年6月13日 讯 /基因宝jiyinbao.com/ –利用基因组编辑系统CRISPR,麻省理工学院和中国的研究人员开发了自闭症的猴子模型。这些猴子表现出一些特定的,类似于患有自闭症的人类患者的行为特征和大脑连接模式。
此前,基于自闭症和其他神经发育障碍的小鼠模型,科学家们研究出了许多候选药物用于临床试验,但它们都没有成功。然而,这种新型模型可以帮助科学家们为某些神经发育障碍开发更好的治疗方案。
“我们的目标是创建一个模型,帮助我们更好地了解自闭症的神经生物学机制,并最终发现更易于人类转化的治疗方案,”作者说道。“我们迫切需要新的治疗方案来治疗自闭症谱系障碍,迄今为止小鼠的治疗方法并不令人满意。虽然小鼠研究仍然非常重要,但我们相信灵长类遗传模型将帮助我们开发更好的药物 “。

此前科学家已经发现了数百种与自闭症谱系障碍相关的遗传变异,其中许多变异只能带来很小的风险。在这项研究中,研究人员专注于一个具有强烈关联的基因,称为Shank3。除了与自闭症有关外,Shank3的突变或缺失还可引起相关的罕见疾病,称为Phelan-McDermid综合征,其最常见的特征包括智力残疾,言语和睡眠能力受损以及重复行为等。
Shank3编码的蛋白质存在于突触中 – 脑细胞之间的连接点,允许它们相互通信。它在称为纹状体的大脑的一部分中特别活跃,其涉及运动计划,动机和习惯行为。 Feng和他的同事之前曾研究过Shank3突变的小鼠,发现它们显示出一些与自闭症有关的特征,包括避免社交互动和强迫性重复行为。
作者认为,尽管小鼠研究可以提供有关疾病分子基础的大量信息,但使用它们来研究神经发育障碍也存在缺陷。具体来说,小鼠缺乏灵长类物种所特有的高度发达的前额叶皮层。这一区域对于做出决定,保持集中注意力等具有重要的作用。
位于中国的研究小组的成员,通过CRISPR技术获得了带有Shank3突变的猴子。麻省理工学院的大部分实验数据进行了分析,发现具有Shank3突变的猕猴表现出与具有突变基因的人类相似的行为模式。他们往往在夜间经常醒来,他们表现出重复的行为。与其他猕猴相比,他们的社交互动也更少。
磁共振成像(MRI)扫描也揭示了这些猴子与自闭症谱系障碍相似的症状。神经元显示纹状体和丘脑的功能连接性降低。
在接下来的一年里,研究人员希望开始测试可能影响自闭症相关症状的治疗方法。他们还希望识别生物标志物,例如MRI扫描中看到的独特的功能性大脑连接模式,这将有助于他们评估药物治疗是否有效。(生物谷Bioon.com)
资讯出处:Using gene editing, neuroscientists develop a new model for autism
2019年6月28日讯/生物谷BIOON/—《速度与激情(The Fast and the Furious)》电影系列与《老车新狂吼(Fast N’ Loud)》电视系列节目相遇,就确定了一种驱动35%的前列腺癌的癌基因。
在一项新的研究中,来自美国密歇根大学罗杰尔癌症中心的研究人员发现基因FOXA1以三种不同的方式颠覆了正常的生物学规则来驱动前列腺癌产生。他们将这种三种类型称为FAST、FURIOUS和LOUD以反映它们的独特特征。相关研究结果于2019年6月26日在线发表在Nature期刊上,论文标题为“Distinct structural classes of activating FOXA1 alterations in advanced prostate cancer”。
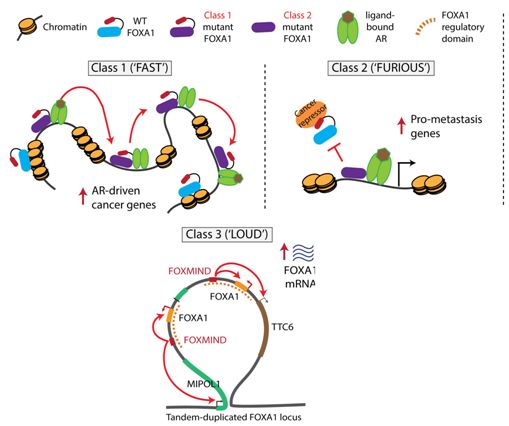
论文通讯作者、密歇根大学密歇根转化病理学中心主任、密歇根大学医学院病理学教授Arul M. Chinnaiyan博士说道,“这是一种非常有趣和复杂的生物学现象。”
论文共同第一作者、密歇根大学分子与细胞病理学研究生Abhijit Parolia说道,“我们发现这个相同的基因以三种不同的方式转化为癌基因。第一种类型是在细胞核中快速移动,第二种类型是疯狂地结合到染色质上,第三种类型是扩大到自己的声音。这三种不同的变化对患者有着不同的临床意义。”
第一类突变称为FAST。它们导致这种转录因子在DNA中更快地移动,从而允许它的伴侣蛋白雄激素受体激活促癌基因的表达。想象一下,司机开着车高速前行。这些突变见于早期前列腺癌中,并且可能是触发这种疾病的原因。
第二类突变称为FURIOUS。这类突变导致FOXA1分子的一部分被切断。这种截短的分子与DNA非常强烈地结合,从而阻止正常的FOXA1结合上去。这些突变存在于致死性的激素治疗抵抗性前列腺癌中,并促进这种癌症扩散到远处部位中。将这类突变视为疯狂地结合DNA,并主导性地让这种癌症出现侵袭性特征。
第三类突变称为LOUD。它们涉及FOXA1基因组位置的复杂重排,产生DNA重复,从而导致FOXA1或其他癌基因过表达。换言之,这些发生扩增的癌基因以生物学上能听到的最高音量发挥功能。这类突变可以在早期癌症和转移性癌症中发生。
Fast和FURIOUS类型的突变是相互排斥的,但是LOUD类型的重排能够独自存在或与其他两种类型中的任何一种同时存在。
在此之前,人们已知FOXA1在前列腺癌中发生突变,但是对它的生物学功能却知之甚少。科学家们不确定FOXA1是一种促进癌症产生的癌基因,还是一种抑制癌症的肿瘤抑制基因。 如今,这些研究人员阐明了FOXA1作为驱动癌基因的作用,此外还对FOXA1的三种新的突变进行了分类。
这些研究人员通过使用来自多个数据库(包括密歇根大学罗杰尔癌症中心的Mi-ONCOSEQ项目)的1546份前列腺癌样本的RNA测序数据,发现它的发病率在增加。
Chinnaiyan说道,“癌基因往往更容易被用来开发治疗方法,这是因为在理论上你可以用靶向药物阻断它们。然而,FOXA1是一种具有挑战性的靶标,这是因为它是一种转录因子,即一类众所周知难以用小分子抑制的蛋白。然而,科学家们如今正在开发新的策略来靶向这些‘无药可靶向的(undruggable)’靶标。”
Chinnaiyan说,这些信息也可用于鉴定患有更具侵袭性疾病的患者,或者开始理解为什么患者对治疗的反应不同。
这些研究人员还发现这三种类型的FOXA1变化也存在于乳腺癌中,并且很可能以类似于它影响雄激素受体的方式影响雌激素受体。FOXA1基因变化也与膀胱癌和一些唾液腺癌有关。(生物谷 Bioon.com)
参考资料:
Abhijit Parolia et al. Distinct structural classes of activating FOXA1 alterations in advanced prostate cancer. Nature, 2019, doi:10.1038/s41586-019-1347-4.

2019年7月21日讯/生物谷BIOON/—在一项新的研究中,来自美国波士顿儿童医院的研究人员报道了在遗传性心律失常小鼠模型中利用基因疗法抑制了这种疾病。这些发现为开发治疗遗传性心律失常的单剂量基因疗法提供了可能,而且也可能为治疗更为常见的心律失常(比如心房颤动)的单剂量基因疗法提供了可能。相关研究结果近期发表在Circulation期刊上,论文标题为“Gene Therapy for Catecholaminergic Polymorphic Ventricular Tachycardia by Inhibition of Ca2+/Calmodulin-Dependent Kinase II”。

参与这项研究的波士顿儿童医院遗传性心律失常项目主治心脏病学家Vassilios Bezzerides博士说道,“我们希望能够提供长期发挥作用的单剂量基因疗法。我们的研究为开发治疗遗传性心律失常的可转化基因治疗策略提供了概念验证。”
这项研究着重关注儿茶酚胺能多形性室性心动过速(CPVT),这是儿童和年轻人猝死的主要原因。这种心律失常通常由运动或精神压力引发,并且在平均12岁时首次出现,通常是突然失去意识。
当前的治疗方法包括β受体阻滞剂和氟卡尼等药物,手术可以阻断心脏左侧的神经,植入式心律复律除颤器(在CPVT中,这可导致中危及生命的并发症),以及让孩子尽可能少运动。
Bezzerides说道,“对于CPVT的治疗目前还不够:尽管接受治疗,25%至30%的患者仍会出现危及生命的心律失常。”
这些研究人员发现在健康的心脏组织中,一种称为CaM激酶(CaMKII)的酶可化学修饰RYR2,从而触发心肌细胞释放出更多的钙离子。在CPVT细胞中,这种修饰与遗传性的RYR2突变结合在一起,导致细胞中出现过量的钙离子水平,从而引起心律失常。
当这些研究人员阻断CaMKII修饰时,他们消除了这种组织模型中的心律失常。当用肽AIP(一种有效的选择性CaMKII抑制剂)阻断CaMKII本身时,他们获得了相同的效果。
利用基因疗法抑制CaMKII
鉴于CaMKII酶作用于心脏旁边的许多组织—并且是大脑中的记忆形成所必需的,这些研究人员希望能够特异性地抑制心脏中的CaMKII。他们在CPVT小鼠模型中测试了这种基因疗法。
他们设计了一种特殊病毒,当被注射到CPVT小鼠模型体内时,这种病毒选择性地移植到心脏并递送肽AIP。测试结果表明,AIP在大约50%的心脏细胞中表达,足以抑制心律失常,但在包括大脑在内的非心脏组织中无明显表达。
这些研究人员如今计划优化他们的基因治疗策略以便在大型动物模型中对它进行测试,并最终希望在CPVT患者中进行临床测试,这可能需要与其他医疗中心的合作。
治疗心脏病的通用方法?
Bezzerides和Pu认为这种基因疗法对于由各种RYR2突变引起的CPVT患者可能是有效的(已报道了160多种RYR2突变)。他们相信他们抑制心脏中CaMKII的整体策略可能有助于治疗更常见的心脏病。
Pu说道,“正常的心脏功能不需要CaMKII,但它会在许多形式的心脏病中被激活。在许多形式的心脏病(比如缺血性心肌病,心房颤动,肥厚性心肌病)的小鼠模型中,慢性CaMKII激活是有害的。我们的抑制CaMKII的基因疗法可能有助于改善这些其他心脏病类型的预后。”(生物谷 Bioon.com)
参考资料:
Vassilios J. Bezzerides et al. Gene Therapy for Catecholaminergic Polymorphic Ventricular Tachycardia by Inhibition of Ca2+/Calmodulin-Dependent Kinase II. Circulation, 2019, doi:10.1161/CIRCULATIONAHA.118.038514.

从中国科学院昆明动物研究所获悉,近期,该所科研人员完成了新版的树鼩基因组高精度测序、组装和注释。新版树鼩基因组填补了第一版基因组中约73%的拼装缺口。
据介绍,树鼩是一种与实验大鼠差不多大小的小型哺乳动物,为灵长类动物的近亲,在生物医学研究中颇具潜力。目前,树鼩已被用于感染性疾病如乙型肝炎、丙型肝炎、疱疹病毒感染、禽流感病毒感染等模型创建,在视觉系统研究、近视模型,以及一些肿瘤模型构建方面,显示了很好的前景。
2013年,为了解决树鼩用于疾病动物模型创建时缺少基因组学等遗传信息的问题,中国科学院昆明动物研究所姚永刚课题组牵头组织中科院动物模型与人类疾病机理重点实验室相关研究团队,联合华大基因,发表了利用二代测序技术测定的中缅树鼩的全基因组,较为全面地获取了树鼩的遗传特性,证实树鼩与灵长类动物的亲缘关系最近。基于此版树鼩基因组数据,姚永刚课题组建立了首个树鼩基因组数据库,实现了树鼩基因组数据的自由访问和共享。但由于二代测序读长过短等技术局限,第一版树鼩基因组中存在一些问题。
近期,来自姚永刚课题组的博士范宇利用单分子实时测序技术,结合高通量染色质构象捕获技术测序数据,完成了新版的树鼩基因组高精度测序、组装和注释。这一版树鼩基因组填补了第一版基因组中约73%的拼装缺口(163,220个),其中处于基因编码区的缺口全部得到填补。此外,新版树鼩基因组中,蛋白编码基因的数量与序列长度较第一版基因组有明显的质量提升,基因结构的精确度也明显上升。
基于第二版基因组信息,范宇等人完成了基因组重复序列的分析,发现120多个长转座子和400多万个包含短重复序列(长度小于150bp)和长重复序列(长度大于5kb)的卫星区域。对LINE1的分析发现,树鼩基因组中的LINE1占基因组的18.54%,这种基因组占比和人类的类似。与包括人类、猕猴和小鼠的基因组结构变异对比分析后发现,相比较于人类,树鼩基因组中含有221个结构变异,猕猴基因组中有188个结构变异,而小鼠基因组中的结构变异多达387个。有趣的是,一些结构变异,如位于MYSM1基因和SLC35D1基因间的区域,只出现在树鼩和灵长类动物中,这一结果也从结构变异的角度说明,相比于小鼠,树鼩与灵长类动物在基因组方面有更高的相似性。
据悉,为了更好地展示最新版的树鼩基因组信息,课题组将新版基因组数据、注释信息、群体遗传学参数、预测的基因共表达网络等数据,增加或更新在第二版树鼩基因组数据库中。这些用户友好型的数据库构建与更新,将为树鼩动物模型的研究提供相关基础数据,有望继续惠及树鼩研究领域。
上述研究工作以“Chromosomal level assembly and population sequencing of the Chinese tree shrew genome”为题,发表在动物学领域SCI期刊《Zoological Research》上。该研究工作得到国家自然科学基金委、中国科学院和云南省的资助。(生物谷Bioon.com)

近日,南非医学研究理事会(SAMRC)基因组学中心在开普敦正式启用,成为非洲首个高通量基因组测序中心。
南非医学研究理事会(SAMRC)成立于1969年,是南非卫生部下属机构,旨在通过研发和技术转移,改善南非人口健康,使民众能够享受到更好的生活质量。SAMRC主要研究领域包括结核病、艾滋病、心血管病及其他非传染性疾病、性别与健康、酒精及药物滥用等。
SAMRC基因组学中心是中南卫生领域合作的一项重要内容。2017年4月中非部长级医药卫生合作会议召开期间,SAMRC与深圳华大基因科技有限公司(简称华大基因)签署了合作谅解备忘录。2018年2月,双方正式签署合作协议,拟由华大基因提供设备和技术支撑,与SAMRC合作建设高通量基因组测序中心。一年多来,在两国政府部门的大力支持下,双方密切合作,通力配合,工作进展顺利。目前,约320平米的实验室改造完成,首套价值55万美元的华大基因测序仪已入驻实验室并完成组装测试。首批4名SAMRC技术人员已赴华大基因总部完成技术培训。华大基因还将派技术人员来南进行一年现场指导。
SAMRC主席兼CEO Glenda Gray教授表示,SAMRC基因组学中心将提升对人类全基因组测序、分析和数据存储的能力,使南非有机会进入医学研究的新时代。在SAMRC成立50周年之际,该中心的启用对其迈上前沿高水平研究新台阶具有重要意义。 (生物谷Bioon.com)
