我们都知道,很多人类疾病的发生都与基因突变有关,那么近期科学家们在该研究领域又取得了哪些重要研究成果呢?本文中,小编对相关研究成果进行整理,分享给大家!
【1】HMG:揭示DNA突变引发神经变性疾病的分子机制
doi:10.1093/hmg/ddz096
近日,一项刊登在国际杂志Human Molecular Genetics上的研究报告中,来自阿德莱德大学的科学家们通过研究揭示了DNA突变引发神经变性疾病的分子机制,相关研究结果有望帮助开发新型疗法减缓多种疾病的进展,包括亨廷顿氏症、运动神经元疾病等,这项研究中,研究人员首次揭示了突变如何引发细胞出现一种抗病毒样的炎性反应,从而导致细胞死亡,进而出现进行性的神经变性损伤。
文章中,研究者对于亨廷顿氏症和20种其它神经变性疾病(包括某些运动神经元疾病)相关的突变所引发的后果进行了分析研究,但其或许也会对神经变性疾病(并不一定是遗传性的)的进展产生影响,比如阿尔兹海默病和帕金森疾病等,有研究证据表明,这些疾病是由对环境诱因产生类似的炎性反应所致。
【2】Science:三个基因的联合突变会导致致命性心脏病发生
doi:10.1126/science.aat5056
高达1%的婴儿会受到先天性心脏病的影响,受影响的婴儿可能需要多次手术,终身服药或心脏移植手术等治疗。在许多患者中,先天性心脏病的确切原因尚不清楚。虽然越来越清楚这些心脏缺陷可能是由基因突变引起的,但尚不清楚哪些基因参与其中以及它们如何相互作用。人类基因组项目允许科学家识别由单个基因的严重突变引起的一些罕见疾病病例,但科学家们认为,更常见的疾病形式可能是多种微妙的基因突变相结合的结果。然而,直到现在,这种人类疾病概念的实验证据仍然难以捉摸。
近日,一项刊登在国际杂志Science上的研究报告中中,科学家们通过研究发现,在一个家庭中遗传的三个微妙遗传变异,导致多个兄弟姐妹在很小的时候患心脏病。为了验证这一理论,研究人员对该家族的基因组进行了测序,发现父亲在两个基因MKL2和MYH7中发生了突变,使他处于患心脏病的风险中。在我们的基因组中通常有两个拷贝的每个基因,在这种情况下,只有一个拷贝的MKL2和MYH7被突变,导致数百个氨基酸中只有一个发生变化。这三个孩子不仅从父亲那里继承了这两种突变,而且还从母亲那里继承了第三个突变——NKX2-5基因的突变。这种突变也只影响了一种氨基酸,并且在没有心脏病的一般人群中有报道。但是孩子们还共享了许多其他共同的遗传变异,所以是否只改变这三个基因的一个拷贝足以引起疾病的发生仍然是一个悬而未决的问题。

【3】BBI:科学家鉴别出与细胞衰老相关的基因突变
doi:10.1016/j.bbi.2019.03.007
我们都知道,精神压力往往与机体加速老化直接相关,近日,来自波士顿大学医学院的科学家们通过研究发现,一种基因突变或会与多种精神压力相互作用,这些精神压力包括创伤后精神紧张性障碍(PTSD)、疼痛及与细胞老化相关的睡眠障碍等,相关研究结果刊登于国际杂志Brain,Behavior,and Immunity上。
研究者表示,克洛索基因(klotho gene)与机体长寿及多种年龄相关疾病的发生直接相关,这项研究中,研究者首次发现,该基因或许能作为指示人类细胞加速衰老的标志物。文章中,研究者对309名退伍军人进行研究,其中很大一部分军人都患有PTSD,其曾被派往伊拉克和阿富汗参战;研究者采集了参与者的血液样本进行遗传和代谢分析,随后对参与者的精神状况进行评估,同时参与者还接受了MRI来检测其大脑结构和功能。
【4】Cell: 染色体17号发生突变会导致遗传病的发生
doi:10.1016/j.cell.2019.01.045
Potocki-Lupski综合征是由于细胞中存在一小块17号染色体的额外拷贝而出现的遗传性疾病。另外一种不同的病症,称为Smith-Magenis综合征,是当一条17号染色体被删除时会出现。人们认为这些情况是由于17号染色体中改变的遗传信息不平衡所致,但由贝勒医学院的研究人员领导的一个多学科小组发现,除了重复或删除含有染色体区域的染色体区域外,整个基因组,广泛的单个Watson-Crick碱基对突变可能发生并可能有助于这些条件的特征。该研究发表在Cell杂志上。
“在之前的一项研究中,我们曾提出,17号染色体的一小部分重复和缺失以及单一突变都发生在同一事件中,”共同第一作者Claudia M.B.博士说:“在这里,我们使用了一系列高分辨率技术和强大的统计分析来确认和扩展我们之前的观察结果。为了实现这一目标,我们仔细研究了这一小部分17号染色体在一大群无关患者中的遗传变化。无论是Potocki-Lupski还是Smith-Magenis综合征。
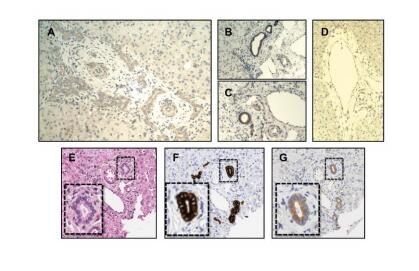
【5】Hepatology:突破!研究发现第一个和儿童胆管闭锁相关的基因突变!
doi:10.1002/hep.30515
来自科罗拉多大学安舒茨医学院(University of Colorado Anschutz Medical Campus,CU Anschutz)的研究人员与其他几个研究所的研究人员合作发现了一种和胆管闭锁(Biliary atresia,BA)相关的基因缺陷,而BA是最常见的儿科晚期肝病的诱因,相关研究成果于近日发表在《Hepatology》上。
通过找到和该疾病相关的基因突变,研究者Sokol等人确定了导致这种致命疾病的诱因。研究人员使用了新一代的基因测序,结果发现PKD1L1基因的突变和一群病人的BA相关。一些患BA的孩子同时还会出现脾异常和心源性畸形,这被称作胆管闭锁脾畸形综合征或者BASM。
【6】eLife:科学家鉴别出与自闭症发病相关的基因突变
doi:10.7554/eLife.40092
近日,一项刊登在国际杂志eLife上的研究报告中,来自加拿大多伦多大学病童医院等机构的科学家们通过研究深入阐明了神经细胞突变对人类自闭症相关特性的影响。如今自闭症谱系障碍和自闭症患者常常会对一种特殊疗法产生反应,即用诱导多能干细胞(ipsCs)衍生的神经元细胞来治疗患者,诱导多能干细胞能产生人体所需要的任何一种类型的细胞,但较高的成本意味着在单一的从测试中仅会有少数的诱导多能干细胞被使用,这就明显限制了自闭症的研究,因此目前研究人员继续在自闭症研究领域取得新的突破。
这项研究中,研究人员通过研究建立了一种可伸缩的iPSCs衍生神经元模型来改善自闭症领域的研究,研究者开发出了一种新型的资源库,该资源库中包含来自25名自闭症个体衍生的53种不同的iPSC细胞系,这些自闭症个体携带广泛的罕见遗传性突变。利用CRISPR基因编辑技术,研究人员开发出了四对等基因的ipsC细胞系(相同或类似遗传组成),这些细胞系携带或不携带遗传突变,他们想通过研究阐明突变对个体机体自闭症特性的影响。
【7】ICME:鉴别出一种与急性呼吸窘迫综合征的新型遗传突变
doi:10.1186/s40635-018-0181-6
近日,一项刊登在国际杂志Intensive Care Medicine Experimental上的研究报告中,来自瓦伦西亚大学的科学家们通过对2000多名患者的样本进行研究,鉴别出了一种与急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)相关的新型遗传突变。
ARDS是导致重症监护病房成年患者死亡的主要原因之一,此前研究结果表明,遗传突变或许参与了患者对该疾病易感性的发生。因此研究人员就想通过研究来寻找参与对败血症所诱导的ARDS易感性的新型基因,这项研究中,研究人员发现了三个候选基因,同时还发现,名为FLT1基因的单核苷酸多态性或与ARDS发生直接相关。
【8】J Cell Biol:基因突变如何诱发诸如帕金森等神经性疾病的发生?
doi:10.1083/jcb.201807019
多个基因的突变与帕金森疾病直接相关,但目前研究人员并不清楚这些基因突变是如何影响个体患上帕金森疾病的;近日,一项刊登在国际杂志The Journal of Cell Biology上的研究报告中,来自耶鲁大学的科学家们通过研究重点对一种诱发家族性帕金森疾病的基因突变进行研究,他们发现,该基因能够编码一种特殊蛋白,而该蛋白能控制脂质在细胞器膜之间的转移。
文章中,研究者调查了VPS13蛋白的关键角色,VPS13蛋白的功能障碍在多种类型神经性疾病发生过程中扮演着重要作用,包括帕金森疾病等。研究者发现,VPS13蛋白能从细胞膜中提取脂质,并将其藏匿于“防水腔体”(waterproof cavity)中,随后再转移到附近的膜结构上。VPS13蛋白家族成员位于细胞中细胞器彼此相互靠近的位点,即所谓的接触点(contact sites),其能够作为不同细胞器之间的纽带,使脂质的传递更加有效。
【9】PNAS:科学家阐明参与癌症发生的DNA的可能性突变
doi:10.1073/pnas.1807258115
近日,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自塞维利亚大学等机构的科学家们通过研究揭示了参与癌症发生的DNA的可能性改变,文章中,研究人员对名为PIF1的蛋白的角色进行了研究,他们解开了这些蛋白分子的不同结构,这些分子中包含有特殊的指令,能够促进细胞发挥正常功能,当这些改变没有得到合适修复时,就会诱发影响机体健康的突变出现。
为了避免这些问题,我们就需要保持DNA分子的完整性,然而细胞自身的代谢,尤其是在利用信息上,这就意味着,一些习惯性的屋里和化学变化可能会破坏DNA中所包含的信息并导致突变的发生。实际上,细胞每天都会发生数十次的突变。因此,为了尽可能地避免遗传信息的任何丢失,多种机制就会发挥作用,其能够帮助抵御改变的发生,并促进DNA的修复,如果这些机制并不能够足以有效修复所有的改变,那么突变就会积累,并诱发细胞衰老,在某些情况下甚至会导致多种病理学的表现,包括癌症等疾病。
【10】Nature:喝酒和吸烟诱发驱动基因突变,导致食管癌
doi:10.1038/s41586-018-0811-x
在一项新的研究中,来自日本京都大学等多家研究机构的研究人员使用来自不同年龄和不同生活方式ESCC风险的人类受试者中的682种微尺度的PNE样本(小至0.2平方毫米)来研究食管中的早期克隆事件,随后利用全外显子组测序无偏见地检测这些样本中的体细胞突变和拷贝数异常,相关研究结果发表在Nature期刊上。
通过对来自大量受试者的PNE样本中的体细胞突变进行无偏检测,这些研究人员展示了PNE样本中发生克隆扩增(clonal expansion,即前面提及的克隆细胞增殖)的综合景观,并揭示了发生增殖的克隆细胞的超微结构及其进化历史。这些研究人员发现在PNE样本中,携带驱动基因(主要是NOTCH1)突变的克隆细胞发生年龄相关的渐进性增殖,而且饮酒和吸烟可显著地加快这种渐进性增殖。几乎在所有人体内,携带驱动基因突变的克隆细胞从儿童早期开始在多个病灶位点上出现,它们的数量和大小随着年龄的增加而增加,并且最终数千个相当大的携带驱动基因突变的克隆细胞(每个食管大约9000~15000个克隆细胞)重塑几乎整个食道上皮。这能够在没有大量饮酒和吸烟的情况下发生,但是,大量饮酒和吸烟极大地加快这种重塑过程。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!

 基因君官网
基因君官网