2019年4月25日讯/生物谷BIOON/—想必大家对国内的韩春雨团队的NgAgo基因编辑事件印象深刻吧。这个事件基本上宣判了NgAgo基因编辑系统的死刑。然而,近期的一个新闻报道指出NgAgo基因编辑系统真地存在,而且在可持续生产、疾病治疗和作物培育方面具有应用价值。有网友将这个报道形容为“翻案了”。至于是不是真地翻案,按下不表,我们先简单回顾了NgAgo基因编辑事件的来龙去脉。
2018年8月31日,河北科技大学发布了《学校公布韩春雨团队撤稿论文的调查和处理结果》,认为撤稿论文已不再具备重新发表的基础,未发现韩春雨团队有主观造假情况。为此,这个持续两年多的韩春雨论文事件最终落下帷幕。
2018年9月1日,韩春雨就河北科技大学公布撤稿论文调查处理结果表示接受,并且表示在国际前沿的基因编辑技术研究领域,存在许多不可预知的问题。在经历了质疑、撤稿和调查之后,通过校内外同行专家的指导和进一步的实验验证,深刻地认识到,撤稿论文的实验设计存在缺陷、研究过程存在着不严谨的问题,论文的发表给国内外同行学者造成了误导和人力物力的浪费。论文发表后,面对媒体和同行的质疑,未能冷静理性对待,发表了一些不当言论,给社会公众带来了不必要的纷扰。对此,韩春雨表示了歉意,并对同行学者和社会的关注表达了感谢。
这一事件的起因是2016年5月2日,韩春雨作为通讯作者在《自然-生物技术(Nature Biotechnology)》(简称NBT)期刊发表了标题为“DNA-guided genome editing using the Natronobacterium gregoryi Argonaute”的论文。
在这篇论文中,来自中国河北科技大学和浙江大学医学院的研究人员发现类似于Cas9,来自Argonaute蛋白家族的核酸内切酶也利用寡核苷酸作为向导降解入侵的基因组。具体而言,他们发现来自格氏嗜盐碱杆菌(Natronobacterium gregoryi)的一种Argonaute蛋白(NgAgo)作为一种核酸内切酶,在向导DNA(guide DNA, gDNA)的引导下,能够在人细胞中进行基因组编辑。
更重要的是,这种NgAgo-gDNA系统设计方便,gDNA可直接转染细胞,而无需构建专门的gDNA表达载体;NgAgo可编辑基因组内任何位点,而Cas9的基因组靶点必须位于PAM序列的上游,而且不能富含G+C;所使用的gDNA是DNA而非RNA,不会像RNA那样容易形成二级结构而导致失效或脱靶效应;对游离于细胞核的DNA具有更高的切割效率。由此可知,相比较于Cas9-sgRNA,NgAgo-gDNA具有更大的优势,规避了令人头痛的脱靶效应,其应用前景是不言而喻的。更难能可贵的是,在Cas9-sgRNA成为全世界各大实验室争相使用的香饽饽时,这项研究发现的新基因编辑系统具有如此巨大的优势,向它发出有力的挑战,也难怪会在国内引发一阵热潮。
但是,在接下来的2年多的时间里,来自国内外的科学家们纷纷指出无法重复韩春雨NgAgo系统的基因编辑结果。最终,这篇论文被撤回了。
然而,近期的一项新闻报道有可能在基因编辑领域引起新的涟漪。
基因编辑一直是一种备受追捧和争议的技术。2019年3月,世界卫生组织(WHO)的一个下属机构要求国际登记处跟踪编辑人类基因组的所有研究。
美国普渡大学的研究人员开发出一种新技术,这可能改变未来基因编辑的方式。他们在2019年4月4日在奥兰多市举行的美国化学学会全国会议(National Meeting of the American Chemical Society)上介绍了他们的研究成果。
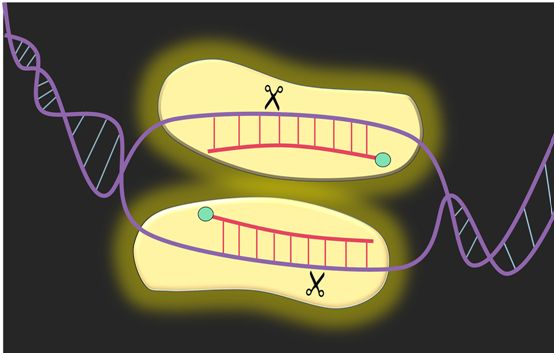
普渡大学的研究人员开发了一种新技术,可以改变基因编辑的方式。NgAgo经编程后在向导DNA(红色)的引导下切割特定区域的DNA(紫色),从而精确的基因修改,图片来自Kevin Solomon/Purdue University。
CRISPR-Cas9技术是目前应用最广泛的基因编辑技术之一。这种方法需要特定的功能性序列或基序来限制修改。
普渡大学农业与生物工程助理教授Kevin Solomon说,“CRISPR经编程后切割特定区域的DNA,在有机体中实现精确编辑,从而增加可持续生产,治疗疾病甚至培育出更好的作物。但是,它需要某种功能性的序列来将修饰限制在某些区域。”
人体中的许多疾病,包括几种类型的癌症,都是由基因组中特定位点发生的突变引起的。Solomon领导的一个研究团队开发出一种方法,该方法使用来自格氏嗜盐碱杆菌(Natronobacterium gregoryi)的蛋白Argonaute(NgAgo),并提供作为向导的DNA以便能够在基因组的任何位置进行修饰,这就为潜在地改进可持续生产、疾病治疗、药物发现和作物培育提供新的选择。
负责这个研究项目的硕士研究生Michael Mechikoff说道,“尽管还有很多研究工作要做,但我们已证实,这种分子剪刀能够编辑当前技术无法编辑的DNA区域。”
在Solomon实验室开展这项研究的博士生Kok Zhi Lee说,“我最好的朋友之一在几年前死于一种由遗传变异导致的癌症。我一直梦想着为我的朋友设计一个不同的场景—生活在一个基因工程是校正遗传疾病的一种常规和安全的选择的时代。凭借我们的技术潜力,我预计在未来遗传病将成为人类的历史。”
Solomon团队与普渡大学研究基金会技术商业化办公室合作,提交了这种技术的发明专利申请。他们正在寻找合作伙伴和其他有兴趣开发和许可它的人。(生物谷 Bioon.com)
参考资料:
New protein for gene editing may improve disease treatment, sustainable manufacturing
韩春雨NgAgo基因编辑论文不存在主观造假,持续两年多的事件就此落幕?
物理学终结?以及新的基因编辑工具NgAgo争论
Nat Biotechnol:我国科学家开发出比Cas9/sgRNA更优的基因编辑系统
 基因君官网
基因君官网