


2015年的春夏之交,我得知,一个改变我人生轨迹的小生命悄然出现,心底的喜悦居然让我愣了很久,因为我不知道应该怎样去表达,然后,我记得抱着娃她妈原地转了三圈。
之后的日子,为了确保小生命的健康成长,我带着娃她妈不断地做了很多检查,其中包括一项2015年刚刚开始的检测,名叫无创产前基因测序(NIPT),需要自费2200元,准确率高达99.8%。另一种传统的唐氏筛查则已经免费测试,但漏检率居然高达35%。这种情况下,这个钱,不能省。
看起来高大上的基因测序,到底有什么用呢?真能让人类免除疾病的困扰?
面对生命的密码,我们就如同蹲在井底的青蛙,看见阳光滑过井沿。看见了光明,却还没有真正的解密。然而放眼远眺,也许5~10年之后,我们能看到当初那被埋在井底那颗基因的种子,已长成苍天大树。
【1】
基因测序之用
“下一个能够超越我的世界首富必定出自基因领域”——比尔盖茨
虽然,人类基因密码被逐步被揭开神秘的面纱,但直到现在,基因科学更多的应用仍然只是在实验室内,为大家说熟知的,更多来源于电视剧里的法医鉴定身份、亲自鉴定关系等。
实际情况远远不是这样,现阶段基因测序主要的用途比如:针对白血病患儿骨髓移植的HLA分型、罕见病的检测、宫颈癌的预防、癌症的早期诊断、靶向用药。除了应用在人身上,还可以用于分子育种搞笑地选育好的农作物、动植物品种、用于生态治理等等。
那么基因测序能给人的健康带来什么?
1、基因检测可以了解自身遗传背景,检测身体与疾病相关的易感基因,使人们能预测身体患疾病的风险
2、基因检测避免盲目补充保健品,给身体造成不必要的伤害
3、基因检测可以指导健康的生活方式,改善不良的生活环境和生活习惯
4、基因检测可以做到疾病的早知道、早预防、早治疗,主动把握健康。
而距离我们最近的痛点,只有两个方面:
1、优生优育上的运用,针对新生胎儿的无创产前检测(NIPT);
2、癌症类病变的靶向药辅助治疗与早期诊断。
在现阶段NIPT已经被国人广泛接受的情况下,剩下的只是市场、服务与品牌的争夺;而对于癌症类病痛的基因早期诊断肯能会成为基因测序市场的另一个重要突破口。在此需要科普两个概念:基因疾病与精准医疗。
基因疾病
狐狸叔非学术简单解释,顾名思义,就是是正常基因发生有害的突变而产生的疾病。
正常情况,人类的一生应该遵循基因给予的密码进行生长发育乃至死亡。但,基因类突变来自两种情况:
1、有可能出生时,基因本身就携带着疾病的隐患,比如遗传性的疾病,美国影星安吉丽娜朱莉就是家族遗传病基因携带者,因此提前手术去掉了癌症隐患。
2、有可能由于外部环境等因素的影响,导致基因突变出现的病变,则有可能在突变基因已经产生,而尚未出现明显肿瘤类病变是,及时提前治疗。
癌症,其在现代社会的普遍性如何,大家可以自己问问身边的朋友与家人。通过常规的生理检查性,发现时间通常较晚,漏查与错误率都比较高。而通过基因测序,就有了尽早提前发现的可能。
随着技术的不断发展,现阶段做一个简单的基因测序的费用仅人民币几千元,绝大多数人几年做一次基因检测,是能够承受的。因此基因测序在癌症早诊方面,随着消费升级,与相关知识的普及,会逐步成为人民大众常规体检检查的一个项目。现在某些地区已经有小范围的逐步开展。
? 精准医疗
精准医疗(Precision Medicine)是以个体化医疗为基础、随着基因组测序技术快速进步以及生物信息与大数据科学的交叉应用而发展起来的新型医学概念与医疗模式。2015年1月20日,美国总统奥巴马在国情咨文中提出“精准医学计划”,希望精准医学可以引领一个医学新时代 。
精准医疗作为下一代诊疗技术,较传统诊疗方法有很大的技术优势。相比传统诊疗手段,精准医疗具有精准性和便捷性,一方面通过基因测序可以找出癌症的突变基因,从而迅速确定对症药物,省去患者尝试各种治疗方法的时间,提升治疗效果;另一方面,基因测序只需要患者的血液甚至唾液,无需传统的病理切片,可以减少诊断过程中对患者身体的损伤。可以预见,精准医疗技术的出现,将显着改善癌症患者的诊疗体验和诊疗效果,发展潜力大。
以上两端描述摘抄自百度百科。更多深入的我就不再细说了,只说两点:1、我国的“十三五”首次把精准医疗列为启动一批新的重大科技项目的重点领域。2、我们前面说的沸沸扬扬的很多抗癌创新药,类似于cat-T等,他们的前置检测技术,就是基因测序。
通过以上两个概念的解释,应该能初步说明基因测序技术现阶段最大的方向就在于NIPT、靶向用药与癌症早诊。在NIPT已经广泛普及的今天,
随着改善型消费的提升,癌症早诊将会是下一个基因测序的巨大市场。这个市场达到千亿级别。——狐狸叔
【2】
基因测序产业链情况
马云预测:下一个世界首富将出现在基因领域
首先说一下基因测序的产业链
资料来源:延展产业研究院整理
1.上游:处于产业链最上游的是基因测序仪、测序试剂耗材制造商。
国外的主要公司是Illumina、Thermo Fisher以及Roche;其中illumina占据60%以上的市场份额,短时间内暂无公司可以超越。
国内多采取与国外公司合作授权的形式,主要公司有华大基因(收购CG)、贝瑞和康(联手illumina)与达安基因(联手生命科学,被Themo Fisher收购)。而通过我国CFDA批准的国产测序仪主要如下:
现阶段的主流测序仪仍然是以illumina为主的测序仪。
从产业链整体上看,产业链上游的基因测序仪及配套试剂是整个产业链壁垒最高的部分,短期国外寡头垄断格局将持续,国外公司进入国内的渠道多为与国内领军者合作。
2.中游:是基因测序服务和生物信息分析机构,现今国内最主要也是最成熟的基因测序服务是无创产前基因测序(NIPT),国内市场主要被华大基因及贝瑞和康垄断。
生物信息分析(数据分析)是基因测序行业一大难点,基因测序是一项需要大数据进行基因测序比对的行业,这也是极具发展前景一块业务,荣之联与华大基因合作多年,积累了一定基因测序数据分析经验,是国内为数不多的能够提供生物数据云计算服务的企业。而贝瑞和康则是与阿里云进行合作。
中游技术壁垒较低,且对资金投入要求较低,是目前基因测序产业链中增速最快的领域。也是造成现阶段各类所谓基因测序公司及项目比比皆是的原因。
3.下游:消费群体包括医院病人、药厂及科研机构等,基因组学是未来最被看好的领域之一,在农业、畜牧业、祖先起源、法医取证、生物能源、药物等领域均有广泛应用。
简单来说,就上游技术实力上,illumina无疑是全球第一,而我国主要集中在中游的服务与应用。下游应用端,也会有较大发展的空间。随着行业与技术的发展,专业性细分公司会更加专业,大平台公司也会把触手伸向各个行业,但行业核心公司会逐步走向寡头局面,这是行业与企业发展的必然规律。
因此,在基因测序的整个行业之中,根据我国目前的实际情况,我们需要把焦点对准:基因测序行业的中游、服务于医院和个人的范围内。
基因测序是一个仍然处在发展初期的行业,绝大部分的应用还留在象牙塔的书架之中。面对那些颠覆医疗行业认知的科学技术,应用之路才刚刚开始,如果把眼光盯在当下成熟的技术与应用之中,比如无创产前检测(NIPT),那么其实并没有太大关注的必要。
一项业务并不能代表整个企业,一个企业也不能代表整个行业和市场,整个A股市场,林林总总涉及基因测序概念相关企业49家,未上市企业更是数不胜数。于是,我将目光转向了企业的人,企业的领导者。对于一项发展中的科学,我们需要的不仅仅是企业家,而是有企业精神的科学家。
井蛙的展望
面对基因检测应用于临床医学,到底能有多大的市场空间,并不好确定,NIPT是百亿级市场,而肿瘤早诊是千亿级市场,整个基因测序市场甚至万亿都有可能。
2003年是苹果股价最低的时候,最低达到12.72美元(不复权),而在2018年5月11日,AAPL(苹果)股价创历史新高190.06美元(前复权),算上分红,15年时间,总共成长234倍。
美国基因测序仪公司illumina,2000年纳斯达克上市(ILMN),2003年股价最低1.71美元(不复权)。而在2018年5月30日,ILMN创出历史新高275.34美元(前复权),15年的股价加上分红,同样成长了234倍。
我不想类比苹果,因为乐视之前类比过,结果令人扣腕。对于基因测序市场的展望,无数的研究报告基于当下市场数据,去揣测今后的市场数据,那些都只是预测而已,实际的轨迹总是出人意料。对于整个基因测序市场,挖得越深,我越是感到自己是一只井底之蛙,妄图通过冰冷的数据,去判断一颗种子发芽成长的轨迹。妄图用几个月的时间去享受今后5年、10年甚至更长时间的红利。
面对生命的密码,我们就如同蹲在井底的青蛙,看见阳光滑过井沿。看见了光明,却还没有真正的解密。然而放眼远眺,也许5~10年之后,我们能看到当初那被埋在井底那颗基因的种子,已长成苍天大树。
时值2018年的六一儿童节,我6月2日凌晨仍然在办公室一缕一缕的揪着我的头发,昨天白天勉强陪她玩了一天,今天凌晨2点,战战兢兢地完成此文,希望将此文先给我的女儿。愿生命的密码在几十年后能被更多的被破解,让他们这一代的孩子能享受更多基因密码带来的幸福。
我为她埋下一颗树种,深深地埋入泥土之中,愿它能长成苍天大树,愿科技能让你的生活更美好。(生物谷Bioon.com)
本文中,小编整理了多篇研究成果,共同解读科学家们如何绘制出基因表达图谱来助力人类疾病的研究,分享给大家!

doi:10.1038/s41586-018-0175-2
尽管血浆蛋白在生物过程中具有重要角色,同时也是许多药物的直接靶标,但是迄今为止我们并不清楚控制人体内血浆蛋白水平出现个体差异的遗传学因素。
为了揭示血浆蛋白出现个体差异的原因,来自剑桥大学等机构的科学家们在John Danesh及Adam S. Butterworth博士的带领下对来自INTERVAL研究中健康捐献者血液中的血浆蛋白组的基因进行了深入分析。他们发现了1927个与1478种蛋白相关的基因,这是已知数量的5倍,相关研究于近日发表在《Nature》上,题为“Genomic atlas of the human plasma proteome”。
最近发表在 Nature Genetics 的一篇文章中,搜集了1,013份前列腺癌的全基因组测序数据(680份原发性肿瘤和333份转移性肿瘤数据),并对其进行了统一分析,共鉴定出97例显著突变基因(SMGs),这些基因的发生率呈现明显的长尾分布(如图1)。其中有70例基因曾在肿瘤相关的研究中有过相关报道,但之前从未在前列腺肿瘤的研究中报道有显著改变。另有9例 SMGs 从未在任何类型的肿瘤中有报道涉及。大部分基因的突变频率小于3%,但是鉴于前列腺癌的高发生率,即使是这些低频率的改变也能影响大量的患者。
研究同样鉴定了参与前列腺肿瘤的信号通路。发现20%样本的基因改变与表观遗传以及染色质重塑相关;25%的样本在 PI3K 通路中发生了基因改变;10%的样本涉及 WNT/β–catenin 通路的基因改变;16%的样本发生了 DNA 修复相关基因的改变;同样在前列腺肿瘤样本中发现了泛素-蛋白酶体与连接酶家族、基因剪接通路、 RAS–MAPK 通路以及 AR 信号转导通路的基因改变。
【3】重大进展!三篇Science揭示单个细胞形成完整有机体的基因图谱
doi:10.1126/science.aar4362 doi:10.1126/science.aar3131 doi:10.1126/science.aar5780
不论是蠕虫、人类还是蓝鲸,所有的多细胞生物都是从单个细胞卵子开始的。这个细胞产生形成有机体所需的许多其他的细胞,而且每个新的细胞都是在合适的时间在合适的位置上产生的,从而通过与它的相邻细胞进行合作而精确地发挥它的功能。这一壮举是自然界中最引人注目的成就之一,而且尽管经过了几十年的研究,生物学家们还是对这一过程知之甚少。
如今,在三项具有里程碑意义的研究中,来自美国哈佛医学院和哈佛大学的研究人员报道他们如何系统性地对发育中的斑马鱼和热带爪蟾(Xenopus tropicalis)胚胎内的每个细胞进行分析,从而确定揭示单个细胞如何形成一个完整有机体的路线图。
这些研究人员利用单细胞测序技术追踪了胚胎生命的最初24小时内单个细胞的命运。 他们的分析揭示出当胚胎转变为新的细胞状态和类型时,哪些基因开启或关闭以及何时发生的完整图谱。总之,这些发现代表着在两种重要的模式生物中产生不同的细胞类型的基因“配方”目录,并且为研究发育生物学和疾病提供了前所未有的资源。
新闻阅读:Genetic profiling could improve IVF success
基因图谱分析或能帮助确定是否通过体外受精技术产生的胚胎能够成功转移到子宫内部,从而就能够提高体外受精手术的成功率。这是研究遗传学在生育能力作用中的一部分领域,来自比利时鲁汶大学的研究人员Joris Vermeesch通过研究表示,理解为何某些人为何会出现不孕不育,以及开发针对这些人群的疗法非常重要,人们有时候会花费多年的时间来试孕,但似乎结果并不奏效。
尽管体外受精技术(in-vitro fertilisation,IVF)已经取得了明显的进步,然而每个周期的成功率也仅有30%,但日前研究者Vermeesch等人发起了一项名为SARM的计划,旨在通过寻找有效的手段鉴别出哪些胚胎不太可能在子宫内存活,从而改善体外受精技术的成功率。2009年,科学家们就通过研究发现,大部分早期IVF的胚胎都是不稳定的,这些胚胎出现错误染色体数量、染色体片段缺失或增加的风险较高,这就使其很难更好地发育,从而就造成了胚胎移植的失败以及未来父母的失望。
研究者Vermeesch等人就想通过研究寻找一种更好的方法来检测上面描述到的这些失衡,在IVF中使用这种方法就能够增强胚胎成功发育的几率;对人类生育的实验受到了伦理界限的严重限制,如今科学家们正在对牛的胚胎进行研究,因为在胚胎发育阶段,牛的生殖系统与人类相似。
【5】Genome Biol:科学家利用新型技术绘制基因图谱 有望改善癌症诊断
doi:10.1186/s13059-017-1253-8
基因组结构的大规模改变通常在癌细胞中比较常见,近日来自英国巴布拉汉研究所(Babraham Institute)的研究人员通过研究就发现了一种能够检测这些改变的新方法,相关研究刊登于国际杂志Genome Biology上,该研究或为后期研究人员开发增强癌症诊断的新方法及癌症新型靶向疗法提供新的思路和希望。
这篇研究报告中,研究者描述了一种名为Hi-C技术的新应用,这种技术能够帮助研究人员绘制出遗传物质在细胞内部的排列方式和机制,通过对相关信息进行分析,研究人员就能够可靠地鉴别出其它方法可能会错过的一些主要的遗传改变,相比标准的DNA测序方法而言,这种方法的成本较低。
Hi-C能够对染色体的重排进行检测,染色体重排,即大片段DNA发生交换或者在染色体的片段间移动;同时这种技术还能够对拷贝数变异进行检测,即遗传物质的拷贝或剔除情况,所有这些改变都会对细胞的行为产生剧烈的影响。研究者Louise Harewood博士表示,在一般人群和大部分癌症患者中我们都能够看到染色体的重排现象,对患者机体的染色体重排进行检测往往非常麻烦,而且有时候很容易错过,当然这或许是非常不利的,尤其是在肿瘤学领域中,因为染色体重排往往扮演着诊断和患者预后的角色。
doi:10.1016/j.cell.2015.11.015
如今科学家们已经绘制出了维持细胞活性的基因图谱,这对于理解机体基因组工作的原理以及基因在疾病比如癌症中的重要性提供了一定思路;近日一项发表于国际杂志Cell上的研究报告中,来自多伦多大学等处的研究人员关闭了18000个基因(人类基因组的90%),用来寻找对于细胞生存非常关键的基因。
研究者在文章中揭示了超过1500个基因的一套关键基因,这对于未来进行生物医学研究来阐明单一基因对基因组的重要性指明了道路,通过关闭5种不同的癌症细胞系,包括脑部、视网膜、卵巢和其它两种结直肠癌干细胞,研究者发现,每一种肿瘤都依赖于独特的一群基因,而这些基因则可以被特殊药物靶向作用,研究者希望后期可以设计出不损伤健康组织,且靶向作用癌症细胞的新型疗法。

doi:10.1016/j.cell.2018.05.057
在一项新的研究中,来自比利时鲁汶大学(VIB-KU Leuven)Stein Aerts教授及其团队首次在果蝇衰老过程中绘制出每个脑细胞的基因表达图谱。由此产生的“细胞图谱”为大脑在衰老过程中的运作提供了前所未有的见解。这种细胞图谱被认为是开发有助于更好地理解人类疾病发展的技术而迈出重要的第一步。相关研究结果于2018年6月14日在线发表在Cell期刊上,论文标题为“A Single-Cell Transcriptome Atlas of the Aging Drosophila Brain”。
果蝇的大脑由大约10万个细胞组成,尽管它比人脑小得多,但它包含数百种不同类型的神经元和其他形成复杂网络的细胞,非常像人类大脑。
Aerts解释道,“为了真正理解大脑的运作,即使对像果蝇一样小的有机体,我们也需要放大观察每个细胞。所有的器官和组织都由许多不同的细胞组成,这些细胞彼此之间进行沟通来执行它们的特定功能。尽管它们具有相同的DNA,但它们都表达一组不同的基因,因此为了理解真正发生了什么,我们需要知道哪些细胞在做什么和什么时候做。”
【8】Science:重大进展!绘制出恶性疟原虫的药物可靶向基因组图谱
doi:10.1126/science.aan4472 doi:10.1126/science.aar4189
在一项新的研究中,来自美国加州大学圣地亚哥分校等研究机构的研究人员利用全基因组分析和化学遗传学(chemogenetics)方法,在恶性疟原虫(Plasmodium falciparum)—一种导致疟疾的疟原虫—的262种疟原虫细胞系中鉴定出新的药物靶标和对37种不同的抗疟疾药物产生抗药性的抗性基因。
这项研究证实了之前已知的有效地导致这种疟原虫产生抗药性的基因修饰,而且也揭示出加深理解这种疟原虫潜在生物学特征的新药物靶标。
论文通信作者、加州大学圣地亚哥分校医学院儿科系药理学与药物发现教授Elizabeth Winzeler博士说,“利用恶性疟原虫抗性组(resistome)—抗生素抗性基因集合—和它的药物可靶向(drug-able)的基因组将有助于指导新的药物发现工作,和增进我们对这种疟原虫如何经过进化加以反击的认识。”
【9】Cell:重大突破!首次构建出人类大脑皮层神经发生的基因调控图谱
doi:10.1016/j.cell.2017.12.014
在一项新的研究中,来自美国加州大学洛杉矶分校等研究机构的研究人员首次构建出人类神经发生(neurogenesis)的基因调控图谱,其中在神经发生中,神经干细胞转化为脑细胞并且大脑皮层在尺寸上扩大。他们鉴定出调控我们的大脑生长并且在某些情形下为在生命后期出现的几种大脑疾病奠定基础的因子。相关研究结果发表在2018年1月11日的Cell期刊上,论文标题为“The Dynamic Landscape of Open Chromatin during Human Cortical Neurogenesis”。
人类大脑与老鼠和猴子的大脑不同,这是因为人类大脑具有更大的皮层。作为大脑器官中最为高度发育的部分,大脑皮层负责思考、感知和复杂的沟通。科学家们刚开始了解促进人类大脑发育的分子和细胞机制以及它们在人类认知中发挥的重大作用。
大脑发育是由某些大脑区域或细胞类型在特定时间段的基因表达引导的。基因表达,即将我们的DNA中的指令转化为功能性产物(如蛋白)的过程,在多种水平上受到在关键时刻作为通断开关发挥作用的DNA片段的调节。但是在此之前,还没有人构建出描述在神经发生期间这些开关在染色体上的活性和位置的图谱。
【10】Cell:首次构建出人癌基因依赖图谱,有助鉴定出潜在新的治疗靶标
doi:10.1016/j.cell.2017.06.010
在一项新的研究中,来自美国哈佛大学-麻省理工学院布罗德研究所(以下称布罗德研究所)和达纳-法伯癌症研究所的研究人员构建出肿瘤细胞存活所依赖的基因的综合图谱。相关研究结果发表在2017年7月27日的Cell期刊上,论文标题为“Defining a Cancer Dependency Map”。
这个由布罗德研究所和达纳-法伯癌症研究所发起的项目旨发现肿瘤细胞存活和生长所依赖的基因。
英国伦敦癌症研究所药物发现专家Paul Workman教授(未参与这项研究)说,“这项重要的研究阐明了人癌细胞如何依赖于特定的基因。鉴定出的这些基因可能是发现新的靶向疗法的药物开发靶标。”(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
2018年7月13日 讯 /生物谷BIOON/ –日前,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自宾夕法尼亚大学Perelman医学院的研究人员通过对猕猴进行研究发现,利用基因编辑使其机体中名为PCSK9的蛋白失活或许能够有效降低猕猴机体的胆固醇水平,这项研究中研究人员首次利用基因编辑技术对大型动物模型进行研究发现了与临床疾病相关的基因表达水平的降低,基于本文研究结果,后期研究人员或许有望开发出新型疗法治疗对PCSK9抑制剂并不会耐受的心脏病患者,同时这种药物/疗法也能用来抵御机体的高胆固醇水平。
图片来源: Wikipedia/CC BY-SA 2.0
正常情况下,PCSK9蛋白能够抑制受体对肝脏中过量的有害胆固醇进行移除,在临床中,抑制PCSK9的水平就能够降低人类机体中有害胆固醇的水平。然而,某些高胆固醇血症患者却不耐受这些药物,这就提示,基因编辑或许能作为一种治疗高胆固醇血症患者的手段。研究者Lili Wang博士说道,大部分患者都会反复注射PCSK9抗体来治疗疾病,这项研究中我们发现,利用基因编辑技术就能够让那些对抑制药物不耐受的患者不再需要这种疗法进行治疗了。
文章中,研究人员对归巢核酸内切酶(meganuclease)进行工程化修饰,使其能够特异性地识别并且失活PCSK9基因,随后研究者利用腺病毒载体(AAV)来携带归巢核酸内切酶干扰灵长类动物肝脏中的PCSK9基因。研究者发现,在利用中等和高剂量AAV载体治疗的动物机体中,PCSK9的水平下降了45%-84%,而且有害胆固醇的水平也下降了30%-60%,且其具有一定的临床相关性,能够稳定减少。
对肝脏活组织分子分析结果表明,基因编辑能够诱发PCSK9基因中出现40%-65%的突变,更为重要的是,本文中使用的AAV载体剂量能够在治疗血友病患者的临床试验中安全有效地使用。研究者James M. Wilson博士表示,当我们将AAV与工程化修饰的归巢核酸内切酶进行配对用于编辑时,就能在非人类的灵长类动物中获得令人印象非常深刻的数据,我们利用了30多年的基因疗法经验,推动了在体内进行基因编辑的转化科学研究,同时还能强化在非人类灵长类动物中进行的早期研究以评估疗法的安全性和有效性。
后期研究人员还需要进行更为深入的研究来减轻动物模型中的毒性作用以及脱靶效应的发生;除了高胆固醇血症患者以外,本文研究数据还能提示研究人员可以利用相同的技术开发治疗因多种其它基因突变所诱发的广谱性肝脏代谢疾病的新型疗法。(生物谷Bioon.com)
原始出处:
Lili Wang, Jeff Smith, Camilo Breton, et al. Meganuclease targeting of PCSK9 in macaque liver leads to stable reduction in serum cholesterol. Nature Biotechnology (2018). DOI:10.1038/nbt.4182
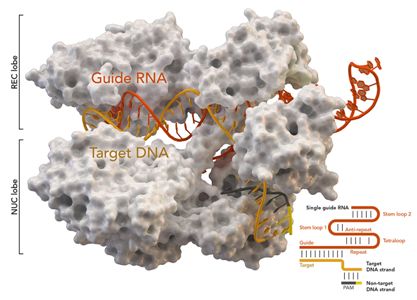
2018年8月2日/生物谷BIOON/—尽管对CRISPR-Cas9基因编辑抱有很高的期望和进行了很高的投资,但科学家们仍然需要了解它如何在人体中发挥作用。
在一项新的研究中,来自美国加州大学伯克利分校的研究人员发现人们对Cas9酶切割DNA后细胞如何修复基因组作出的假设是错误的。这一发现有助深入了解为何CRISPR-Cas9基因编辑在几乎所有细胞中都能很好地发挥作用(尽管不会在所有细胞中都取得同样的成功)。它可能有助于人们提高细胞将新的DNA片段插入到基因组—比如利用正确的DNA序列替换有害的突变—中的效率和对CRISPR-Cas9基因编辑加以调整以便获得期望的结果。相关研究结果发表在2018年8月的Nature Genetics期刊上,论文标题为“CRISPR–Cas9 genome editing in human cells occurs via the Fanconi anemia pathway”。
论文第一作者、加州大学伯克利分校博士后研究员Chris Richardson说,“如果你想要治疗镰状细胞性贫血,那么你取得成功的机会与你利用正确的基因替换发生突变的镰状细胞基因的效率密不可分。如果你从患者体内收集了一百万个细胞,并且你实现的DNA片段插入率为10%,那么这就不如30%到40%的DNA片段插入率那么好。能够操纵这些细胞来增加一个被称作同源介导修复(homology-directed repair, HDR)的过程的发生频率是非常振奋人心的。”
论文通信作者、加州大学伯克利分校分子与细胞生物学兼职教授Jacob Corn说,“基因编辑是非常强大的,人们对它充满着期待,但到迄今为止,它出现了很多错误。它在人体细胞中发挥作用的机制是未知的,而且人们对此提出了很多假设。我们终于开始了解它的作用机制。”
CRISPR依赖于DNA修复
CRISPR-Cas9是一种革命性的工具,这是因为它能够精确地靶向含有数十亿个碱基的人基因组中的特定DNA序列并切割双链DNA分子。但在那之后,细胞就开始修复这种损伤。
DNA修复能够通过两种方式进行。酶能够将悬挂的DNA末端连接在一起,这通常导致一个或多个碱基添加或缺失,从而破坏基因的功能。或者,其他的酶能够利用与切割位点的上游和下游序列相匹配的单链DNA修补这种断裂。一条互补的DNA链也会由此产生,从而完成这种双链DNA修复。
前者被称为非同源末端连接(non-homologous end-joining, NHEJ),它似乎是CRISPR切割后出现的最为常见的结果。后者就是前面所提及的同源介导修复(HDR),相比于其他的细胞,它在某些类型的细胞中更为频繁地发生,并且需要一种能够用于修补这种断裂的DNA片段的存在。科学家们经常提供单链DNA,并希望细胞利用它实现将新的DNA序列替换掉错误的DNA序列的目的。然而,这两个DNA修复过程都有点神秘,而且没有人知道为何有些细胞很容易修补DNA断裂,而其他细胞很少这样做。
Richardson说,“将CRISPR-Cas9用于医学或合成生物学应用的热情是非常高的,但是没有人真正地知道在将它导入到细胞中后会发生什么。它会导致双链DNA断裂,你依靠细胞来修复这些断裂。但是人们并没有真正地理解这个过程是如何发挥作用的。”
为了找出哪些DNA修复酶在CRISPR切割后的同源介导修复中发挥着至关重要的作用,Richardson和Corn采用了一种被称作CRISPR干扰(CRISPRi)的技术,一次一个地敲除已知或怀疑参与DNA修复的2000多个基因。
当许多经证实起着重要作用的基因被沉默时,同源介导修复发生的频率显著下降。令人吃惊的是,这些基因也参与一个之前认为并不参与CRISPR修复的重要修复通路。
范可尼贫血通路(Fanconi anemia pathway)
这个修复通路涉及21种不同的蛋白,它被称为范可尼贫血通路,这是因为如果编码这些蛋白的基因中的任何一个遭受破坏,那么人们就会患上范可尼贫血,这是一种罕见但严重的遗传性疾病,在这种疾病中,骨髓不能够产生足够的新的血细胞。它与出生缺陷和高的癌症风险(包括童年时患上白血病的几率为10%)有关。很少有范可尼贫血患者活到30岁以上。
这个通路已被人们所知和研究了数十年,但是人们普遍认为它修复一种特殊的DNA损伤:DNA链间交联(DNA interstrand crosslink):一条DNA链上的核苷酸与相邻DNA链上的核苷酸紧密地结合在一起,这会干扰DNA复制并经常杀死细胞。Corn指出,科学家们在20世纪80年代就报道了同源介导修复与范可尼贫血通路之间的关联性,但这一点被人们忽视或误解了。
Richardson说,“基于我们的研究,我们认为范可尼贫血通路在修复其他类型的DNA损伤中起着重要的作用,不过最好将它理解为一种修复双链DNA断裂的通路。在Cas9进行编辑后,如果你想插入新的DNA序列,那么范可尼贫血通路是必需的。”
然而,范可尼贫血通路在修复CRISPR断裂中的重要性让人对一些计划用于疾病治疗的CRISPR疗法本身提出质疑。在没有活性的范可尼贫血通路的情形下,在Cas9切割DNA后,细胞可能无法利用正常的基因替换发生突变的基因。
事实上,范可尼贫血通路的活性水平可能会影响CRISPR在特定细胞中插入DNA的效率。这些研究人员得出结论:尽管非同源末端连接是双链DNA断裂发生后的默认修复机制,但范可尼贫血通路与它竞争,并且更高的范可尼贫血通路活性导致更多的同源介导修复和更少的非同源末端连接发生。
癌症治疗
虽然这些发现有助于科学家们更好地理解人体细胞中的DNA修复机制,但是它们也可能有助于人们开发出靶向癌细胞中的DNA修复的抗癌疗法。鉴于如今其他的因素似乎也参与修复双链DNA断裂,因此这项研究扩大了当遭受异常调节时会干扰癌细胞中的DNA修复而让它们更容易死亡的蛋白清单。
Richardson还发现作为范可尼贫血通路中的一种蛋白,FANCD2始终靶向由CRISPR-Cas9产生的双链断裂位点,这表明它在调节将新的DNA序列在切割位点上插入到基因组中起重要作用。人们可能能够对FANCD2蛋白加以调整来提高细胞通过同源介导修复机制插入DNA的频率。
Richardson说,“此外,由于FANCD2定位到Cas9导致的断裂位点上,因此你能够利用FANCD2来绘制Cas9在任何细胞类型中进行切割的位置。如果你对一群细胞进行编辑,而且你想要知道在靶切割(on-target cut)和脱靶切割(off-target cut)的位置,那么你能够仅绘制FANCD2结合到基因组中的位置,这样就能够找到切割位置。”
Corn说,“整个范可尼贫血通路影响非同源末端连接和同源介导修复之间的平衡;它起着类似于交通警察的作用。因此,患者的基因型将影响你如何进行基因编辑。”(生物谷 Bioon.com)
参考资料:
Chris D. Richardson, Katelynn R. Kazane, Sharon J. Feng et al. CRISPR–Cas9 genome editing in human cells occurs via the Fanconi anemia pathway. Nature Genetics, August 2018, 50(8):1132–1139, doi:10.1038/s41588-018-0174-0.
2018年8月10日 讯 /生物谷BIOON/ –FOXP2是一种参与影响机体言语表达的特殊基因,其是人类机体特征正向选择的一个典型范例,近日,一项刊登在国际杂志Cell上的研究报告中,来自石溪大学等机构的研究人员通过研究对来自现代人和尼安德特人的多份样本进行遗传数据的分析,结果并未发现相关证据表明FOXP2基因最近并未出现人类特异性的选择,这或许就修正了此前我们对人类获得语言方式的认知。

图片来源:Elizabeth Atkinson
2002年一项刊登在国际杂志Nature上的研究报告中,研究人员对人类进化史进行了一项深入的分析,这或许能在很大程度上解释人类机体的语言能力,并且解释在过去50至10万年间人类时如何在非洲迅速繁衍生息的,这项研究中,研究人员对FOXP2基因进行了重新分析,尤其是对更多非洲人群机体中的该基因进行了相应分析。
研究者Brenna Henn表示,2002年当这项工作最初完成时,研究人员无法进行现代的基因测序技术来获取更多关于人类机体基因组的信息,因此他们仅对大约20名个体(欧亚血统)机体中FOXP2基因的一小部分进行了分析,如今我们想通过研究检测这种假设是否与更大、更加多样化的数据相关,而这些数据能够更加明确地控制人口统计学信息。
FOXP2在机体大脑发育期间处于高度表达状态,其能调节某些肌肉运动、促进人类语言产生,当该基因无法表达时,其就会诱发机体出现特殊的语言损伤,个体或许在认知测试中表现正常,但却无法产生口语,FOXP2被认为能够调节小鼠和鸣鸟机体语言样的行为。文章第一作者Elizabeth Atkinson说道,在过去5年里,我们对一些古老的古人类基因组进行了测序分析,而FOXP2是被研究的第一批基因,其非常重要,而且被认为对于人类具有一定的特殊性,研究结果表明,我们所认为的对人类非常特殊的FOXP2基因实际上或许并非如此。
文章中,研究人员对整个FOXP2基因进行了分析,并且将其同起周围的遗传信息进行比较来更好地理解该基因的进化,尽管研究者尝试了一系列不同的统计学测试,但他们仍然无法复制出FOXP2基因能够发生正向选择的观点;研究者Sohini Ramachandran表示,尽管最近有来自古老DNA的相关数据,但FOXP2基因仍然是每一个进化学生物学课程中教科书式的例子,因此我们并不质疑FOXP2基因的功能以及其在人类语言产生上所扮演的角色,实际上,FOXP2或许远比我们想象中更为复杂。(生物谷Bioon.com)
原始出处:
Elizabeth Grace Atkinson,Amanda Jane Audesse,Julia Adela Palacios, et al. No Evidence for Recent Selection at FOXP2 among Diverse Human Populations, Cell (2018) doi:10.1016/j.cell.2018.06.048
Enard W, Przeworski M, Fisher SE, et al. Molecular evolution of FOXP2, a gene involved in speech and language. Nature. 2002 Aug 22;418(6900):869-72, https://www.ncbi.nlm.nih.gov/pubmed/12192408
2018年8月22日 讯 /生物谷BIOON/ –由于基因检测技术的进步,如今科学家们开发出了一种新方法,能够帮助个体检测晚期阿尔兹海默病的最大遗传风险因素。阿尔兹海默病是一种进行性且致死性的神经变性疾病,其主要影响老年人群体,这种疾病是引发痴呆症的常见原因,其也是仅次于心脏病和癌症,引发人群死亡的第三大原因,在美国大约有70万65岁及以上的老年人在死亡时被发现患有阿尔兹海默病,而最近一项研究询问了50岁以上的美国人最害怕的疾病类型,对于受访者而言,他们最害怕的是阿尔兹海默病(39%),其次是癌症(30%)。
从临床上来讲,阿尔兹海默病患者最常见的表现是在不知不觉中记忆的丧失,思考和理解困难,以及精神出现混乱等。笔者(来自博伊西州立大学的Troy Rohn教授)在过去18年里,长期致力于阿尔兹海默病的研究,他认为,进行基因检测能够有效评估个体在患阿尔兹海默病上的风险,但人们也应该意识到,在进行这种疾病的检测之前,需要考虑一些事情。

图片来源:genomicslawreport.com
为何ApoE对于阿尔兹海默病患病风险而言非常重要?
绝大多数阿尔兹海默病患者发病均较晚(或者在65岁以后),而且年龄增长是诱发阿尔兹海默病的最大风险因素,在65岁以上的人群中,阿尔兹海默病会影响十分之一的个体,而且在美国,几乎三分之二的阿尔兹海默病患者均为女性患者。除了年龄增长之外,在已有的与阿尔兹海默病相关的遗传风险因素中,基因ApoE4或许就是最重要的一个,该基因能够编码载脂蛋白E(apolipoprotein E),其能与大脑中的脂质结合形成脂蛋白分子,脂蛋白负责包装胆固醇和其它脂质,并且让其在大脑中不断“摆渡”。
长期以来,科学家们一直认为ApoE4与个体大脑中淀粉样蛋白的积累直接相关,淀粉样蛋白是阿尔兹海默病发病的一个主要标志,但最近有研究却表明,ApoE4会促进tau蛋白的积累,tau蛋白是参与阿尔兹海默病发生和进展的第二种关键蛋白,因此,检测ApoE4对于很多人而言变得非常迫切。ApoE有三个不同的等位基因,同时该基因也会发生突变形成ApoE2、ApoE3和ApoE4,这些等位基因与基因的位置相同。
每个人机体都有两个拷贝的基因,等位基因的组合决定了ApoE的基因型,即E2/E2, E2/E3, E2/E4, E3/E3, E3/E4或E4/E4,E2等位基因是一种非常罕见的ApoE,即使携带该基因的一个拷贝也能够将个体患阿尔兹海默病的风险降低40%,ApoE3是一种最常见的等位基因,其似乎并不会影响患阿尔兹海默病的风险,相比E3而言,ApoE4等位基因并不常见,其在10%-15%的人群中会出现,但却会介导个体患阿尔兹海默病的风险,拥有一个拷贝的E4基因(E3/E4)会加倍个体的患病风险,拥有两个拷贝的E3/E4会使得疾病风险增加10-15倍, 65%-80%的阿尔兹海默病患者都会携带至少一个ApoE4等位基因。

图片来源:en.wikipedia.org
对ApeE4进行检测
2017年4月,基因公司23andMe获得FDA批准,能直接向消费者提供基因检测产品的服务,目前该公司能对来自消费者唾液样本中的ApoE基因进行检测,但人们常常会面临一个更困难的问题,就是我是否应该进行检测呢?了解一个人的ApoE基因状况非常有意义,消费者在决定进行检测之前应该考虑这些问题,的确,包括美国国立卫生研究院在内的很多专业机构也推荐对自愿参与临床试验的个体进行ApoE4基因的检测。
进行这项测试的优点包括:1)当前的预防医学研究表明,携带ApoE4基因的个体可以采取多种生活方式来降低其患病风险;2)能够参与临床试验;3)ApoE4对机体心血管疾病风险有一定的预测价值。缺点包括:1)家庭因素;2)精神损失;3)长期护理对家庭收支的影响;4)对就业的影响。
了解自身状态的影响
对ApoE4基因进行检测的一个主要缺陷就是这项测试是一种敏感性测试,其预测价值非常有限,携带E4等位基因并不意味着个体会被诊断为阿尔兹海默病,很多E4携带者通常会很长寿,而且不会患阿尔兹海默病,而许多非携带者则仍然会患上这种疾病,因此在对机体ApoE4基因进行检测之前,了解这些情况对于个体而言至关重要。
目前多项研究分析了ApoE4基因检测对个体所产生的影响,美国国立卫生研究院进行的一项计划中就分析了研究ApoE4的状态对于未表现出任何痴呆症症状但却有阿尔兹海默病一级亲属的个体的影响,研究结果表明,了解ApoE的状态对于遗传了E4等位基因的个体而言,会造成轻微和短暂的心理问题。
在最近的一项研究中,研究者发现一部分受试者出现了心理上的不良反应,其中就包括那些专门寻找测试的一些个体;然而几乎所有接受采访的人都会说,在进行检测后他们能从后期生活方式的改变中获益。

图片来源:cam.ac.uk
是否存在其它风险因素?
ApoE4等位基因时晚期阿尔兹海默病的重要风险因子,了解E4等位基因的状态或许能帮助个体及时作出改变,即通过参与有益的生活方式改变来预防后期患阿尔兹海默病的风险。在对靶向基因进行检测之前考虑一些重要因素或许能帮助减缓个体E4等位基因测试阳性所带来的压力和焦虑情绪。研究人员建议,个体首先应该了解ApoE4的一些基础知识,如果个体进行了检测,并且发现了较高的疾病风险,那么这些个体可以进行遗传咨询来获取帮助。
无论你是否携带ApoE4风险基因,其它很多风险因素也会影响机体患阿尔兹海默病的风险,并不仅仅是风险基因和年龄;你的饮食、锻炼水平、教育、吸烟、精神活跃程度以及其它因素都是与阿尔兹海默病相关的风险因素。那么你到底是否愿意进行基因检测呢?这就是个人的意愿问题了,需要注意的是,我们要了解阿尔兹海默病的筛查利弊所在,以及医生是否能根据患者的病情制定合理的治疗策略。(生物谷Bioon.com)
参考资料:
【2】Contribution of Alzheimer disease to mortality in the United States
【3】Fear of diseases among people over 50 years of age: A survey【4】Alzheimer’s Disease Facts and Figures
【5】APOE gene
【6】A new culprit tangles with ApoE4 in Alzheimer’s disease
【7】Genetics: Finding risk factors
【11】Communicating Amyloid Neuroimaging (REVEAL-SCAN)
【12】Disclosure of APOE Genotype for Risk of Alzheimer’s Disease
【13】“Well, good luck with that”: reactions to learning of increased genetic risk for Alzheimer disease
【15】Genetic testing: Should I get tested for Alzheimer’s risk?

下一波生物技术企业IPO开始!日前,开发蛋白降解技术的生物医药公司Arvinas宣布,公司正在申请进行1亿美元的IPO融资。从公司在研管线看,Arvinas目前还没有进入临床的产品。
Arvinas是一家专注于开发基于蛋白质降解的新药的生物技术公司,成立于2013年,现在大约有50人,预计明年才扩招到75人,规模很小,运营模式是通过与其他公司合作开发其内部的研发管线。公司目前主要在研项目是针对老年痴呆病因Tau蛋白的研究。基于公司创始人兼首席科学顾问Craig Crews博士在耶鲁大学的创新研究,Arvinas正在将天然蛋白质降解的方法转化为用于治疗癌症和其他疾病的新型药物。
公司基于PROTAC的药物研发平台,使用泛素蛋白酶体系统诱导蛋白质降解(而非蛋白质抑制)。与蛋白抑制相比,PROTAC可以提供靶向 “不可成药”的蛋白质等多种优点。此外,传统的小分子抑制剂可能需要高度的全身暴露以实现足够的蛋白抑制,通常导致毒副作用和药物抗性。因此,PROTAC技术极大地扩展了为新的、以前无法成药的蛋白靶点创造药物的能力。
按照过程,泛素连接酶需要一个特殊的识别信号来识别并泛素化目标蛋白。PROTAC技术就是使其泛素任何蛋白成为可能,通过设计一个双重功能的化合物,一端可以结合目标蛋白,另一端结合连接酶,形成聚合物。此时该泛素就能泛素化目标蛋白而引导其进入降解通路,据报道,该泛素为泛素连接酶E3。
自从人类基因组被解读以来,研究人员就在试图靶向成千上万导致疾病的蛋白。据估计仅有10%的蛋白能用小分子调控,10%能用生物大分子调控的蛋白在细胞表面,而高达80%的蛋白无法用现有药物调控。蛋白靶向降解是药物研发领域的一个新兴方向。蛋白靶向降解药物力图将小分子设计成为一种新型药物,传统小分子的作用是阻断蛋白的功能,而蛋白靶向降解剂的作用是通过将这些蛋白送入蛋白酶体而将它们完全降解。
Arvinas公司的蛋白降解PROTAC技术来源于耶鲁大学Craig Crews教授的实验室,其治疗癌症的原理相对比较容易理解,该技术的亮点在于恰当的利用了细胞内的“清洁工”泛素-蛋白酶体系统。泛素-蛋白酶体系统负责清理细胞中无用或者有害的蛋白,通过激活这个清洁器从而特异性的扫除致癌蛋白。因为这种方法只需药物短暂地与致癌蛋白结合,从而区分于正常蛋白,相当于贴上了清除标签,因此往往药物浓度不高还可以循环使用,并且蛋白被降解后需要重新合成才能恢复功能,这样能保持机体长久的稳定,延缓耐药性的产生,非常适合与癌症做持久战斗,所以越来越受到大家的欢迎。
Arvinas自己的在研药物管线专注于针对前列腺癌和乳腺癌的雄激素和雌激素受体降解。去年11月,它命名了靶向并诱导雄激素受体蛋白降解的首款临床候选药物ARV-110。去年12月,靶向并诱导雌激素受体蛋白降解的第二款候选药物ARV-378获得命名。
此前,辉瑞已经答应投资Arvinas能降解蛋白的小分子技术,这是一种对治疗前列腺癌以及其他领域有非常重要作用的新技术。像辉瑞其他股权协议一样,细节无处得知,但里程碑式的打包价高达8.3亿美元,已经惊讶医药圈。在此之前,Arvinas已经与两家医药巨头基因泰克和默克结成联盟。继2015年默克4.3亿美元加入之后,去年11月基因泰克以双倍下注高达6.5亿美元来推进这一里程碑式技术的发展。
不过需要注意的是,涉足蛋白降解技术的不止是Arvinas一家公司。美国C4 Therapeutics公司凭借独家的癌蛋白靶向降解技术Degronimid与罗氏达成了7.5亿美元的订单。在一定程度上,C4 Therapeutics公司不仅收获了资本市场的青睐,更是靠着特定蛋白标记升级了肿瘤疫苗治疗癌症的技术。(生物谷Bioon.com)
小编推荐会议 2018(第三届)蛋白质修饰与疾病研讨会
2018年9月10日讯 /生物谷BIOON /——迄今为止,在使用基因疗法治疗杜氏肌营养不良症时会面临两大免疫障碍:一是治疗杜氏肌营养不良患者的抗肌营养不良蛋白会发生突变,因此会变成外源性蛋白,从而引发免疫反应;二是用于递送抗肌营养不良蛋白的腺相关病毒6(AAV-6)载体是一种病毒载体,具有固有的免疫原性。
为了克服这些障碍,近日来自斯坦福大学和华盛顿大学的科学家们开发出了一种新技术去递送工程化的质粒DNA以降低发生自身免疫反应的可能性,相关研究成果与近日发表在《PNAS》上,题为“Engineered DNA plasmid reduces immunity to dystrophin while improving muscle force in a model of gene therapy of Duchenne dystrophy”。

图片来源:PNAS
研究人表示事实上他们已经将这种技术应用于人体:可以用于递送治疗多发性硬化的髓磷脂蛋白和治疗1型糖尿病的胰岛素原蛋白。在这项最新研究中,研究人员将这项技术拓展到了基因治疗领域,以降低AAV载体以及产生的该疾病导致缺失的野生型蛋白的免疫原性。
通过系统注射重组AAV-6-微小抗肌萎缩蛋白基因到mdx/Mtrg2小鼠后,研究人员发现这种传统方法确实会诱发机体产生靶向抗肌营养不良蛋白和载体的抗体。但是使用工程化的编码微小抗肌萎缩蛋白的DNA结构可以显著降低小鼠机体针对抗肌营养不良蛋白和AAV-6载体的免疫反应。研究人员发现经过治疗的小鼠的肌肉力量也得到了显著的提高。
这些数据表明这种使用工程化DNA质粒编码抗病蛋白的方法具有很好的优势,可以避免产生免疫副反应,因此可以克服现有基因疗法的关键障碍,促使功能基因表达不受限制,从而达到更好的功能性治疗效果。(生物谷Bioon.com)
参考资料:
Peggy P. Ho el al., “Engineered DNA plasmid reduces immunity to dystrophin while improving muscle force in a model of gene therapy of Duchenne dystrophy,” PNAS (2018). www.pnas.org/cgi/doi/10.1073/pnas.1808648115