图片来自Cell期刊,doi:10.1016/j.cell.2017.09.049。
2017年10月22日/基因宝jiyinbao.com/—在一项新的研究中,来自美国麻省理工学院(MIT)的研究人员开发出一种合成基因回路(gene circuit),当该基因回路检测到癌症的迹象时,它激活体内的免疫系统来攻击这种疾病。这种基因回路仅当它检测到两种特异性的癌症标志物时才会激活一种治疗反应。相关研究结果于2017年10月19日在线发表在Cell期刊上,论文标题为“Synthetic RNA-Based Immunomodulatory Gene Circuits for Cancer Immunotherapy”。
人们普遍认为免疫疗法在抵抗一系列癌症中具有相当大的潜力。根据论文通信作者、MIT生物工程与计算机科学副教授Timothy Lu的说法,在最近的几次临床试验中,这种方法已成功地得到证实。
然而,尽管取得了成功,但是免疫疗法的使用仍然局限于肿瘤特异性抗原的缺乏。肿瘤特异性抗原是能够触发对特定癌症产生免疫反应的物质。比如,当作为一种全身疗法给送到全身时,一些免疫疗法的毒性是另一种障碍。
更为重要的是,这种疗法并不是在所有情况下都会取得成功。Lu说,事实上,即便在一些最为成功的试验中,仅30%~40%的患者会对一种给定的疗法作出反应。
基于此,如今就有开发组合疗法的努力:不同的但互补的疗法被用来增强免疫反应。举例来说,如果一种免疫疗法被用破坏癌症产生的一种抑制信号,而肿瘤通过上调第二种信号作出应对的话,那么另一种疗法随后就被用来靶向它。
Lu说,“我们认为有必要开发更加特异性的仅在肿瘤位点局部发挥作用而不是试图进行全身治疗的靶向免疫疗法。其次,我们想要一揽子开发出多种免疫疗法,因此能够以多种不同的方式刺激免疫系统。”
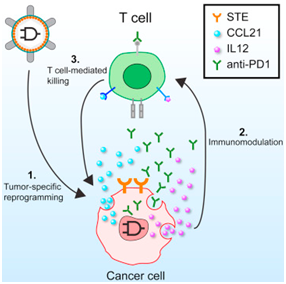
为了做到这一点,Lu、及其包括MIT博士后研究员Lior Nissim和Ming-Ru Wu在内的团队构建出一种编码在DNA中的能够区分癌细胞和非癌细胞的基因回路。
这种基因回路能够经定制对不同的肿瘤作出反应。它是基于电子学中使用的简单的与门(AND gates)构建出的。这种与门仅当两种输入都存在时才会开启。
癌细胞与正常细胞的差异在于它们的基因表达谱。因此,这些研究人员开发出编码在这种基因回路中的合成启动子,即仅启动癌细胞中的基因表达的DNA序列。
利用一种病毒,这种基因回路被运送到体内受影响的区域。肿瘤细胞中有活性的某些蛋白随后结合到这些合成启动子上,从而将它们激活。仅当这两种癌症启动子都被激活时,这种基因回路才会开启。这就允许这种基因回路比现存的疗法更加准确地靶向肿瘤,这是因为在作出反应之前,它需要两种癌症特异性的信号都存在。
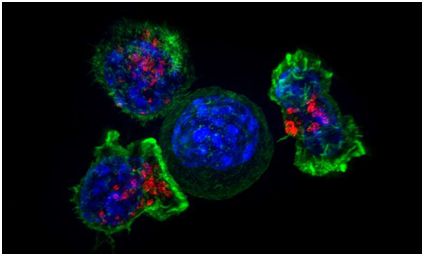
一旦受到激活,这种基因回路表达引导免疫系统靶向肿瘤细胞的蛋白,包括T细胞表面衔接蛋白(surface T cell engagers),这些蛋白引导T细胞杀死这些肿细胞。这种基因回路也表达一种解除对T细胞活性的抑制的检查点抑制剂。
当这些研究人员在体外测试这种基因回路时,他们发现它能够从其他的非癌卵巢细胞和其他的细胞类型中检测到卵巢癌细胞。他们随后在接受卵巢癌细胞移植的小鼠体内测试了这种基因回路,并证实它能够触发T细胞来寻找和杀死这些癌细胞,同时不会伤害它们周围的其他细胞。
这些研究人员还证实这种基因回路经调整后能够很轻易地靶向其他的癌细胞。他们鉴定出乳腺癌选择性的启动子,而且当将它们编码在这种基因回路上时,它会靶向乳腺癌细胞而不会靶向其他的细胞类型。
最终,这些研究人员希望他们也能够利用这种基因回路靶向其他的疾病,比如类风湿性关节炎、炎症性肠病和其他的自身免疫疾病。(生物谷 Bioon.com)
参考资料:
Lior Nissim, Ming-Ru Wu, Erez Pery et al. Synthetic RNA-Based Immunomodulatory Gene Circuits for Cancer Immunotherapy. Cell, Published online: October 19, 2017, doi:10.1016/j.cell.2017.09.049

 基因君官网
基因君官网