2019年12月9日讯/基因宝jiyinbao.com/—今年早些时候,有消息人士向《麻省理工科技评论(MIT Technology Review)》杂志发送了贺建奎(He Jiankui)的一份未发表的论文手稿的副本,该手稿副本描述了制造去年在中国出生的首批经过基因编辑的婴儿—一对称为露露(Lulu)和娜娜(Nana)的双胞胎女性婴儿—的实验过程。这份手稿显示了他在制造露露和娜娜时忽略了伦理规范和科学规范。2019年12月3日,《麻省理工科技评论》首次公开了该手稿的摘录。
这篇未发表的论文手稿标题为“Birth of Twins After Genome Editing for HIV Resistance(基因组编辑后抵抗HIV的双胞胎出生)”,共有4699个英语单词,由中国生物物理学家贺建奎撰写。《麻省理工科技评论》还接受到第二份讨论了关于人类和动物胚胎的实验室研究的论文手稿。
《麻省理工科技评论》收到的这些手稿文件中的描述性文字表明贺建奎在2018年11月下旬对这两份手稿进行了编辑,并且它们似乎是他最初提交的用于发表的论文手稿。在经过至少两个著名期刊Nature和JAMA的评审后,他的论文手稿仍未发表。
这份关于这对基因编辑双胞胎的论文手稿的正文写着可以“控制HIV流行病”的医学突破的说辞。它声称使用一种“新型疗法”在让这两名女性婴儿对HIV产生抵抗力方面取得“成功(这个单词不止一次使用)”。然而令人吃惊的是,它很少尝试证实这对双胞胎确实对这种病毒具有抵抗力。这份论文手稿的正文在很大程度上忽略了该手稿中其他地方存在的表明这种基因编辑出错的数据。
《麻省理工科技评论》与四位专家—一名法律学者、一名试管婴儿医生,胚胎学家和基因编辑专家—分享了这些未发表的论文手稿,并询问他们的评论意见。他们的观点都认为这一做法很不科学,其中包括:贺建奎和他的团队提出的关键主张得不到数据的支持;这对双胞胎婴儿的父母迫于压力才勉强同意参加这项基因编辑实验;所谓的临床益处实在令人怀疑;这些研究人员在完全了解自己进行基因编辑的效果之前就着手制造活的基因编辑婴儿。
由于这些手稿文件关乎有史以来最重要的公共卫生问题之一,即使用基因编辑技术改变人类遗传的能力,因此《麻省理工科技评论》在此公布这份关于这对“基因编辑双胞胎”的论文手稿的摘录,以及这些专家的评论,并解答他们提出的问题。这些摘录按照它们在这篇论文手稿中出现的顺序进行排列。
1.为什么这份论文手稿没有医生名单?
这份论文手稿以作者名单开头—共有10位作者,其中的大多数来自中国南方科技大学贺建奎的实验室,还包括帮助招募艾滋病夫妇的一家艾滋病支持网络组织的负责人Hua Bai和美国生物物理学家Michael Deem。目前,赖斯大学正在审查Deem在这项基因编辑实验中扮演的角色。
参与这项重大计划的人数很少,原因之一是缺少一些人的名字,尤其是治疗患者的不孕不育科医生和分娩婴儿的妇产科医生。隐藏他们的名字可能是试图掩盖患者身份。但是,也不清楚这些医生是否理解他们正在帮助制造首批经过基因编辑的婴儿。
对于一些人来说,这立即就产生了这份论文手稿是否值得信赖的问题。斯坦福大学法学教授Hank Greely说,“对于这份论文手稿报道的任何内容,我们没有或几乎没有独立的证据。尽管我相信这些婴儿很可能是经过DNA编辑后出生的,但针对这方面的证据非常少。鉴于这种情形,我不愿意承认贺建奎是一名诚实的研究员。”
2.这些研究人员自己的数据不支持他们的主要主张
这份论文手稿的摘要列出了这个研究项目的目标—培育出抵抗HIV感染的人—以及取得的主要成果。它指出,贺建奎的研究团队“成功”地能够“复制” CCR5基因中一种已知的突变。一小部分自然出生的具有这种突变(称为CCR5Δ32)的人免受HIV感染。
但是这种摘要远远超出了这份论文手稿中的数据所能支持的范围。具体来说,正如稍后将看到的那样,该团队实际上并未复制这种已知的突变。相反,他们构建出新的突变,这种新的突变可能导致HIV抵抗性,但也可能不会导致HIV抵抗性。根据这份论文手稿,他们从未对此加以验证。
加州大学伯克利分校创新基因组学研究所基因组编辑科学家Fyodor Urnov说,“他们声称复制了这种流行的CCR5突变,这是对实际数据的公然歪曲,只能用一个术语来描述:蓄意捏造。这项研究表明贺建奎的研究团队未能复制这种流行的CCR5突变。胚胎编辑将帮助数百万人的说法既荒谬又可笑,就像1969年的月球漫步‘为数百万寻求在月球上生活的人带来了希望。’”
Eugin集团科学总监Rita Vassena说,“在阅读这份论文文件时,我希望看到一种反思性的、深思熟虑的人类胚胎基因编辑方法。不幸的是,它读起来更像是一个寻找目的的实验,试图找到不惜一切代价在人类胚胎中使用CRISPR/Cas9技术的合理理由,而不是一种为了子孙后代的利益认真、经过深思熟虑、循序渐进地编辑人类基因组的方法。正如目前的科学共识所表明的那样,在现阶段,在注定会导致怀孕的人类胚胎中使用CRISPR/Cas9是不合理和不必要的,不应当继续下去。”
3.对胚胎进行基因编辑不会控制HIV,尤其是在受影响最严重的国家
这份论文手稿的摘要末尾和正文开头是这些作者为他们的研究寻找合理理由的地方。他们提出基因编辑婴儿可以使得数百万人免于感染HIV。《麻省理工科技评论》的评论者将此说法称为“荒谬”和“荒唐”,并指出,即使CRISPR方法能够制造出对HIV有抵抗力的人,但在HIV肆虐的地方,比如非洲南部,这种方法也不太可能行得通。
Rita Vassena说,“这项研究提供的对人类胚胎进行编辑和随后植入以产生妊娠的证据并不充足。正如这些作者所声称的那样,认为经过基因编辑的胚胎可能有朝一日能够控制‘HIV流行病’的想法是荒谬的。事实证实公共卫生措施、教育和广泛使用抗病毒药物可控制HIV流行病。”
Hank Greely说,“这是‘控制HIV流行病’的一种可行方法,似乎很可笑。如果世界上的每个婴儿都获得这种突变(极不可能),它将在20至30年内开始实质性地影响HIV感染,届时我们应该有更好的方法来遏制这一流行病,以及现有的方法即便还不够充分地遏制,也会极大地延缓它。相比于2012年,2017年中国的新增HIV感染病例增加了64%(如果是真的话),这是因为基数很低的缘故。中国的HIV感染率远低于西方国家。这种局势在一些发展中国家仍然更加严重。但是,就此认为这种高科技应对措施可能对这些国家有帮助,这是不合情理的。”
4. 这对双胞胎婴儿的父母可能出于错误原因想要参加基因编辑实验
与某些解释相反的是,在这对基因编辑双胞胎女性婴儿的DNA上使用CRISPR并不是要阻止她们从被感染的父亲那里感染HIV。如这份论文手稿所描述的那样,这是通过精子洗涤(sperm washing)这一成熟技术实现的。相反,这种基因编辑实验的目的是让她们在以后的生活中对HIV具有免疫力。因此,这一实验并未为她们或她们的父母提供明显的即时医学益处。这对夫妇为何会同意参加?原因之一可能是为了获得生育治疗。
Rita Vassena说,“我担心这对夫妻中的丈夫接受这种实验性基因组编辑的原因在于他是HIV阳性的,这是因为人们可以想象这对夫妻承受的不必要的情绪压力使得他们同意接受一项对患者本身及其子女的健康无任何改善但可能会带来负面后果的实验。值得记住的是,HIV感染不会像遗传病那样世代相传;胚胎需要‘抑制’这种感染。因此,采取预防措施,比如用适当的药物控制患者的病毒载量,以及在体外受精期间小心处理配子,可以非常有效地避免HIV传染。当前的辅助生殖技术可确保HIV阳性的男性和女性安全地生育后代,避免水平传播(伴侣之间)和垂直传播(父母与胚胎/胎儿之间),从而使得在这些情况下无需编辑胚胎。实际上,这对参与这项实验的夫妇确实接受了这样的辅助生殖措施,包括对精液进行长时间的清洗,以清除所有可能携带HIV的精液。更长时间的精子洗涤已在全球体外受精实验室和数千名患者中使用了近二十年。根据我们和其他人的经验,这对父母及其未来的孩子都是安全的,并不需要侵入性地操纵胚胎。”
生殖内分泌学家Shane Grove Fertility说,“在中国,HIV阳性会招致重大的社会歧视。尽管有强烈的家庭和社会义务要有一个孩子,但HIV阳性患者没有机会获得不孕不育治疗。在这样的社会环境下开展这项临床研究存在问题,并且它针对弱势患者群体。这项研究是为一种社会问题提供基因治疗吗?这对夫妇没有受到不适当的强迫吗?”
5.这项研究中的基因编辑与赋予天然HIV抵抗力的突变不同
在这项研究中,这些研究人员描述了CRISPR实际上给这对双胞胎带来的改变。他们从体外受精的胚胎中取出了一些细胞以研究它们的DNA,发现旨在让CCR5基因失去功能的基因编辑确实站稳了脚跟。
但是,尽管他们“期待”这些编辑通过让这个基因失去活性而赋予HIV抵抗力,但他们不能确切地知道这一点,这是因为这些编辑“类似于”自然发生的CCR5Δ32突变,但并非完全相同。再者,仅有一个胚胎中的CCR5基因的两个拷贝都被编辑;另外一个胚胎中的仅有一个拷贝被编辑,这充其量只能给予部分HIV抵抗力。
Hank Greely说,“‘成功’在这里显得很浮躁。没有一个胚胎出现这种存在于在数百万人中的CCR5Δ32缺失突变。相反,这些胚胎/最终的婴儿出现了新的突变,它们的作用尚不清楚。同样地,对HIV的‘部分抵抗力’是什么意思?如何衡量这种部分抵抗力?是否足以证明将携带人类中从未见过的CCR5基因形式的胚胎植入到子宫中以进行可能的分娩?”
6.可能还存在其他不想要的CRISPR编辑
CRISPR并不是一种完美的工具。试图编辑一个基因有时会在基因组的其他地方产生其他意想不到的变化。在这项研究中,贺建奎的研究团队讨论了他们对这种不想要的编辑(称为‘脱靶’突变)的搜索,并说他们只找到了一个。
然而,这种搜索并不彻底,这份论文手稿还掩盖了一个关键点:这些研究人员从早期胚胎中提取的任何用于测试的细胞实际上都没有对这对双胞胎的身体做出贡献。剩下的将发生增殖并成长为这对双胞胎的细胞也可能具有脱靶效应,但是在开始怀孕之前无法知道这一点。
Fyodor Urnov说,“这是对实际数据的严重歪曲,同样只能被描述为公然的谎言。从技术上讲,在不破坏胚胎的情形下,不可能通过检查胚胎的每一个细胞来确定编辑后的胚胎是否‘没有显示任何脱靶突变’。对于整个胚胎编辑领域来说,这是一个关键问题,这些作者在此掩盖了这个问题。”
7.治疗这对夫妇的医生可能不知道发生了什么事
包括《华尔街日报》在内的各种新闻媒体的报道都指控贺建奎的研究团队通过更换血液样本来欺骗医生,而且并非所有人都知道他们参与了制造经过基因编辑的婴儿。如果确实如此的话,这就是个问题,这是因为医生有责任做符合患者最大利益的事情。
Jeanne O’Brien说,“无论CRISPR是否用于基因组编辑,体外受精程序都遵循相同的步骤和时间线。这些进行体外受精的中国医生可能没有意识到这名父亲的HIV感染状况,或者这些胚胎是经过基因修饰的。贺建奎只需要一名愿意在授精时注射CRISPR的胚胎学家。他的言辞似乎表明进行体外受精的医生似乎没有参与随后选择要植入的胚胎的决定。这是对参与体外受精的医生的一次警钟:科学技术将继续发展,绝望的不孕不育夫妇可能会忽略未知的风险或相信该技术已被证明是安全的。一旦我们这些治疗不孕不育的医生有意识地移植了经过生殖系编辑的胚胎,我们实质上就是在向父母和未来的孩子确认这种基因修饰的安全性。有可能知道这一点吗?”
8.这份论文手稿歪曲了基因编辑婴儿的出生时间
到目前为止,一些媒体报道和熟悉这项研究的人士已经确定,这对双胞胎出生于十月,而不是十一月。为什么贺建奎的团队给出了错误的日期?这可能是为了保护这对夫妇及其双胞胎的匿名性。在一个中国这么大的国家,每个月可能会有一万多对双胞胎出生。伪造日期可能是为了让重新鉴定他们的身份的企图变得更加困难。
9.不清楚是否有存在适当的伦理审查
这篇论文手稿对伦理进行了非常简短的讨论。它说该研究计划已经在中国临床试验登记处进行了登记,但是实际上这种公开登记仅在这对双胞胎出生后才进行。
Hank Greely说,“何时登记的呢?答案是在2018年11月8日,即这对双胞胎出生后不久和宣布她们出生之前,这可能是为了增加发表的可能性。这不是正常的登记。也许已经获得了伦理批准,不过医院已否认了这一点。谁在说实话?不确定我们是否会知道。针对全面的伦理审查,‘我们被告知’这个短语并不是强有力的证据。这份论文手稿也没有讨论中国禁止HIV阳性父母接受辅助生殖服务的禁令。据报道,为了进行必要的HIV检测,贺建奎让其他男性假装是预定的父亲。这份论文手稿没有谈及这一点。在我看来,这很可能是真的,真是混账。如果确实是真的话,这意味着他欺骗了中国的监管程序。”
10.这些研究人员并未在制造活的基因编辑婴儿之前测试HIV免疫是否有效
在这项研究中,贺建奎的研究团队概述了他们从这对双胞胎那里收集血液的计划,以查看他们编辑过的细胞是否真正地抵抗HIV。在制造这两名经过基因编辑的女性双胞胎婴儿之前,他们本可以尝试提前了解这一点。在植入胚胎之前,他们可以将它们冷冻,同时在实验室对细胞进行相同的编辑并测试HIV对这些细胞的影响。
Fyodor Urnov说,“这就表明这个研究团队把他们的利益置于这对捐献胚胎的夫妇和他们未来孩子的利益之上。这份论文手稿中没有任何证据支持这种新的CCR5突变形式可阻止HIV感染的基本预期。在植入胚胎之前确定这一点至关重要。他们可以使用一种已知的检测方法进行检测:在实验室中对免疫系统细胞进行相同的基因编辑,然后用HIV感染它们。只有携带阻止HIV感染的CCR5变体的细胞才能存活下来。这个研究团队选择不进行这项检测。相反,他们利用携带完全不确定功能影响的CCR5突变形式的胚胎培育出婴儿。这些研究人员赶时间吗?还是他们根本不在乎吗?无论作出何种解释,这种对基本伦理规范和研究准则的严重违反都与犯罪行为相去不远。”
11.一名美国诺贝尔奖获得者可能帮助贺建奎证明他的实验是合理的
这份论文手稿的结论包含了一个意料之外的题外话,为这项研究提出了一个全新的理由,该理由将这个研究项目与非洲HIV流行病的核心地带联系了起来。感染HIV的非洲母亲的许多未感染儿童都患有一种称为‘HEU’的综合征,这使得他们更容易患上各种儿童疾病。这些作者说基因组编辑可能是对抗HEU的‘新策略’。
这个想法没有任何证据,但是有一些关于贺建奎从哪里得到这一点的线索。在一封他于11月22日发送给马萨诸塞大学生物学家Craig Mello(他当时是贺建奎的一家公司的顾问)的电子邮件中,他感谢Mello对这一主题提出的建议,并在他的电子邮件附上了上述同一段文字。
这是否意味着作为2006年诺贝尔医学奖得主的Mello对这份论文手稿做出了重要贡献?Mello很早就被告知有关这个双胞胎项目的消息,但Mello的一名发言人说,他从未就如何撰写这篇论文给贺建奎提出建议。但是,根据贺建奎的电子邮件,任何这样的互动都意味着不被承认。他再次写信给Mello,“我不会告诉别人你知道这里发生了什么。”
12.这个研究项目还有其他的支持者,但缺少一些关键信息
这份论文手稿最后感谢了一批人,根据贺建奎的说法,这些人针对这篇论文正文的初稿给出了直接的反馈或者给出了其他的建议。在对“编辑”这篇论文的正文表示感谢时,他提名了加州大学的研究员Mark Dewitt。Dewitt没有回复贺建奎发送过来的电子邮件,但早些时候描述了他自己的角色,称他已对这个研究项目提出警告。斯坦福大学伦理学家William Hurlbut说,他曾向贺建奎提供伦理意见,但他不知道这名中国科学家制造了基因编辑婴儿。
贺建奎还感谢英国马生殖专家W.R. “Twink” Allen,以及Allen当时的学生Jin Zhang,也就是John Zhang,他现在是纽约新希望生育中心的负责人,该中心是纽约最大的生育中心之一。据报道,Zhang在去年年底计划与贺建奎合作,为基因编辑婴儿开设医疗旅游业务。
在这些名字中,只有Allen的研究之前从未因与这项CRISPR婴儿研究存在关联而被引用。针对通过电子邮件与他联系的尝试,Allen没有给出回复。Zhang一直没有透露自己的角色,他告诉《麻省理工科技评论》,他不熟悉这份论文手稿。他在10月份告诉《麻省理工科技评论》,“我从未见过它。”
《麻省理工科技评论》拥有的这份关于基因编辑双胞胎的论文手稿版本缺少科学论文中通常存在的两个至关重要的披露。首先,它没有提供有关谁资助了这个项目或者这些作者在研究结果中有什么经济利益的信息。它也没有详细介绍每个作者作出的科学贡献。这意味着这篇论文的正文并未明确描述唯一的非华裔作者、赖斯大学的Michael Deem发挥的作用(特别是是否与患者进行任何实际接触)可以决定着Deem或他所在的大学可能面临的惩罚。Deem的律师没有回答任何问题,包括要求提供他过去声明的副本,以尽量减少他在这项研究中的作用。赖斯大学表示,它针对此事的调查正在进行中。
13.这些研究人员忽略了有关基因编辑不一致的证据
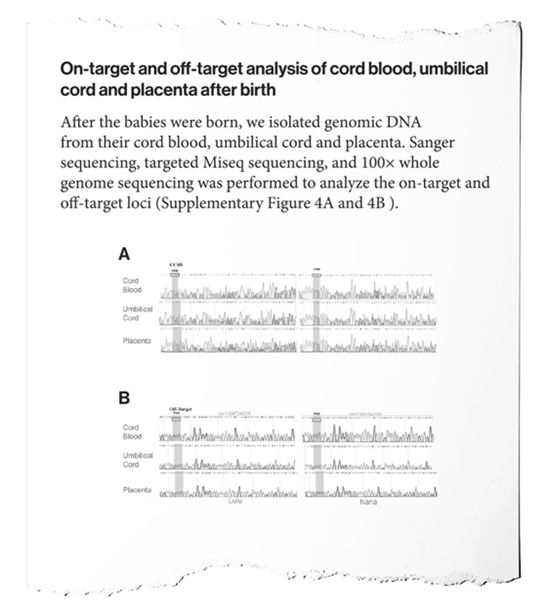
这份论文所附的数据,即所谓的‘补充’材料是贺建奎先前公开显示的表格。这些数据显示当他的研究团队试图测量CCR5基因发生了何种编辑时,在这对双胞胎的胚胎和出生后的组织中发现的DNA序列读出值,即DNA图谱(chromatogram)。
包括Musunuru在内的一些观察者都说这些数据清楚地表明这些胚胎是“镶嵌的”,这意味着胚胎中不同的细胞被不同地编辑。他说,在这些DNA图谱中可以看到多个基因编辑的存在,即在给定的DNA位置上的重叠信号中记录了几个不同的读出值。
这些数据的言下之意就是这对双胞胎的身体可能由用不同方式编辑的细胞的组成,或者根本就不是。Musunuru指出,这意味着仅她们的某些细胞可能具有抵抗HIV感染的基因编辑。这也意味着一些细胞可能具有未检测到的“脱靶”编辑,这可能会导致健康问题。从贺建奎对动物胚胎的实验中可了解到,这种镶嵌问题是众所周知的。这个研究项目的秘密之一是,如果胚胎有这种缺陷,贺建奎为何选择继续利用它们开展实验。
在这份论文手稿中,贺建奎没有解决这个秘密。它仅说,“对所有样品中的CCR5基因进行了深度测序,以检查基因编辑的镶嵌性(mosaicism)。”没有对他的团队发现的东西进行解释,也没有承认这些数据似乎显示出镶嵌现象或这是一种问题。(生物谷 Bioon.com)
参考文献:
China’s CRISPR babies: Read exclusive excerpts from the unseen original research
https://www.technologyreview.com/s/614764/chinas-crispr-babies-read-exclusive-excerpts-he-jiankui-paper/

 基因君官网
基因君官网