2019年1月24日/生物谷BIOON/—来自原核生物CRISPR/Cas系统的酶已被用作可编程的和高度特异性的基因组编辑工具。目前的基因组编辑技术集中在II型CRISPR-Cas系统上,该系统含有单个用于DNA切割的蛋白效应核酸酶。然而,到目前为止,仅有两个II型核酸酶家族用于人细胞中的基因组编辑:Cas9,即一种由两个向导RNA(gRNA)引导的核酸酶,含有两个核酸酶结构域:HNH和RuvC,其中这两个gRNA为CRISPR RNA(crRNA)和tracrRNA;Cas12a,即一种由单个gRNA引导的核酸酶,含有单个结构域:RuvC,其中这单个gRNA为crRNA。
在一项新的研究中,来自美国布罗德研究所的张锋(Feng Zhang)及其团队着重关注第三种II型蛋白效应核酸酶:Cas12b,即一种由两个gRNA引导的核酸酶,含有单个结构域:RuvC,其中这两个gRNA为crRNA和tracrRNA。尽管Cas12b蛋白通常比Cas9和Cas12a小,因而从通过病毒载体进行细胞内递送的观点来看具有吸引力,但是得到最好描述的来自嗜酸耐热菌(Alicyclobacillus acidoterrestris)的Cas12b核酸酶(AacCas12b)在48°C时表现出最佳的DNA切割活性,这阻止它在哺乳动物细胞中的应用。张锋团队试图鉴定出在较低温度下有活性的Cas12b家族成员,这样就可用于人类基因组编辑。相关研究结果于2019年1月22日发表在Nature Communications期刊上,论文标题为“Engineering of CRISPR-Cas12b for human genome editing”。
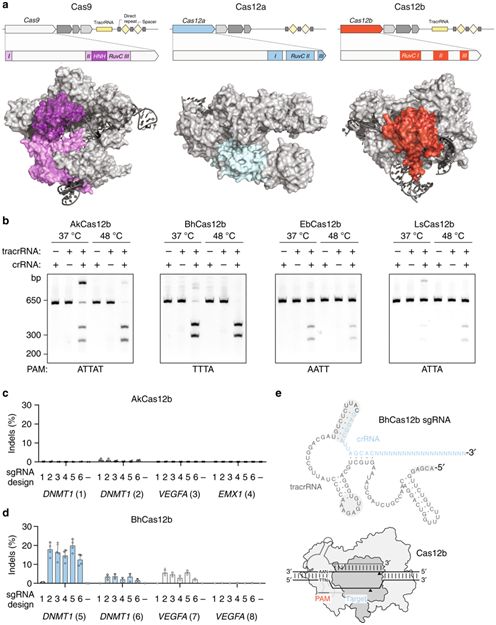
通过利用之前已发现的Cas12b在序列数据库中进行BLAST检索,张锋团队鉴定出27个Cas12b家族成员。他们选择了14个之前未被描述过的Cas12b基因用于实验研究,这样就可避免之前已被描述的Cas12b家族成员和那些来自广为人所知的嗜热菌的Cas12b家族成员。鉴于已知所有的靶向DNA的II型CRISPR–Cas核酸酶仅在位于靶位点两侧的前间区序列邻近基序(protospacer-adjacent motif, PAM)存在时才能进行DNA切割,为了证实已被鉴定出的每个Cas12b基因是功能性的CRISPR-Cas系统并找出它们的PAM序列,他们在大肠杆菌中表达了经过人类密码子优化的带有天然的两侧序列的Cas12b,并将随机的5′ PAM文库导入大肠杆菌转化细胞中。通过深度测序,他们发现在这14个测试的Cas12b基因中,仅4个Cas12b家族成员(AkCas12b、BhCas12b、EbCas12b和LsCas12b)受到影响,这就表明在异源宿主细胞中发生功能性的DNA干扰。
为了在描述这4个Cas12b家族成员的生化性质,张锋团队在体外测试了纯化的Cas12b蛋白与对应的tracrRNA和crRNA组分在一起时的DNA切割活性。为了简化基因递送,他们将引导Cas12b到靶位点上的tracrRNA和crRNA融合成单导RNA (single-guide RNA, sgRNA)。他们发现EbCas12b和LsCas12b具有最小的切割活性,而AkCas12b和BhCas12b在37 °C时表现出最强的切割活性。不过,他们发现在293T细胞中,这两种Cas12b可诱导插入或删除(insertion or deletion, indel)突变,但是indel发生率小于1%。为了增加切割效率,他们改变了tracrRNA和crRNA之间的连接、移除错配的发夹结构以及改变5’起始位点和间隔序列长度,结果发现,这些变化对AkCas12b sgRNA具有较小的影响,但是BhCas12b sgRNA的5’端发生5nt截断可显著地改善BhCas12b对多个靶位点的切割活性,改善幅度高达30倍。
图片来自Nature Communications, doi:10.1038/s41467-018-08224-4。
然而,在检测体外切割反应时,张锋团队发现AkCas12b和BhCas12b偏好切割非靶DNA链,而且这种行为在较低温度时更为显著,这就降低了BhCas12b作为一种用于有效的用于基因组编辑的核酸酶的潜力。为此,他们通过一系列突变实验,发现含有K846R/S893R/E837G突变的 BhCas12b v4突变体在多个位点上表现出最高的切割活性。而且与此相一致的是,纯化的BhCas12b v4突变体在37 °C下表现出增加的dsDNA切割活性,而且带切口的dsDNA显著减少。
鉴于强效的基因组编辑工具应当在一系列靶标上是高效的和特异性的,张锋团队在针对293T细胞中的5个基因的56个靶位点上测试了BhCas12b v4突变体,结果观察到强效的DNA切割。接着,他们通过电穿孔技术将BhCas12b v4-sgRNA复合物递送到人CD4+ T细胞中。在3个测试的靶位点上,这些复合物表现出的indel发生率为32%~49%。这些数据表明BhCas12b v4突变体在多种基因组编辑环境下(包括一种在治疗上有重大意义的人细胞类型)可作为一种有效的可编程的核酸酶。
最终,张锋团队试图确定BhCas12b在人细胞中的全基因组靶向特异性。他们选择了9个在不同Cas核酸酶之间表现出相当的indel活性的靶位点,并进行了Guide-Seq分析。针对BhCas12b v4突变体或AsCas12a,他们并没有检测到任何脱靶位点的存在,然而来自酿脓链球菌(Streptococcus pyogenes)的Cas9(SpCas9)在其中的6个靶位点上表现出显著的脱靶切割。在14个非匹配性的位点上开展的进一步Guide-Seq实验表明BhCas12b v4突变体仅在2个位点上检测到脱靶切割。与这些发现相一致的是,当gRNA和靶DNA之间的位点1~20上发生双位点错配时,他们观察到有限的indel活性,而且对单个位点错配表现出较低的耐受性。这些结果对在人细胞中观察到的较低的脱靶活性提供了一种分子水平上的解释。
综上所述,除了Cas9和Cas12a(之前称为Cpf1)之外,这项新的研究建立了第三种由RNA引导的核酸酶平台,可用于人细胞中的基因组编辑。更重要的是,这种新的平台具有更低的脱靶效应。此外,BhCas12b v4突变体的较小尺寸和较高的靶位点切割特异性使得它成为一种有前景的在体内进行基因组编辑的工具。(生物谷 Bioon.com)
关于张锋:
张锋,男,1982年出生于河北石家庄,斯坦福大学化学及生物工程博士,是当今最为人所关注的华人生物学家之一。他最著名的工作是基因修饰技术CRISPR-Cas9的发展和应用,率先获得了美国专利,并被视为诺贝尔奖的热门人选之一。
张锋于2011年加入麻省理工学院,同时在麦戈文脑科学研究所(McGovern Institute)大脑与认知科学部门,以及布罗德研究所(Broad Institute)从事科研工作。2013年,他的实验室开发出创新性CRISPR/Cas系统,大幅度提高了编辑基因的可靠性和效率,引起国际关注,因其突破性的研究成果,他获得了众多荣誉。
2014年,张锋被《自然》杂志评选为2013年年度十大科学人物之一,2015年获得“年度波士顿人”提名,2016年三月获得加拿大盖尔德纳国际奖。
最近几年,张锋及其团队在CRISPR/Cas领域不断取得新的成果。比如,2016年,他们发现一种靶向作用于RNA而不是DNA的新型CRISPR系统:CRISPR/C2c2。2017年4月,他们将一种靶向RNA(而不是DNA)的CRISPR相关酶(即Cas13a)改造为一种快速的、廉价的和高度灵敏的诊断工具:SHERLOCK(Specific High-sensitivity Enzymatic Reporter unLOCKing),从而有潜力引发研究和全球公共卫生变革。2017年10月,他们发现CRISPR/Cas13可靶向哺乳动物细胞中的RNA,而在同月的另一项研究中,他们将gRNA与一种不同的没有切割活性的核酸酶dCas13和一种将RNA中的A转化为I的天然性酶融合在一起而构建出一种RNA碱基编辑器。2018年2月,他们在SHERLOCK的基础上进一步增加了它的灵敏度,并增加准确地定量确定样品中的靶分子水平和一次测试多种靶分子的能力。
另外,值得一提的是,加州大学伯克利分校和布罗德研究所之间的CRISPR专利纠纷在美国和欧洲仍然酣战不已。这一系列专利专利纠纷更是让张锋闻名于世。(生物谷 Bioon.com)
参考资料:
Jonathan Strecker et al. Engineering of CRISPR-Cas12b for human genome editing. Nature Communications, 2019, doi:10.1038/s41467-018-08224-4.

 基因君官网
基因君官网