2019年4月25日讯/生物谷BIOON/—在作为同类规模最大研究之一的一项研究中,来自英国剑桥大学韦尔科姆基金会桑格研究所和Open Targets等研究机构的研究人员利用CRISPR/Cas9技术破坏了来自30种癌症类型的300多种癌症模型中的每个基因,并发现了癌症存活所必需的数千个关键基因。他们随后开发出一种新的系统,对600个最有希望用于开发治疗方法的药物靶标进行优先排序。这些结果加快靶向治疗药物的开发,并且让科学家们更接近于构建出癌症依赖性图谱(Cancer Dependency Map),即一份详细的精准癌症治疗规则手册,旨在帮助更多患者接受有效的治疗。相关研究结果于2019年4月10日在线发表在Nature期刊上,论文标题为“Prioritization of cancer therapeutic targets using CRISPR–Cas9 screens”。
每两分钟,在英国就有人被诊断出患有癌症,并且在每两个人中,就有一人在生命的某个阶段患上癌症。手术摘除、化疗和放疗通常用于治疗癌症,然而虽然它们可以有效地杀死癌细胞,但是一些患者对治疗没有反应,而且健康组织也会遭受损伤,从而导致患者出现不想要的毒副作用。科学家们和制药公司正在探索选择性地杀死癌细胞但不让健康组织受到损伤的新型靶向疗法。
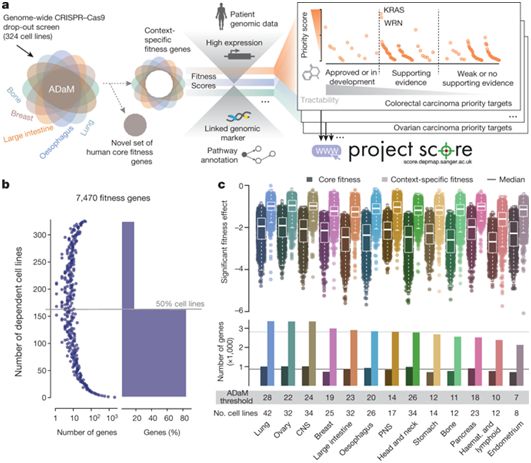
在这项新的研究中,这些研究人员对癌基因开展了迄今为止最大规模之一的CRISPR/Cas9筛选,破坏了来自30种癌症类型的300多种癌症模型中的将近2万个基因,以便发现哪些基因对癌症存活至关重要。他们专注于常见的癌症(比如,肺癌、结肠癌和乳腺癌)和因临床需求特别未被满足而迫切需要新型治疗方法的的癌症(比如,肺癌、卵巢癌和胰腺癌)。
这些研究人员鉴定出数千个关键的癌基因并开发了一个优先排序系统,将这个癌基因列表缩小到大约600个最有希望用于药物开发的基因。
存在于多种不同癌症类型中的一种排序最高的靶标是沃纳综合征RecQ解旋酶(Werner syndrome RecQ helicase, WRN)。这些研究人员发现,DNA修复途径有缺陷的癌细胞—微卫星不稳定性癌症(microsatellite unstable cancer)—需要WRN才能存活。微卫星不稳定性发生在许多不同的癌症类型中,包括15%的结肠癌和28%的胃癌。新发现的WRN作为一个有希望的药物靶标,为开发首批靶向WRN的癌症治疗方法提供了一个令人兴奋的机会。
论文共同通讯作者、韦尔科姆基金会桑格研究所的Kosuke Yusa博士说道,“CRISPR/Cas9是一种非常强大的工具,它使得我们能够以五年前无法达到的规模和精确度进行科学研究。通过CRISPR,我们发现了一个非常令人兴奋的机会来开发针对癌症的新药。”(生物谷 Bioon.com)
参考资料:
Fiona M. Behan et al. Prioritization of cancer therapeutic targets using CRISPR–Cas9 screens. Nature, 2019, doi:10.1038/s41586-019-1103-9.
 基因君官网
基因君官网