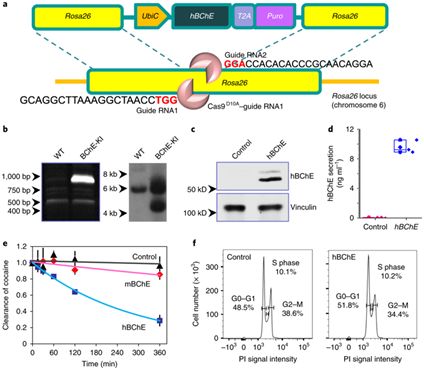
2018年7月23日,燃石医学的肿瘤NGS检测试剂盒获批。在其后的几个月里,诺禾致源、世和基因和艾德生物的同类试剂盒也相继获批。NMPA对肿瘤NGS检测试剂盒的放行,不仅表示其对此种试剂盒的认可,也标志着肿瘤基因检测行业从初生逐步走向成熟。
经过近十年的发展,肿瘤基因检测已经从不知所云的高新技术,成为了大量肿瘤患者的刚需。肿瘤基因检测提供的检验内容完美契合了精准医疗的发展理念,并且已经可以深入到肿瘤患者诊疗的各个环节当中。
动脉网认为,目前肿瘤基因检测行业虽然已经在治疗阶段站稳脚跟,但是从患者覆盖率上看,还有极大地发展空间值得挖掘。在未来如果肿瘤基因检测完全覆盖预防-早筛-治疗-复发的全流程,必将会是一个千亿级的市场。
根据动脉网知识库的监测,共有77家企业正在提供以二代测序技术为基础的肿瘤基因检测服务,其中既有像燃石医学、世和基因这样以肿瘤基因检测为主要发展方向的企业,也有像华大基因、贝瑞基因这样的基因检测巨头。
报告核心提示:
1.报告对目前国内正在从事肿瘤基因检测的77家公司进行了分类和统计,统计内容包括融资情况、产品类型、检测靶标、切入诊疗阶段等多个方面,并根据统计内容进行了进一步的数据分析,从客观角度上描述了目前肿瘤基因检测行业的市场情况。
2.根据产品价格、患者数量、患者覆盖率等数据对肿瘤基因检测行业的当前市场规模进行了估算。
3.对肿瘤基因检测行业未来可能发生的重心迁移进行了预测。预计肿瘤基因检测行业的中心可能会沿诊疗流程逐步前移,尤其是从治疗端向早筛方向延伸。
以下是报告内容节选:
一、恶性肿瘤发病率概况:肺癌领跑,性别差异大
2018年,中国癌症预防与控制办公室联合多家机构,在《Chinese Journal of Cancer Research(中国癌症研究进展)》上发表论文“Cancer incidence and mortality in China,2014(中国癌症发病与死亡情况2014)”。论文通过对339家癌症注册机构的数据统计,覆盖了全国约21.07%人口的数据,对2014年我国癌症发生和死亡的总体情况进行了估算。
二、基因检测与传统检测:各有优劣,取长补短
肿瘤基因检测可以切入到肿瘤诊疗的各个环节中。尤其是在治疗阶段,已经成为了部分肿瘤患者的刚需产品。与传统检测方案相比,肿瘤基因检测已经表现出了多个方面的优势。首先,从检测目标上,肿瘤基因检测既可以直接检测肿瘤组织,又可以通过液体活检检测血液中的肿瘤内容物。灵活的检测方法选择让肿瘤基因检测可以应对大多数患者的需求。其次,肿瘤基因检测可以直接检测到肿瘤中的突变位点,即肿瘤发生的根本原因。这使得肿瘤诊疗过程可以更加针对肿瘤特点,也使肿瘤基因检测成为了指导靶向药物使用的不二选择。第三,定制化的检测方案可以直接针对患者的肿瘤特点入手,为医生推荐最佳的治疗方案。
三、组织活检与液体活检:基因检测数据来源
四、肿瘤内容物:肿瘤遗传信息的载体
五、肿瘤基因检测应用场景:切入肿瘤诊疗全过程
六、肿瘤基因检测行业产业链结构
与其他的基因检测行业类似,肿瘤基因检测行业的上中下游关系明朗。上游由基因检测相关用品供应商组成,为中游的肿瘤基因检测公司提供测序仪器、测序耗材、测序试剂等产品。中游的检测公司则向下游包括肿瘤易感人群、肿瘤患者和医生在内的用户群体提供相应的基因测序服务。
癌症测序服务公司针对不同的用户需求,通过不同的测序样品和测序目标,提供不同的测序服务类型。通过检测个人基因序列,为有家族病史的肿瘤易感人群提供肿瘤易感基因检测服务;还可以通过检测血液中的肿瘤内容物或直接检测肿瘤样本,提供更多针对肿瘤患者和医生的服务类型。
七、肿瘤基因检测行业生态图谱
肿瘤基因检测行业的上游与基因检测行业一样,主要是测序仪器、耗材、试剂供应商。在测序行业中,Illumina是当之无愧的行业龙头。2018年11月1日,Illumina宣布收购Pacific Biosciences。这笔交易的达成意味着Illumina在未来将继续保持自身在测序行业的垄断性优势。华大智造在近几年连续推出了数款基因测序仪器,有部分基因检测公司正在试用。反馈出的数据对于国产测序仪还是表现出了积极的态度。如果国产测序仪的定价较低,有机会依靠自身的高性价比,对基因测序市场发起冲击。
中游的测序服务公司目前同质化较为严重。多数公司缺乏旗帜鲜明的特点,都用同样的手段,提供着类似的服务。头部企业不明显使得我们很难以某种标准来对行业内的企业进行分类和归纳。因此目前我们只能以公司是否以肿瘤基因检测产品为主要业务方向,将参与到肿瘤基因检测行业的公司划归两类。
不以肿瘤基因检测为主营业务的公司,不代表其肿瘤基因检测相关业务水平差。这一类企业中也有像华大、贝瑞、安诺优达这样赫赫有名的基因检测企业,其肿瘤基因检测方面的业务水平不输很多主营肿瘤基因检测的公司。这些公司在肿瘤基因检测行业中同样占有一席之地,只是其发展历程和融资情况并不能很好的代表肿瘤基因检测行业的发展状况。
八、肿瘤基因检测行业市场规模
从目前的市场角度上看,治疗阶段的肿瘤基因检测产品作为目前的刚需产品,其市场规模较为稳定,并且也相对容易测算。2018年全年我国预计会有450万人新发恶性肿瘤,其中约5%的患者会使用肿瘤基因检测产品,平均每人在肿瘤基因检测产品上的开销在8000元左右,据此估计市场规模下限在18亿元。而除此之外还有包括预防、早筛、复发监控等非刚需产品。估计肿瘤基因检测行业目前的市场规模在20-30亿元。
不论从患者覆盖率的角度上,还是从业务拓展的角度上,目前肿瘤基因检测行业的发展潜力都还非常大。肿瘤早筛和肿瘤复发监控还没成为诊疗过程中的常规项目,肿瘤患者群体中的检测覆盖率也只有5%上下。随着技术的发展和社会认可程度的提高,相信肿瘤基因检测行业的千亿级市场不仅仅是一纸空话。
九、企业案例
本报告所选案例不代表行业头部企业,企业先后顺序无特殊含义
优迅医学2015年在北京成立,至今已近完成了两轮总计2.1亿的融资,投资方包括高特佳投资、险峰旗云、中信国安资本等。
优迅医学目前和国内遍及30个省市自治区的1500多家医院保持着良好的合作关系,其中不乏行业顶尖的科研型医院和地区三甲医院的翘楚。双向发展是优迅医学的特点,出生缺陷+肿瘤基因检测;CTC+ctDNA;实体瘤&血液病。这种发展模式极大地丰富了优迅医学的产品线,使其产品的受众更广,而且不同的方向之间可以互相补偿。特别值得一提的是,优迅医学在2017年获得营收1.7亿,并已经成功实现盈利。18年业务稳定增长,根据前三季度财务数据,全年收入预计将超2亿元。
优迅医学是国内少有的选择了出生缺陷和肿瘤基因检测双路径发展方式的公司之一。优迅医学是国内最早介入NIPT行业的公司之一,并已经成功通过NIPT实现了盈利。优迅医学不仅保持着自身在NIPT行业的竞争力,还持续的保持着对技术方法上的创新。2017年11月优迅的NIPT新算法文章发表于临床遗传学领域最好的杂志之一Genetics in Medicine(IF=9.937),是NIPT上市以来唯一一篇方法学重大革新类文章;在2018年三月的第十三届国际基因组学大会上,优迅题为”Power of Bayesian Noninvasive Prenatal Screen on BGISEQ-500 data”的研究入选壁报展示。该研究证实了优迅基于贝叶斯理论的NIPT算法同样适用于BGISEQ-500(华大国产测序仪型号)的数据,并且相较传统Z检验方法,能更好的排除母体微缺失微重复对于三大染色体异常结果的判定。
在NIPT行业获得的成功使得优迅有能力在肿瘤基因检测产品研发上做出更大的投入。到目前为止优迅医学提供的肿瘤基因检测产品类型已经几乎覆盖了患者诊疗全过程,并且是国内唯一搭建了ctDNA&CTC液体活检双平台的基因检测公司。而在研发方面,肿瘤早筛是优迅医学的重点关注内容,目前在一期临床试验中已经取得了喜人的成绩。除此之外,优迅医学还与中国癌症基金会合作,在ctDNA检测方面开展大规模肿瘤精准医疗临床科研项目。
优迅医学的CEO周晔博士是新墨西哥大学的生物医学PhD,在美国希望之城多年从事肿瘤的机理及科研临床转化领域的工作,在CTC、ctDNA、肿瘤二代测序技术方面有着丰富的临床经验。除周晔博士外,优迅医学的首席科学官关永涛教授带领的科技团队研发出的应用于液态活检的ESRiT技术、基于贝叶斯理论的NIPT新算法、基于低深度WGS的泛肿瘤CCeS早筛模型,均在行业中保持领先,并能够在一定的时间内持有技术壁垒。
产品情况
优迅的肿瘤基因检测产品主要分为肿瘤专项基因体检、优替、优旭和优睿,分别对应肿瘤预防、肿瘤治疗/预后、CTC&ctDNA检测和血液肿瘤检测,此外还有正在进行临床研究的早筛产品。优迅医学在液体活检技术上的长足优势和覆盖诊疗全过程的产品线,使得优迅医学可以实现“早期筛查诊断+个体化治疗指导+全程动态监控”的癌症精准诊疗全业务线模式。
A. 泛癌种无创早期筛查
目前市面上提供肿瘤早筛的企业不在少数,但是还没有出现基于中国人基因特点,安全有效并且价格合适的泛癌种早筛产品。为了解决这些问题,优迅医学建立了一种低成本、便于操作、准确、可针对泛癌种的CCeS三维泛肿瘤早筛分析方法。该方法从cfDNA浓度、CNV模式及error Spectrum三个角度分析数据建立早筛模型,以实现在低深度的情况下通过模型进行筛选,实现早期肿瘤信息的捕获。优迅医学已经在对健康个体,良性疾病患者和不同阶段的癌症患者进行低至0.5X的全基因组测序中,证明了使用低深度WGS进行癌症筛查的可行性。
根据优迅医学的披露,肺癌研究共207例样本入组,乳腺癌研究共入组212例样本。研究结果表明,该分析方法在针对健康人群、早期患者、中晚期患者的样本比对中,在准确性、敏感性、特异性三个方面均得到了较好的印证。多数检测有效率在90%以上,最低值也超过75%。对比常规检测使用的肿瘤标志物方法,其灵敏度和特异性都有大幅提升,并且不受肿瘤原发部位的影响。
目前该项临床研究仍在进行当中。优迅医学将在随后的研究中,继续验证这一方法的优越性。
B. 优替
优替是优迅医学针对治疗和预后部分的产品,主要包括肿瘤个性化治疗基因检测、乳腺癌21基因检测和肿瘤细胞微卫星不稳定性检测。肿瘤个性化治疗基因检测是其中的重点内容,主要服务于肿瘤患者,为肿瘤患者提供精准治疗意见。优迅医学根据不同癌种和检测内容的多寡制定了多个不同的方案以服务不同种类的患者,其中适用癌种最广、覆盖治疗类型最多的肿瘤全景观测包括125个靶向药物基因、60多个化疗药物基因、370个肿瘤信号通路基因和54个遗传易感基因,以及PD-L1、TMB检测等。丰富的检测内容为肿瘤患者精准医疗的实现提供了切实的帮助。
C. 优旭
目前临床已经广泛认可ctDNA液体活检在指导用药的中的作用。为贴近临床,优迅医学开发了小、中、大三种panel的检测产品,来应对不同患者的不同需求。单癌种小panel的检测主要专注于常见癌种,检测内容涵盖常用的靶向药物和化疗药物,属于最高性价比的一款;中等panel大小的检测产品包含多癌种,在小panel检测内容的基础上扩展到相关信号通路的基因情况,从有效性和毒副作用两方面提升用药信息参考性;全方位检测的大panel产品,则可以涵盖所有FDA目前已批准的靶向药物,同时结合化疗药物相关基因、遗传易感情况、信号通路相关基因等,通过多维度的信息分析,给出最佳的治疗方案建议。
除了个性化用药之外,优旭还包括ctDNA&CTC预后评估和动态监测。针对肿瘤患者,通过ctDNA&CTC双平台检测,为患者提供完整的术后检测内容,包括预后分析、疗效监测、耐药性分析、病程评估等。主要应用于肺癌、胃癌、乳腺癌领域。优迅医学的CTC检测,通过结合双向筛选和肿瘤特异性基因表达水平检测,使得检测效率获得了大幅提升。目前其临床试验在乳腺癌、结直肠癌等癌种的病程监控和甲状腺癌的良恶性鉴别上,都表现出了良好的应用前景。
D. 优睿
优迅医学是市场中少数提供血液肿瘤基因检测的公司之一。在血液肿瘤基因检测大多使用PCR试剂盒的情况下,优迅医学着眼未来,开发了基于NGS技术的血液肿瘤检测产品。使用NGS进行血液肿瘤融合基因、点突变及个性化微残的检测,相比于传统的PCR技术,可以为患者提供更全面的检测结果,实现更加精准的预后分析,并提供更加有效的治疗方案。
2.元码基因
元码基因2014年在北京成立,曾在2015年和2016年进行过天使轮和A轮的融资,投资方包括华人创投、合源资本、雅惠精准医疗基金等,具体融资额未披露。2018年1月,元码基因在新三板上市。
在肿瘤基因检测行业发展的开端,企业的推广模式主要是线下销售团队或者是通过与专家合作进行大panel的基因检测。而元码基因则走出了第三条路,通过与医院共建实验室的方式进行市场推广。国内90%以上的三甲医院都没有独立检测中心,在实验室检测方面需求旺盛。元码基因正是看准了医院的这种需求,采取共建实验室的模式,将自己的产品推送进医院系统。与其合作的医院遍及全国。东到山东,西至新疆,北及黑龙江,南临海南,均有元码基因的足迹。这样的经营模式可能在发展初期需要大量的资本投入,但是从长远角度上看,此种经营模式更具有可持续性,并且也使元码基因与医院之间的关联更加紧密。
元码基因的创始人田埂博士,毕业于中国科学院研究生院。田埂博士在创业之前历任清华大学基因组与合成生物学中心主管,华大基因华北区第一负责人,天津华大创始人法人总经理,深圳华大基因研究院研发副主管。多年的学术底蕴和测序行业的工作经验令田埂博士对精准医疗行业深谙其道。在清华工作期间,一个偶然的机会令田埂博士了解到国内临床需求与临床资源有限的矛盾,于是毅然决定投身实业。其创业契机也促成了元码基因这种以共建实验室为主的经营模式。
产品情况
元码基因提供的肿瘤基因检测产品主要分为两大类,一是肿瘤精准医疗系统解决方案,二是10K液体活检检测方案。元码基因的产品中大量的使用了最新的ddPCR技术。这项技术可以对样品进行维滴化处理,将大量稀释后的样品分至芯片的微反应器中,使得每个反应器的核酸模板数量少于或等于一个,以此完成对于核酸分子的绝对定量。ddPCR的应用使得元码基因的检测结果更加精确,也表现出了元码基因精益求精的服务态度。
肿瘤精准医疗系统解决方案中主要提供了三个产品类别,济康、济克和济安,分别对应肿瘤防治进程中的预防和早筛、治疗、动态监控。这个大类的产品主要是常规的肿瘤基因检测项目,包括广谱的遗传性筛查、适应不同人群的用药基因检测、耐药监控、定制基因动态监控和CTC肿瘤复发监控等产品。肺癌和消化系统癌种是元码基因主要的关注方向,而广谱检测则基本可以覆盖大多数的实体瘤癌种。
10K液体活检检测方案是元码基因在2016年5月整合创立的新内容,主要是针对ctDNA的液体活检产品。其中“10”代表十毫升血液,“10K”则意味着10K分之一的灵敏度,也就是ctDNA液体活检灵敏度的极限。10K液体活检检测方案现在已经可以用于肿瘤的早筛早诊、治疗、病情检测、复发转移等多个阶段。这一产品的优越性尤其体现在早筛早诊方面,已经可以涵盖34种癌症相关的50个驱动基因的2855个基因突变,进而通过分子分型,帮助受检者制定个体化治疗方案,筛选靶向药物。
3.海普洛斯
海普洛斯2014年在深圳成立,至今已经完成了4轮共计4.7亿元的融资(数亿以一亿计),投资方包括山蓝资本、优选资本、可信资本、软银中国、深创投等。海普洛斯也是软银和深创投在精准医疗和液体活检领域中国布局的唯一企业。
与上述企业都不同的是,海普洛斯并不仅仅面向临床,面向科研的测序项目也是海普洛斯关键的业务组成部分。科研产品在检测内容和检测深度上与临床产品有较大的不同。科研产品往往检测深度较深,检测目标也不仅限于CTC和ctDNA,还会包括miRNA、lncRNA等目前尚未登陆临床的其他肿瘤内容物。这对于基因检测公司的检测团队能力有着极高的要求,海普洛斯在科研行业活动的开展,也表现出其对自身团队水平的自信。
海普洛斯的创始人许明炎博士毕业于美国新墨西哥大学,是哈佛大学的访问学者。许明炎博士师从哈佛大学“三院院士”George Chunch实验室的Jeremy Edwards教授,具有十余年基因测序技术和测序仪器研发经验,曾参与多款二代测序仪的研发。因此海普洛斯的研发道路多向技术靠拢,自主研发的CUBE-ctDNA测序技术、HAPCap基因捕获技术等多项先进液体活检技术,达到行业顶尖水平。
产品情况
海普洛斯的主要产品系列是HapOnco,包括了大多数的肿瘤基因检测产品类型。既有泛肿瘤的用药基因检测产品,也有几个常见癌种的小范围检测产品。其中最大panel的泛肿瘤基因检测产品可检测高达451种相关基因,包括肿瘤靶向用药基因、信号通路相关基因、化疗位点基因、MSI区域基因、病毒序列基因等。
海普洛斯在2015年就提出了中国首个大型癌症“精准医疗”计划,目前已经基本完成。该计划针对肺癌、乳腺癌、结直肠癌、胃癌、肝癌这五个高发癌种,旨在实现10000人的癌症早期筛查、预后监测、个体化用药指导,建立中国首个大型癌症数据库,为实现精准医疗奠定基础。
在万人计划之后,海普洛斯又相继提出了绿肺计划和肠康计划。两项计划都以ctDNA检测为技术基础,利用液体活检技术无创、实时、灵敏度高、特异性强的特点,对参与计划的患者进行全病程的系统化管理。这两项计划的主旨在于建立一个超过10万例的中国人群基因数据库,为后期的精准医疗落地打下坚实的基础。
这些计划的提出和实施表明了海普洛斯着眼未来的战略企图。这些计划的实施使得海普洛斯在很长一段时间内都可能会需求大量的资金支持,但是从长远角度上看,基础数据的积累对于肿瘤基因检测产品的研发具有不可替代的关键作用。这些数据库的成型可能会拉开海普洛斯与同类企业之间的技术差距,为海普洛斯在下一阶段的竞争中取得优势。(生物谷Bioon.com)
小编推荐会议 2019先进体外诊断行业峰会
http://meeting.bioon.com/2019ivd?__token=liaodefeng

 基因君官网
基因君官网