2018年11月27日/生物谷BIOON/—2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿—一对双胞胎女性婴儿—在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。
这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
一名美国科学家说,他参与了中国的这项研究,但是这类的基因编辑在美国是被禁止的,这是因为DNA变化能够传递到下一代,因而有风险伤害其他的基因。但是,许多主流科学家认为这种尝试太不安全了,而且有些科学家谴责中国的这项研究是人体实验。
贺建奎说,他在生育治疗期间改变了7对夫妇的胚胎,到目前为止仅导致一次成功的怀孕。他说,他的目标不是治愈或预防遗传疾病,而是试图赋予人们很少天然具有的特性—抵抗在未来可能发生的HIV(即艾滋病病毒)感染的能力。他说,所涉及的成功怀孕的夫妇拒绝透露姓名或接受采访,而且他也不会透露他们住在哪里或在哪里工作。
图片来源:ep.bmj.com
迄今为止,还没有人独立证实贺建奎的研究结果,而且他也没有在期刊上发表,因而也不会受到其他专家的审查。他周一(即2018年11月26日)在中国香港向周二开始的国际基因编辑会议的组织者之一透露了他的研究结果,而且稍早前在接受美联社的独家采访中也透露了这一点。
他告诉美联社,“我感到有责任不仅要做第一个吃螃蟹的人,而且要做一个榜样。社会将会决定下一步该做什么。”
一些科学家对听到这一说法感到震惊并对这一点进行了强烈谴责。美国宾夕法尼亚大学基因编辑专家和Genetics期刊编辑Kiran Musunuru博士说,这是“不合情理的……在人类身上开展在道德或伦理上站不住脚的的实验”。
美国斯克里普斯研究转化研究所主任Eric Topol博士说,“这太不成熟了。我们正在处理人类的操作指令。这是一个大问题。”
不过,作为一名知名的遗传学家,美国哈佛大学的George Church为试图进行阻止HIV感染的基因编辑进行辩护,他将HIV称为“一种主要的不断增加的公共卫生威胁”。在谈及这种目标时,他说道,“我认为这是合理的。”
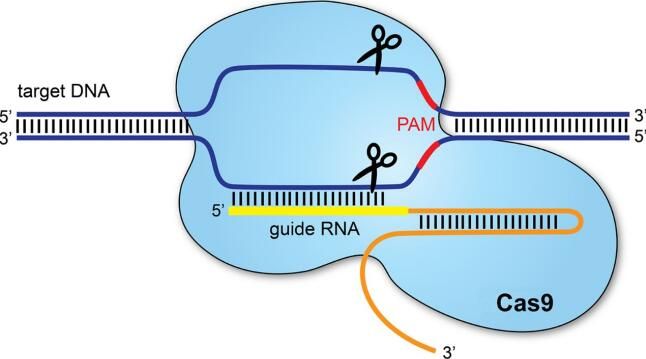
近年来,科学家们发现了一种相对简单的方法来编辑基因—一段具有特定功能的DNA链。基因编辑工具CRISPR-Cas9使得通过操纵DNA来提供所需的基因或者让致病性的基因失去功能成为可能。它仅在近期才被尝试着用于治疗成年人所患的致命性疾病,而且所产生的DNA变化仅限于那个接受基因编辑的人。对精子、卵子或胚胎进行编辑则不同—所产生的DNA变化是可遗传的。在美国,除在实验室研究外,进行这样的基因编辑是不允许的。中国禁止人类克隆,但并不特别禁止基因编辑。
贺建奎在美国赖斯大学和斯坦福大学深造过,然后返回祖国在深圳成立的南方科技大学成立了一家实验室。他在深圳还创建了两家遗传公司。在贺建奎返回中国后,与他一起工作的这名美国科学家是物理学和生物工程学教授Michael Deem,Deem是贺建奎在赖斯大学求学时的学业导师。Deem在贺建奎创建的这两家遗传公司中拥有“少数股权”,而且还是这两家遗传公司的科学咨询委员会成员。
贺建奎表示,多年来,他在实验室中已对小鼠、猴子和人类胚胎进行了基因编辑,并且针对他的方法申请了专利。
贺建奎说,他选择对人类胚胎进行基因编辑是为了阻止HIV感染,这是因为HIV感染在中国是个大问题。他试图让一个称为CCR5的基因失去功能,这是因为这个基因编码的蛋白是导致艾滋病(AIDS)的HIV病毒侵入人类免疫细胞的门户。他说,这个研究项目中的所有男性都感染上HIV,所有女性都没有,不过开展这种基因编辑的目的并不是为了阻止较低的传播风险。这些男性体内的HIV感染受到标准HIV药物的深度抑制,并且有一些简单的不涉及改变基因的方法来阻止他们携带的HIV病毒感染他们的后代。相反,他开展这种基因编辑的目的是给受HIV影响的夫妇提供一个可能保护孩子免受类似命运的机会。为此,他通过北京艾滋病公益组织“白桦林(Baihualin)”招募了一对夫妇。该组织的化名为“Bai Hua”的负责人告诉美联社,HIV感染者在他们的感染被发现后失去工作或很难得到医疗救助的情形并不少见。
以下是贺建奎描述这项研究是如何开展的:
这种基因编辑发生在体外受精(IVF)或者说实验室培养皿受精期间。首先,精子经“清洗”后与它的精液分离开,这是因为HIV有可能潜伏在精液中。将单个精子放入单个卵子中,从而产生胚胎。随后往所产生的胚胎中添加基因编辑工具CRISPR-Cas9。
当胚胎3~5天大时,取出胚胎中的一些细胞以便检查基因编辑情况。参加这项研究的夫妇可选择是否使用经过基因编辑或未经过基因编辑的胚胎进行怀孕尝试。贺建奎说,总共在22个胚胎中,有16个发生了基因编辑,在6次植入尝试中使用了11个胚胎,最终成功实现了这个双胎妊娠。
贺建奎说,测试结果表明在这对双胞胎婴儿中,一名婴儿的两个CCR5基因拷贝都被改变,另一名婴儿的仅一个CCR5基因拷贝被改变,不过没有证据表明这会对其他基因造成伤害。
有一个CCR5基因拷贝的人仍然能够感染上HIV,尽管一些非常有限的研究指出一旦遭受HIV感染,他们的健康状况可能会下滑得更慢。
一些科学家审查了贺建奎向美联社提供的材料,并说道迄今为止的测试结果不足以说明这种基因编辑发挥了作用或者不会对其他的基因带来伤害。他们还注意到,有证据表明这种基因编辑并不充分,而且在这对双胞胎婴儿中,至少有一名婴儿看起来是由携带着发生不同DNA变化的细胞拼凑而成的。
Church说,如果仅有一些细胞发生改变,那么“这几乎就像没有发生基因编辑一样”,这是因为HIV感染仍然会发生。
Church和Musunuru质疑允许其中的一个胚胎用于怀孕尝试的决定,这是因为贺建奎及其团队表示他们事先知道存在两个CCR5基因拷贝都没有被改变的情况。
Musunuru说,“在那名婴儿身上,在阻止HIV感染方面几乎没有什么收获,但是你却让那名婴儿处于全所未知的安全风险之中。”
Church说,使用这个胚胎(指的是两个CCR5基因拷贝都没有被改变的胚胎)表明这些研究人员的“主要重点是测试基因编辑,而不是避免这种疾病”。
即使这种基因编辑表现完美,缺乏正常CCR5基因的人也会面临着感染上某些其他病毒(如西尼罗河病毒)和死于流感的风险。Musunuru说,鉴于有很多方法来阻止HIV感染,而且如果发生HIV感染,它也是可以治疗的,因此,因缺乏正常CCR5基因而产生的其他医疗风险也是令人担忧的。
人们对贺建奎提及他取得进展的方式也存在疑问。在开展他的研究很久后,他于2018年11月8日在中国的临床试验登记处,正式通报了他的研究。
迄今为止,人们尚不清楚这项研究的参与者是否完全理解它的目的以及它的潜在风险和益处。比如,知情同意书将这个研究项目称为“艾滋病疫苗开发(AIDS vaccine development)”计划。Deem说,当候选参与者表示同意并且他“绝对”认为他们能够理解这些风险时,他就在中国。Deem说,他曾与贺建奎在赖斯大学一起从事疫苗研究,并认为这种基因编辑类似于疫苗。他说,“这可能是外行人描述它的方式。”
Deem和贺建奎都是物理专家,没有开展人体临床试验的经验。
贺建奎说,他个人明确了这些目标,并告诉参与者,胚胎基因编辑之前从未尝试过,而且存在风险。他说,他还为这个研究项目中怀上的任何婴儿提供医学保险,并且计划对这些婴儿进行随访,直到他们年满18岁甚至更长时间(如果他们成年后同意的话)。
贺建奎承认,在当前的怀孕尝试安全性得到分析和这个领域的专家进行权衡之前,进一步的怀孕尝试暂停了,不过的确没有提前告知这些参与者一旦获得“第一次怀孕尝试”后,他们可能没有机会尝试他们签约的内容。免费生育治疗是他们达成的交易的一部分。
贺建奎说,针对他的研究项目,他寻求并获得深圳和美妇儿科医院(Shenzhen Harmonicare Women’s and Children’s Hospital)的批准,不过这家该医院不是他所说的为他的研究或怀孕尝试提供胚胎的四家医院之一。在提供胚胎的四家医院中,几家医院的一些工作人员对这项研究的性质一无所知,贺建奎和Deem说,这样做是为了阻止一些参与者的HIV感染被披露。
作为深圳和美妇儿科医院伦理小组的负责人,Lin Zhitong说,“我们认为这是合乎道德的。”
贺建奎说,任何处理样本的医务人员都知道样本中可能含有HIV。作为贺建奎实验室的一名胚胎学家,Qin Jinzhou向美联社证实,他做过精子清洗,并且在一些怀孕尝试中注射了基因编辑工具CRISPR-Cas9。
贺建奎说,这项研究的参与者虽然不是伦理学家,但是“针对什么是正确的什么是错误的,他们也有同样的发言权,这是因为这关系到他们的生活。”
贺建奎说,“我相信这将有助于这些家庭及其子女。”如果它引起不必要的副作用或伤害,“我会感受到与他们一样的痛苦,这将是我自己的责任。”(生物谷 Bioon.com)
参考资料:
First gene-edited babies claimed in China
Gene-edited baby claim by Chinese scientist sparks outrage

 基因君官网
基因君官网