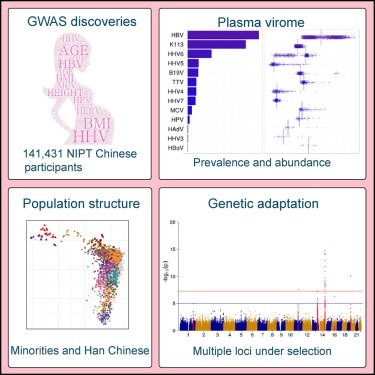
2018年10月7日/生物谷BIOON/—在一项新的研究中,通过分析全球最大的涉及141431名来自中国各地的孕妇的基因组数据,来自中国深圳华大基因等研究机构的研究人员发现了基因与出生结果(包括双胎妊娠和女性第一次怀孕时的年龄)之间存在意想不到的关联。这种分析还允许这些研究人员重建中国不同种族群体在近代的人口流动和通婚,并有望有助于鉴定出让人们容易患上传染病的基因。相关研究结果发表在2018年10月4日的Cell期刊上,论文标题为“Genomic Analyses from Non-invasive Prenatal Testing Reveal Genetic Associations, Patterns of Viral Infections, and Chinese Population History”。
这些孕妇提供了血液样本来测试胎儿染色体异常,主要是唐氏综合症。这种称为无细胞胎儿DNA测试的技术是一种非侵入性产前测试方法。鉴于孕妇的血液中漂浮着来自她们未出生的孩子的DNA,这种技术是可行的。通过快速鸟枪测序,实验室能够让血液中所有自由漂浮的DNA发生断裂,并对大小刚好的DNA片段进行测序以便诊断唐氏综合症。
图片来自
尽管在美国尚未普及,但是这种非侵入性产前测试在中国是很常见的:全球70%的此类测试都是在中国进行的。孕妇的血液取样能够在早期进行,是没有风险的,然而美国的标准产前测试涉及羊膜穿刺术或绒毛膜绒毛取样,这两种方法都需要从子宫内获取胎儿细胞,并有可能伤害未出生的孩子。
产科医院付钱让华大基因进行这些测试,但获得了每名孕妇的知情同意,以便为了研究目的对经过部分测序的基因组进行分析,此外每名孕妇都保持匿名。所有分析均在中国进行,而且这些数据存放在中国国家基因库中。
这种数据分析揭示出一个称为NRG1的基因发生的变异与双胞胎的发生率或多或少存在着关联。这个基因的一种变体在怀有双胞胎的孕妇中更常见,并且与甲状腺功能亢进相关,这突出表明甲状腺功能与双胎妊娠之间存在着关联,这一点之前在小鼠身上观察到。另一个称为EMB的基因发生的变异与年龄较大的首次怀孕的母亲存在关联。这种分析还发现了几个之前未发现的与身高和身体质量指数(BMI)相关的基因。
可能最令人感兴趣的是,对孕妇血液中的DNA进行测序可提供关于在体内血液中循环流通的病毒的信息,因而可将病毒与决定着疾病易感性的基因相关联在一起。比如,一个基因发生的变异与孕妇血液中更高水平的人疱疹病毒6型(HHV-6)有关。HHV-6是一种相对良性的婴儿皮疹(称为玫瑰疹)的最为常见的原因,但是较高的“病毒载量”与更严重的症状相关联。患有阿尔茨海默病的人的大脑中也含有较高水平的HHV-6。
更多的关联性仍有待发现。迄今为止,深圳华大基因研究团队对来自300多万孕妇的基因组进行了测序,其中大部分都伴随着可用于发现遗传关联的母亲和婴儿健康信息。
论文共同作者、华大基因研究院院长徐迅(Xun Xu)说,“如果你有这些基因型,并将它们与表型进行比较,那么你能够找到解释人类性状的遗传变异。”
为了找到与人类性状(比如身高和体重)相关的基因,科学家们通常对少数(数百至数千个)基因组进行彻底测序并扫描基因组中的序列变异,这些变异在具有这种性状的人群中更常见。如今的金标准是鉴于测序过程中存在固有误差,对每个基因组进行60次测序,以确保测序准确性。即便对每个基因组仅测序20次,这是不错的但不是很好,而且它仍然是成本高昂的。
这项新研究仅依赖于部分基因组序列—获得它们的成本更低,但是它们的数量是庞大的。平均而言,每名孕妇的大约10%的基因组被测序,这是因为这是医生诊断胎儿染色体异常所必需的。比如,唐氏综合症(也称为21三体综合症),是由三条而不是两条21号染色体引起的。单个测序循环就足以确定某些基因的数量是否比正常情况高出50%,这表明存在一条额外的染色体。
在对这些部分测序的基因组进行重建时,还有另一个重要的数据集可供使用:迄今为止所有已被测序的完整的人类基因组,以及它们各自的变异。
使用141000多个部分测序的基因组进行推算的结果表明这种重建的中国少数民族和占主导地位的汉族的人口地理分布反映了中国过去100年来已知的人口流动情况。
鉴于这种样本规模如此之大,这些研究人员能够了解近代的中国人口流动情况,包括中国政府政策导致的人口迁移。比如,中国西部的许多汉族人口与东海岸大城市的人口密切相关,这反映出在近代,大量人口迁移到人口稀少的乡村。
这些研究人员还发现,许多中国人具有在印度人、东南亚人以及旧丝绸之路路线上的欧洲人中常见的基因变异。
如今,这些研究人员正在分析100万接受非侵入性产前测试的中国女性的基因组。(生物谷 Bioon.com)
参考资料:
Siyang Liu, Shujia Huang, Fang Chen et al. Genomic Analyses from Non-invasive Prenatal Testing Reveal Genetic Associations, Patterns of Viral Infections, and Chinese Population History. Cell, 4 October 2018, 175(2):347-359, doi:10.1016/j.cell.2018.08.016.

 基因君官网
基因君官网