伊莎贝尔(Isabelle)是一名生活在英国的17岁女孩。如果用一个词来形容她的人生,“悲惨”会是最贴切的选择:一出生,她就得上了极为罕见的遗传病;由于肺功能衰竭,年纪轻轻的她不得不切除双肺,接受移植;而移植后,她又出现了细菌感染,任何一种抗生素都治疗不了……
正当她的生命不可避免地走向终结时,死神挥空了镰刀——如同奇迹一般,一度瘦到只剩骨架的伊莎贝尔,已经能和同龄人一样正常生活。谱写这一生命奇迹的,是一种在百年前就已具雏形的病毒疗法。
与死神共存
伊莎贝尔的一生伴随着疾病。出生后不久,她就确诊患有囊性纤维化。这是一种非常罕见的遗传病,平均每10万人里才有1例。在疾病的影响下,伊莎贝尔的肺部积攒了大量浓稠黏液,让她呼吸困难。更为雪上加霜的是,这些黏液在她的肺部滋生了大量细菌。为了抑制细菌感染,伊莎贝尔连续吃了8年的抗生素,这是她人生一半的长度……
然而即便是得到了精心的照料,也无法让她过上健康的生活。15岁那年,在疾病和细菌的双重攻击下,伊莎贝尔的肺部功能只剩下正常人的三分之一。无可奈何之下,医生们决定为她进行双肺移植手术,也就是锯开她的胸骨,打开她的胸腔,切掉她病变的双肺,再移植入一对健康的肺。毫无疑问,这是一场危险的手术。更何况,在8年抗生素影响下,伊莎贝尔肺部的细菌早已“成精”,怎么杀都杀不死。一旦手术部位出现伤口感染,这些耐药的细菌就会通过血液游遍全身,后果不堪设想。
但她别无选择。
2017年,伊莎贝尔在英国著名的大奥蒙德街儿童医院(Great Ormond Street Hospital)完成了双肺移植。手术进行得很顺利,伊莎贝尔也顺利挺过了最初的几周。然而,医生们最担心的事情终于还是来了——移植的几周后,手术的缝合部位展露出亮红色,而一系列指标也说明她的肝脏正在出现感染。
随后的一幕更让医护人员们感到痛心。伊莎贝尔体内肆虐的细菌穿透了她的皮肤,在手臂、大腿以及臀部的表面留下了一个个水泡和疤痕。“看到这些伤口感染时,我的心都沉了下去。”负责治疗伊莎贝尔的海伦·斯宾塞(Helen Spencer)医生说道。通常情况下,由于缺乏有效的抗生素,这些出现耐药感染的儿童将在病痛的折磨中走向年轻生命的终点。见过太多病例的她,深知这些患者家庭将要面临怎样的悲剧。
神秘的冰库
“她掉了那么多体重,看上去就像是一具骨架,” 伊莎贝尔的母亲绝望地说道:“细菌从她的皮肤下不断钻出,医生们无法让她感到舒适,这简直太可怕了!”
但她并没有就此放弃希望。这名不服命运安排的女性在网络上疯狂地寻找各种“另类疗法”,一种叫做“噬菌体”的神秘病毒进入了她的视野。顾名思义,这种病毒有着杀死细菌的神奇能力。早在一个世纪前,就有人想要驾驭这种病毒的能力,消灭细菌感染。与广谱抗生素不同,噬菌体的“口味”非常挑剔,一种噬菌体只能杀死特定的少量细菌。这固然可以避免抗生素带来的副作用,但同时也极大增加了找到有效噬菌体的难度。
抱着死马当活马医的想法,伊莎贝尔的母亲询问斯宾塞医生,能不能试试这种噬菌体疗法。这一次,幸运女神眷顾了这对母女。
在大奥蒙德街儿童医院,斯宾塞医生的一名同事欣然伸出了援手。大洋彼岸的美国,全球最权威的噬菌体专家之一格拉汉姆·哈特福尔(Graham Hatfull)教授正是他的合作伙伴。哈特福尔教授是一个“狂热”的噬菌体收藏者,他的实验室里有两座大型低温冰箱,里头藏有从世界各地的尘土、污水、乃至空气中寻找到的15000多管噬菌体。如果要说世界上哪个角落可能存在治疗伊莎贝尔的噬菌体,这两座大型冰箱几乎是唯一的答案。
但即便有着全世界最大的噬菌体收藏,哈特福尔教授依然对治疗前景感到不乐观:“我有预感那么庞大的噬菌体收藏总能回答一些生物学的问题,但我们没有想到居然要用这些噬菌体来治疗人类。”
基因改造病毒
不久,哈特福尔教授收到了从伦敦寄来的细菌样本。这是一种特殊的结核分枝杆菌(Mycobacterium),和引起肺结核的细菌算是亲戚。随后,研究人员们开始马不停蹄地筛选噬菌体。
为了节省时间,研究人员们同时采取了两种筛选策略,一种是直接测试那些对其亲戚有杀伤效果的噬菌体,希望找到那些有“灭门”潜力的病毒;另一种则是将数千种噬菌体混在一起,从中逐步筛选出能杀死耐药结核分枝杆菌的成员。
三个月后,在大规模的筛选之下,研究人员们找到了3种有希望治疗伊莎贝尔的噬菌体,但其中2种噬菌体感染并杀死细菌的能力并不是非常强。为此,研究人员们又做了进一步的基因改造,让这些噬菌体能够在细菌里疯狂繁殖,最终涨破并杀死细菌。
在做过了安全性的测试后,研究人员们决定用这3种噬菌体组成的“鸡尾酒疗法”治疗伊莎贝尔。具体来看,伊莎贝尔每日需要接受两次治疗,而伴随每次治疗进入她体内的,是10亿个噬菌体病毒。
伊莎贝尔也是首位接受基因改造噬菌体治疗的人类。
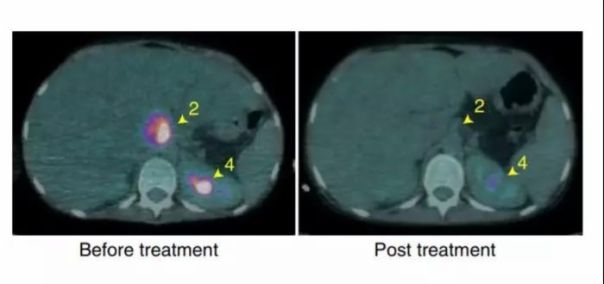
治疗的效果可以说是立竿见影。仅仅是3天后,伊莎贝尔皮肤表面的水泡开始干瘪下去,表明耐药细菌的肆虐得到了快速控制。6周后,扫描结果表明她体内的感染几乎全部消除。
她的母亲喜极而泣:“这是不可思议的医学,简直像是个奇迹!”从出生起就充满不幸的伊莎贝尔,在这一刻也成为了她母亲口中“地球上最幸运的孩子”。
这一“医学奇迹”于上周发表于《自然·医学》上,《科学》杂志官网对其也做了长文报道。
伊莎贝尔是在2018年接受的治疗。如今,她身上的水泡几乎已消失殆尽。在外人看来,这名接受过肺移植手术,差点被耐药细菌夺取生命的17岁女孩和同龄人没有什么两样。她每天上学,偶尔和同学一起购物,甚至还在学习怎么开车。见过死神的模样,她想尽力活得精彩。
后记
成功拯救一条生命,并没有就此让科学家们松懈下来。短暂的喜悦过后,他们很快投入到了新的研发方向上。
哈特福尔教授已经找到了第四种有望治疗伊莎贝尔的噬菌体,以防细菌对“鸡尾酒疗法”产生耐药。但依照目前的疗效来看,至少在短期之内我们无需担心这一点。
斯宾塞医生和她的合作伙伴们则在研究这些噬菌体能否用于其他耐药细菌感染。很不幸,由于噬菌体的高度特异性,即便是同属于结核分枝杆菌的其他细菌,也无法被这些病毒所杀死。此外,伊莎贝尔感染的耐药菌主要生活在细胞外。如果是针对细胞内的细菌感染,噬菌体可能会无能为力。
尽管还有种种未知,但伊莎贝尔的案例,是一个再好不过的开头。正如哈特福尔教授所言,如今接受过噬菌体治疗的人类屈指可数,我们正处于一片未知的天地。而向着未知进行探索,正是人类的本能。(生物谷Bioon.com)

 基因君官网
基因君官网