AJHG:研究发现数百个易致癌基因
Cell Stem Cell:经过基因改造的HSC-iNKT细胞提供持久的抗肿瘤免疫反应
2019年10月8日讯/生物谷BIOON/—恒定自然杀伤细胞(invariant natural killer T cell, iNKT)称为免疫系统的“特种部队”。尽管它们在体内相对较少,但是它们要比许多其他的免疫细胞功能强大。
在一项针对小鼠的研究中,来自美国加州大学洛杉矶分校的研究人员发现他们可以利用iNKT细胞的功能攻击肿瘤细胞并治疗癌症。这种方法可以抑制移植到小鼠体内的多种类型人类肿瘤的生长。相关研究结果发表在2019年10月3日的Cell Stem Cell期刊上,论文标题为“Development of Hematopoietic Stem Cell-Engineered Invariant Natural Killer T Cell Therapy for Cancer”。论文通讯作者为加州大学洛杉矶分校伊莱-艾迪斯布罗德再生医学与干细胞研究中心成员Lili Yang。论文第一作者为加州大学洛杉矶分校的Yanni Zhu和Drake Smith。
Yang说,“真正令人兴奋的是,我们能够只进行一次这样的治疗,它可以增加iNKT细胞的数量,使之达到在小鼠的一生中都能抗击癌症的水平。”
科学家们已猜测iNKT细胞可能是抗癌的有用武器,这是因为已经显示出它们能够同时靶向多种类型的癌症,这与大多数免疫细胞—一次仅能识别并攻击一种特定类型的癌细胞—不同。但是大多数人体内的iNKT细胞数量很少。在大多数情况下,只有不到0.1%的血细胞是iNKT细胞。
此外,Yang和她的同事们已知道之前的临床试验表明具有天然较高水平的iNKT细胞的癌症患者通常比具有较低水平的iNKT细胞的癌症患者寿命更长。
Yang说,“它们是非常强大的细胞,但是它们天然存在于人体血液中的数量如此之少,以至于它们通常无法产生治疗作用。”
这些研究人员的目标是开发一种能永久性地增强人体自然产生更多iNKT细胞能力的疗法。他们从造血干细胞开始,其中造血干细胞是在骨髓中发现的细胞,它们可以自我复制,并可以变成所有类型的血细胞和免疫细胞,包括iNKT细胞。他们对这种干细胞进行了基因改造,使得它们经编程后产生iNKT细胞。
他们在携带人类骨髓和人类癌症—多发性骨髓瘤(血癌)或黑色素瘤(实体瘤)—的小鼠上测试了所获得的细胞,即造血干细胞经过基因改造后产生的恒定自然杀伤细胞(hematopoietic stem cell-engineered invariant natural killer T cell, HSC-iNKT细胞),并研究了在HSC-iNKT细胞整合到骨髓后的小鼠免疫系统、癌症和HSC-iNKT细胞发生了什么。
他们发现这些经过基因改造的造血干细胞可以正常分化为iNKT细胞,并在小鼠的余下的生命(通常大约一年)中继续产生iNKT细胞。
Yang说:“这种方法的优势在于它是一种一次性的细胞疗法,这可以为患者提供终身的iNKT细胞供应。”
尽管没有接受经过基因改造的造血干细胞移植的小鼠具有几乎不可检测到的iNKT细胞水平,但是在那些接受经过基因改造的造血干细胞移植的小鼠中,iNKT细胞占免疫系统中总T细胞数量的60%。此外,这些研究人员发现他们能够通过对初始的造血干细胞进行基因改造的方式控制所产生的iNKT细胞数量。
最后,这些研究人员发现在多发性骨髓瘤和黑色素瘤中,HSC-iNKT细胞均能有效抑制肿瘤生长。
还需开展更多的研究来确定HSC-iNKT细胞如何可能用于治疗人类癌症,以及增加HSC-iNKT细胞的数量是否会引起长期副作用。不过,Yang说,从癌症患者或合适的供者中收集的造血干细胞可用于在实验室中产生HSC-iNKT细胞。将干细胞移植到患者骨髓中的方法已经被确认为是一种治疗许多血癌的方法。(生物谷 Bioon.com)
参考资料:
1.Yanni Zhu et al. Development of Hematopoietic Stem Cell-Engineered Invariant Natural Killer T Cell Therapy for Cancer. Cell Stem Cell, 2019, doi:10.1016/j.stem.2019.08.004.
2.Engineered killer T cells could provide long-lasting immunity against cancer
https://medicalxpress.com/news/2019-09-killer-cells-long-lasting-immunity-cancer.html
blood:植物成分能够提高基因疗法的速度与有效性

原始出处:Stosh Ozog, Nina D. Timberlake, Kip Hermann, Olivia Garijo, Kevin G. Haworth, Guoli Shi, Christopher M. Glinkerman, Lauren E. Schefter, Saritha D’Souza, Elizabeth Simpson, Gabriella Sghia-Hughes, Raymond R. Carillo, Dale L. Boger, Hans-Peter Kiem, Igor Slukvin, Byoung Y. Ryu, Brian P. Sorrentino, Jennifer E. Adair, Scott A. Snyder, Alex A. Compton, Bruce E. Torbett. Resveratrol trimer enhances gene delivery to hematopoietic stem cells by reducing antiviral restriction at endosomes. Blood, 2019; 134 (16): 1298 DOI: 10.1182/blood.2019000040
Amicus公布基因疗法最新结果 有望中止致命儿童疾病进展
新基因疗法可用于治疗颞叶癫痫

德国柏林夏里特大学医院和奥地利因斯布鲁克医科大学合作,开发了一种新方法来治疗颞叶癫痫,这种靶向基因疗法针对癫痫发作时的位置进行给药,抑制癫痫发作症状。
在整个欧洲,约有500万人患有癫痫病,其特征是神经细胞反复同步放电,导致正常脑功能中断,并表现为癫痫发作。最常见的形式是颞叶癫痫(TLE),这种癫痫发作起源于颞叶。该病的长期后果可能是记忆功能、学习能力和情绪控制失调。此外,工作、出行和体育活动也受影响。
药物在颞叶癫痫患者中通常无效,并且经常伴有严重的副作用。对于这类患者,手术切除颞叶病变区域通常是唯一的替代治疗选择。但是这样的手术会导致认知功能丧失,并且不能保证癫痫不再发作。
柏林夏里特大学医院病毒学研究所所长海尔布隆教授与因斯布鲁克医科大学药理研究所克里斯多夫·施瓦茨教授合作,开发了一种基于靶向基因的新疗法,可选择性地将特定基因引入负责癫痫发作的大脑区域神经细胞,该基因可作为强啡肽存储和定向给药的途径。
强啡肽是一种内源性物质,可以防止过度的神经元唤醒。一旦神经元吸收并存储了特定基因,它们就会永久性地产生药物储备。“在癫痫发作开始时,将强啡肽通过靶向基因定向给药,会使高频信息刺激神经元活动的强度减弱,癫痫发作得到抑制。”施瓦茨教授解释说,“由于该药物仅在需要时才从细胞中释放出来,因此我们称之为‘按需药物’基因疗法。”
该研究小组现已在动物模型中证明,基因治疗可抑制癫痫发作数月,癫痫发作对学习和记忆的负面影响也消失了。这种基因疗法的副作用还没有观察到,按需释放药物没有检测到任何习惯性影响。此外,研究小组还对癫痫患者的组织样品进行了治疗原理测试,证明强啡肽能够显着降低组织中同步神经元活动的强度和频率。
海尔布隆教授说:“研究结果使我们充满信心,这种新的治疗方法也可以在人类中获得成功。”他们现在希望将这种新的基因疗法尽快用于临床。(生物谷Bioon.com)
揭秘基因突变与多种癌症发生之间的神秘关联!
本文中,小编整理了多篇研究报告,共同解读基因突变与多种癌症发生之间的关联,分享给大家!
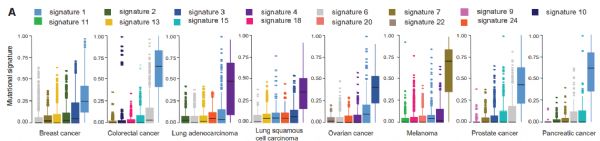
图片来源:Nature, 2019, doi:10.1038/s41586-019-1646-9
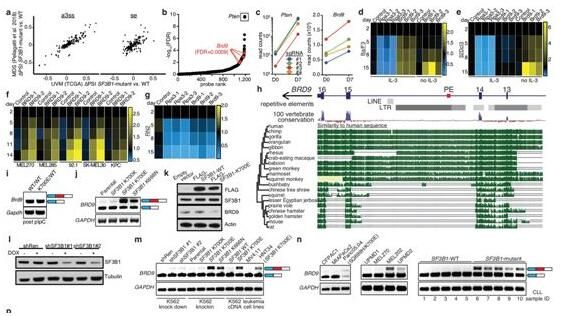
【1】Nature:重大进展!新研究揭示最常见的SF3B1基因突变如何导致癌症
doi:10.1038/s41586-019-1646-9
在一项新的研究中,来自美国弗雷德哈金森癌症研究中心和纪念斯隆凯特琳癌症中心等研究机构的研究人员确定了SF3B1(splicing factor 3b subunit 1, 剪接因子3b亚基1)基因突变如何促进很多癌症形成,其中SF3B1是最为频繁发生突变的剪接因子编码基因,相关研究结果近期发表在Nature期刊上。
这些研究人员发现了SF3B1基因突变如何导致癌症,这些突变发生在许多癌症类型中,包括各种白血病、骨髓增生异常综合征、黑色素瘤、乳腺癌、胰腺癌、肝癌和膀胱癌。鉴于SF3B1编码的蛋白对于产生RNA分子至关重要,因此Bradley和Abdel-Wahab研究了来自数百名患有几种不同癌症类型的患者的RNA测序数据,以寻找异常的RNA分子。他们发现SF3B1突变导致癌细胞产生异常形式的BRD9 RNA分子,它包括非编码DNA序列或者说“垃圾DNA”。这种“垃圾DNA”源自近期将自身插入人类基因组的病毒序列元件。 Bradley和Abdel-Wahab发现BRD9在许多类型的癌症中都是重要的肿瘤抑制因子,这些癌症包括葡萄膜黑色素瘤(一种影响眼睛的黑色素瘤类型)、慢性淋巴细胞性白血病和胰腺癌。他们随后利用CRISPR技术和反义寡核苷酸设计了可逆转这种疾病过程的疗法。
【2】Nature:重磅!科学家在人类癌症基因组非编码区域中鉴别出关键的致癌突变
doi:10.1038/s41586-019-1651-z
近日,一项刊登在国际杂志Nature上的研究报告中,来自加拿大安大略省癌症研究所的科学家们通过研究在人类癌症基因组中的大量非编码区域(也被称之为人类癌症DNA的“暗物质”)中发现了一种新型的致癌突变;这种突变或能作为一种新型潜在的治疗靶点,帮助科学家们开发治疗多种类型癌症的新型疗法,包括脑癌、肝癌和血液癌症等。
研究者Lincoln Stein表示,非编码DNA在基因组中占到了98%的比例,其对于科学家们而言非常难以研究,而且其因为不编码蛋白质经常会被忽略。通过仔细分析这些区域,研究人员在DNA代码的一个碱基中发现了改变,其或能驱动多种类型癌症的发生,研究人员或能利用这种新型癌症机制来开发治疗包括癌症在内多种疾病的新型疗法。
doi:10.7554/eLife.43668
根据开放获取的期刊《eLife》上的一篇新报告,科学家已经确切地展示了两种不同基因的突变如何协调驱动恶性肺部肿瘤的发展。这项在新型基因工程小鼠身上进行的研究观察了肺肿瘤的特征–从小到肉眼看不到到大到可能致命的肿瘤。这一结果为肿瘤进展机制的研究提供了新的线索,并将有助于目前正在开发治疗肺肿瘤药物的研究人员。
肺癌的类型很多:非小细胞肺癌(NSCLC)是全球癌症相关死亡的主要原因,肺腺癌是NSCLC最常见的亚型。约75%的肺腺癌的影响细胞生长的两种重要控制机制发生突变–MAP激酶途径和PI3′-激酶途径。单独的每一种途径都不足以导致肺癌;他们需要协调才能做到这一点。
【4】Nat Genet:新发现!科学家鉴别出诱发遗传性胰腺癌风险的基因突变
doi:10.1038/s41588-019-0475-y
近日,一项刊登在国际杂志Nature Genetics上的研究报告中,来自美国Dana-Farber癌症研究所等机构的研究人员通过对一组极易患癌的家庭进行研究的过程中鉴别出了一种罕见的遗传性基因突变,其或会明显增加个体在一生中患胰腺癌和其它癌症的风险。识别出这种此前未知的突变或能帮助研究人员对这种较强胰腺癌家族史的个体进行常规检测,从而确定其是否携带有这种突变(RABL3基因),如果确定是的话,研究人员或许就能在疾病早期对患者进行筛查。
目前有研究证据表明,通过筛查高风险个体来发现胰腺癌或能改善患者的预后,此外,患者的亲属也能够选择进行检测来排除其机体是否也携带有RABL3基因突变。大约10%的胰腺癌都有一定的家族模式,尽管目前研究人员鉴别出了一部分基因突变,然而在大多数情况下,致病性的基因缺陷并不为人所知,一种促进个体易患胰腺癌的遗传性突变就会发生在BRCA2上,该基因会引发某些乳腺癌和卵巢癌。研究者所鉴别出的RABL3基因的突变会增加个体在其一生中患癌的风险。
【5】Nat Commun:乳腺癌中的基因突变或有望帮助开发治疗肺癌的新型疗法
doi:10.1038/s41467-019-11236-3
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自密歇根州立大学的科学家们通过研究表示,深入研究基因突变在乳腺癌中的关键角色或有望帮助开发治疗肺癌的新型疗法。
研究者Eran Andrechek教授表示,我们对乳腺癌样本进行了全基因组测序研究,结果发现了一种驱动突变或许与肺癌的发生密切相关,这在此前我们并不清楚;这种突变或能帮助我们识别接受FDA批准的靶向性疗法的肺癌患者。文章中,研究人员利用实验室小鼠进行研究,对测序的基因进行了计算机分析,研究者指出,乳腺癌中存在的基因突变或许会抑制特定肺癌肿瘤的生长,而且大约5%的肺癌患者都携带有这种突变。
图片来源:commons.wikimedia.org
【6】Nat Commun:新发现!鉴别出与女性常见癌症发生相关的基因突变组合
doi:10.1038/s41467-019-11403-6
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自密歇根州立大学和Van Andel研究所的科学家们通过研究发现,两个基因突变的组合或与女性子宫内膜癌发生直接相关。
研究者Ronald Chandler教授说道,今年已经有超过6.3万名女性被诊断可能患上了子宫内膜癌,这或许使得子宫内膜癌成为了最常见的妇科癌症;文章中,研究者发现,在子宫内膜癌和子宫内膜异位症相关的卵巢癌发生过程中,ARID1A和PIK3CA基因会频繁发生突变,研究结果意味着,研究人员有望开发出更好的靶向性疗法来帮助抵御上述女性疾病。
【7】Nature:FOXA1突变改变癌症表型及其细胞谱系分化
doi:10.1038/s41586-019-1318-9
转录因子FOXA1中的突变导致了前列腺癌中的一个独特部分,但是人们并不知道这些突变的功能性后果以及它们是否导致功能的获得或丧失。
在一项新的研究中,来自美国纪念斯隆-凯特林癌症中心、威尔康乃尔医学院、加州大学旧金山分校和加拿大GenomeDx生物科学公司(GenomeDx Bioscience)的研究人员通过对来自3086种人类前列腺癌的FOXA1突变景观进行注释,在FOXA1的叉头结构域(forkhead domain)中确定了两个热点:Wing2(约占所有突变的50%)和高度保守的DNA接触氨基酸残基R219(约占所有突变的5%)。Wing2突变在腺癌的各个阶段都能检测到,而R219突变在具有神经内分泌组织学特征的转移性肿瘤中富集,相关研究结果发表在Nature期刊上。
【8】Cancer Res:科学家成功靶向癌症臭名昭著的KRAS突变
doi:10.1158/0008-5472.CAN-18-2372
KRAS是癌症治疗中最具挑战性的靶点之一。尽管它的发现已有60多年的历史,但研究人员仍在努力抑制它的变异形式–这也为它赢得了”无法下药”的名声。然而,研究人员仍然在寻找其致命的弱点,因为KRAS突变引发的癌症既常见又致命。
如今研究人员通过研究发现,一种名为PHT-7.3的化合物可以缩小小鼠体内KRAS驱动的肿瘤。与直接靶向突变KRAS不同,这个潜在的候选药物的目标是蛋白质的犯罪伙伴:突变KRAS附着的细胞支架,这项研究发表在Cancer Research杂志上。
新闻阅读:Time doesn’t heal all wounds: How DNA damage as we age causes cancer
随着年龄的增长,我们的身体不可避免地会恶化。一些变化,如白发和皱纹,很容易看到。其他人,如高血压,往往被忽视,但可能是致命的。随着我们的身体显示出衰老的迹象,我们的基因组也是如此。损害来自改变我们DNA的化学反应,以及复制时引入的错误。我们的细胞可以抵御这些破坏,但这些机制并非万无一失,细胞会在一生中逐渐累积DNA损伤。
由于这种损害,你的基因组在每个细胞中都变得不太一样。当细胞分裂时,它将传递这些变化,并且随着它们的积累,存在越来越多的效应。如果这些变化 – 我们称之为突变 – 切断控制细胞增殖和存活的系统,这可能导致癌症的发生。
【10】PNAS:科学家阐明参与癌症发生的DNA的可能性突变
doi:10.1073/pnas.1807258115
近日,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自塞维利亚大学等机构的科学家们通过研究揭示了参与癌症发生的DNA的可能性改变,文章中,研究人员对名为PIF1的蛋白的角色进行了研究,他们解开了这些蛋白分子的不同结构,这些分子中包含有特殊的指令,能够促进细胞发挥正常功能,当这些改变没有得到合适修复时,就会诱发影响机体健康的突变出现。
为了避免这些问题,我们就需要保持DNA分子的完整性,然而细胞自身的代谢,尤其是在利用信息上,这就意味着,一些习惯性的屋里和化学变化可能会破坏DNA中所包含的信息并导致突变的发生。实际上,细胞每天都会发生数十次的突变。因此,为了尽可能地避免遗传信息的任何丢失,多种机制就会发挥作用,其能够帮助抵御改变的发生,并促进DNA的修复,如果这些机制并不能够足以有效修复所有的改变,那么突变就会积累,并诱发细胞衰老,在某些情况下甚至会导致多种病理学的表现,包括癌症等疾病。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
中科院北京基因组所和山大合作揭示人类早期胚胎染色体结构动态

《自然》杂志刊发了中国科学院北京基因组研究所研究员刘江团队与中国科学院院士、山东大学附属生殖医院教授陈子江团队合作研究成果。
该研究首次揭示了人类早期胚胎中的染色体三维结构的动态变化,并发现CTCF蛋白对于早期胚胎发育中拓扑相关结构域(TAD结构)有着重要的调控功能,为进一步揭示人类胚胎发育机制提供了理论基础。
染色体三维结构是重要的表观遗传因素,与基因的表达调控密切相关。
染色体三维结构的动态变化影响着细胞功能的发挥、疾病的发生等。
人类个体发育从精卵结合形成受精卵开始,经历早期胚胎发育过程,由一个细胞逐渐分裂分化形成一个含有上百种细胞类型、多种器官的复杂有机体。
“人类精子和卵子受精后,细胞核中的染色体结构如何变化,哪些生物学分子会影响胚胎中的染色体结构变化,一直以来是未被解决的科学问题。
此外,精子在形态和功能上与其他终末分化的细胞截然不同,染色体在人类精子中如何压缩折叠还并不清楚。”论文第一作者、中国科学院北京基因组研究所特别研究助理陈雪鹏表示。
基因组染色体的三维结构由拓扑相关结构域(TAD)基本单元构成。
研究人员对精子及人类早期胚胎发育过程中的染色体结构动态变化情况进行了描绘。
研究结果显示,在成熟的人类精子中没有TAD结构并且没有检测到染色质调节蛋白CTCF,这与在小鼠精子中的情况完全不同。
受精后,胚胎中TAD结构非常模糊,在后续的胚胎发育中染色体逐渐建立清晰的TAD结构。
陈雪鹏指出,需要注意的是,不同于小鼠胚胎和果蝇胚胎,人类早期胚胎中阻断合子基因组激活(ZGA)可以抑制TAD结构的建立。
进一步研究发现,CTCF蛋白在合子基因组激活之前表达量非常有限,在TAD结构出现的合子基因组激活时期表达量会迅速上升。
在胚胎中敲低CTCF蛋白可以导致TAD结构显着变弱,这表明在合子基因组激活时CTCF蛋白的表达对于人类早期胚胎的TAD结构建立至关重要。
“该研究让我们深入了解人类精子和早期胚胎染色体结构的独特性,对改善试管婴儿技术、促进优生提供理论的基础。”刘江说。
他同时指出,当前该领域存在的瓶颈是,在少量细胞的情况下,染色体结构的分辨率较低。
“下一步,我们将不断优化方法,提高分辨率,并力争通过我们的研究,解决临床上的问题,造福人类。”(生物谷Bioon.com)
Cancer Cell:重大发现!科学家鉴别出能促进成神经细胞瘤恶性扩散的关键基因!
2017年9月4日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Cancer Cell上的研究报告中,来自梅奥诊所的研究人员通过研究首次阐明了成神经细胞瘤扩散的分子机制,同时他们还揭示了促进成神经细胞瘤恶性扩散的两个基因之间的关联。
图片来源:Mayo Clinic
成神经细胞瘤是一种神经系统肿瘤,其常常会影响5岁及以下儿童的健康,在年长的儿童中很少发生;这种癌症往往会从机体多个区域的未成熟的神经细胞开始发生,但在肾上腺和其周围却最为常见,肾上腺和神经细胞有着类似的起源,而且位于肾脏上面;与其它癌症类似,成神经细胞瘤的特性和遗传改变直接相关。
研究者Shizhen Zhu指出,LMO1基因表达水平的增加和恶性高风险的成神经细胞瘤直接相关;利用斑马鱼进行遗传学分析,我们首次发现LMO1基因能够同MYCN基因协作加速肿瘤开端并且增加肿瘤的渗透性。研究人员在实验室中开发出了两类斑马鱼模型使其能够高水平表达LMO1和MYCN基因。
研究者开发出的首个成神经细胞瘤转移的斑马鱼模型揭开了LMO1介导的成神经细胞瘤扩散背后的分子机制;在表达LMO1和MYCN的斑马鱼机体中,研究者在80%的24周龄的斑马鱼机体中都观察到了肿瘤的发展,而在仅表达MYCN基因的斑马鱼机体中,在相同时间段内仅有20%至30%的斑马鱼机体中出现了肿瘤发生的现象。
研究者Zhu说道,这是首个在动物模型中发现的证据,即LMO1基因的高水平表达会促进MYCN诱导的成神经细胞瘤的转移,这或许是由于和细胞外基质相关的基因异常表达所导致的结果。细胞外基质是细胞间的一种特殊物质,其包括了一些结构性和化学性的元件,能够连接细胞的物理和信号交流;在表达上述两个基因的斑马鱼模型中,研究者发现模型中细胞外基质的硬度增加了,同时他们还指出,LMO1的高水平表达能够改变控制细胞外基质的基因的表达,从而就会引发促进肿瘤生长和扩散的一些改变。
阐明LMO1如何促进成神经细胞瘤的恶性进展扩散或许并不能直接应用于患者机体中,但研究者强调,斑马鱼或许是一种非常关键的模型,其能够帮助解决未来患者的一些治疗需求;最后研究者Zhu说道,携带LMO1和MYCN转基因表达的成神经细胞瘤斑马鱼模型或许能为研究人员提供一种有价值的平台来帮助评估药物抑制成神经细胞瘤转移的效果;目前我们正在进行更为深入的研究来将相关的研究结果进行转化,从而开发出能够有效治疗成神经细胞瘤的新型个体化疗法。(生物谷Bioon.com)
原始出处:
Shizhen Zhu, Xiaoling Zhang, Nina Weichert-Leahey, et al. LMO1 Synergizes with MYCN to Promote Neuroblastoma Initiation and Metastasis. Cancer Cell (2017). DOI: 10.1016/j.ccell.2017.08.002
Nat Genetics:胎儿的基因或许会影响怀孕期间患病的风险
资讯出处:Fetal genes can increase the risk of illness during pregnancy
 基因君官网
基因君官网