2017年9月25日/基因宝jiyinbao.com/—本期为大家带来的是九月份CRISPR/Cas9基因编辑技术相关的最新研究进展,希望读者朋友们能够喜欢。
doi:10.1038/nature24033
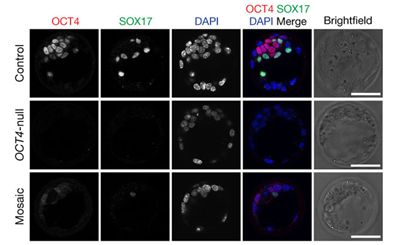
在一项新的研究中,来自英国和韩国的研究人员利用基因组编辑技术CRISPR/Cas9揭示出一种关键的基因在人胚胎的最初几天发育中发挥的作用。这是基因组编辑技术首次被用来研究人胚胎中的基因功能,这可能有助人们更好地理解我们的早期发育的生物学特征。相关研究结果于2017年9月20日在线发表在Nature期刊上,论文标题为”Genome editing reveals a role for OCT4 in human embryogenesis”。
这些研究人员利用CRISPR/Cas9阻止一种关键的基因表达蛋白OCT4。在正常情形下,该基因在人胚胎的最初几天发育中是有活性的。在卵子受精后,它一直进行分裂,大约7天后,它形成一种有大约200个细胞组成的球体,即囊胚(blastocyst)。这项研究发现人胚胎需要OCT4来正确地形成囊胚。
论文第一作者、英国弗朗西斯-克里克研究所的Norah Fogarty博士说,”我们吃惊地观察到这个基因在人胚胎发育中发挥着如此至关重要的作用,但是我们需要继续开展研究来证实它的作用。其他的研究方法,包括利用小鼠开展的研究,已提示着OCT4在胚胎发育更晚的时候发挥着一种更加专注的作用,因此我们的研究结果强调了开展人胚胎研究的必要性。”
论文通信作者、弗朗西斯-克里克研究所的Kathy Niakan博士补充道,”发现一种基因在发育中的胚胎内发挥什么作用的方法之一是观察当它不发挥功能时会发生什么。如今,我们展示了一种高效地做到这一点的方法,我们希望其他的科学家们将利用它发现其他基因的作用。如果我们了解到胚胎成功地发育所需的关键基因,那么我们就可能改进体外受精治疗和理解妊娠失败的一些原因。要实现这样的理解可能需要多年的时间,我们的研究只是第一步。”
这些研究人员在开始研究人胚胎之前,以小鼠胚胎和人胚胎干细胞为研究对象,花了一年多的时间来优化他们的技术。为了让OCT4失活,他们利用CRISPR/Cas9改变41个人胚胎中的DNA。7天之后,这些胚胎的发育停止了,他们随后分析了它们。
除了在人胚胎中之外,OCT4被认为在干细胞生物学中也发挥着重要的作用。多能性干细胞能够变成任何一种其他类型的细胞,而且它们能够从胚胎中获得(如胚胎干细胞),或者让皮肤细胞等成体细胞经过重编程而被诱导出来(如诱导性多能干细胞)。人胚胎干细胞是从发育中的人胚胎内的具有较高的OCT水平的那一部分获得的。
论文共同作者、弗朗西斯-克里克研究所的James Turner博士解释道,”我们有产生和使用多能性干细胞的技术,这毫无疑问是一项巨大的成就,但是我们仍然并未充分理解这些细胞如何发挥作用。更多地了解不同的基因如何导致细胞产生和保持多能性,将有助我们更加可靠地产生和使用干细胞。”
doi:10.1038/nature24268
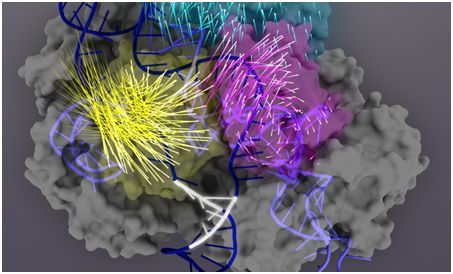
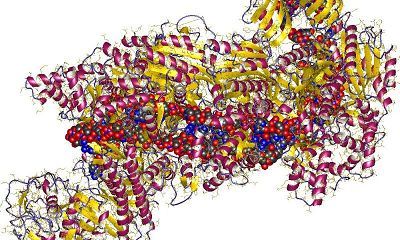
在一项新的研究中,来自美国加州大学伯克利分校、麻省总医院、哈佛医学院和劳伦斯伯克利国家实验室的研究人员鉴定出Cas9蛋白中的一个关键区域决定着CRISPR-Cas9如何精准地对靶DNA序列进行编辑,对它进行微调可产生超精准的基因编辑器,并且使得该基因编辑器的脱靶切割(off-target cutting)活性降低到有史以来的最低水平。相关研究结果于2017年9月20日在线发表在Nature期刊上,论文标题为”Enhanced proofreading governs CRISPR-Cas9 targeting accuracy”。论文通信作者为加州大学伯克利分校分子与细胞生物学教授、霍华德-休斯医学研究所研究员Jennifer Doudna博士。
在CRISPR-Cas9中,Cas9蛋白起着结合和切割DNA的作用。这些研究人员说,他们鉴定出的这种蛋白区域作为DNA切割的一种主控制器发挥作用,是对Cas9进行重新设计进一步提高它的切割精准度的一种显而易见的靶标。这种方法应当有助科学家们定制设计Cas9变异体,从而使得CRISPR-Cas9在错误位点上对DNA进行编辑的几率最小化。当利用CRISPR-Cas9在人体进行基因治疗时,这是一个关键的考虑因素。
一种提高精准度的策略是在这种控制性的被称作REC3的蛋白结构域中引入突变,然后观察哪些突变会提高精准度,同时不会影响在靶切割(on-target cutting)的效率。
论文共同第一作者、Doudna实验室研究生Janice Chen说,”我们发现即便Cas9的REC3结构域发生微小的变化也会影响在靶编辑和脱靶编辑之间的差异,这提示着这个结构域明显是通过深入地诱发突变来改善靶向特异性的候选者。作为这项研究的延伸,相比于我们之前开展的靶向突变,我们能够在REC3结构域中更加无偏向性地引入突发。”其他的论文共同第一作者为加州大学伯克利分校的Yavuz Dagdas和哈佛医学院的Benjamin Kleinstiver。
超精准的Cas9
2012年,Doudna和德国马克斯-普朗克感染生物学研究所的Emmanuelle Charpentier将Cas9蛋白改作他用,构建出一种便宜的、廉价的和易于使用的基因编辑器。从那以后,人们就已寻求降低脱靶编辑的几率。尽管改进的保真度有利于开展基础研究,但是当将基因编辑用于临床应用时,这是至关重要的,这是因为任何脱靶DNA切割可能让关键基因丧失功能,从而导致永久性的和意想不到的副作用。
在过去的两年里,两个研究团队构建出高度精准的Cas9蛋白:一种特异性增强的Cas9,即eSpCas9(1.1);一种高保真度的Cas9蛋白,即SpCas9-HF1,而且Chen和Doudna试图了解为何它们要比如今广泛使用的来自酿脓链球菌(Streptococcus pyogenes)的野生型Cas9蛋白更高特异性地切割。
当前,使用CRISPR-Cas9的科学家们构建出单向导RNA(sgRNA)—一种RNA分子,含有长20个核苷酸的RNA片段,而且该片段与想要靶向的长20个核苷酸的特定DNA序列互补—并且将它附着到Cas9上。这种sgRNA允许Cas9蛋白靶向互补的DNA序列,结合并切割它。但是这种Cas9-sgRNA复合物也能够结合到不那么精确匹配的DNA上,从而导致不想要的脱靶切割。
2015年,Doudna实验室发现了Cas9的一种构象开关,当sgRNA与靶DNA匹配时,这种构象开关会被激活(Science, doi:10.1126/science.aac6572; Nature, doi: doi:10.1038/nature15544)。他们已发现仅当这种sgRNA与靶DNA严格匹配时,Cas9的三维结构,特别是它的HNH核酸酶结构域构象,会发生改变,从而激活Cas9的切割活性。然而,负责识别这种构象开关上游的这些核酸的过程仍然是不为人知的。
在当前的这项研究中,Chen和Dagdas利用一种被称作单分子荧光共振能量转移(single-molecule FRET, smFRET)的技术准确地测量当Cas9-sgRNA复合物结合到靶DNA上时,这种复合物中的多种蛋白结构域,特别是REC3、REC2和HNH结构域,如何移动。
他们首先确定了eSpCas9(1.1)和SpCas9-HF1提供的特异性益处能够根据这些Cas9变体中的HNH构象开关的激活阈值要比野生型Cas9蛋白高得多从而使得当结合到脱靶序列上时eSpCas9(1.1)和SpCas9-HF1变体更不可能激活Cas9的切割活性的事实加以解释。
接着,他们发现REC3结构域负责检测靶标结合的精准度,随后这会指示REC2结构域向外旋转而为HNH核酸酶结构域打开一条通路,从而激活Cas9的切割活性。具有这种活性构象的Cas9随后能够切割靶DNA的双链。
Chen、Dagdas和Kleinstiver随后证实通过让REC3的部分片段发生突变,就有可能改变Cas9蛋白的特异性,使得HNH核酸酶结构域不会被激活,除非这种sgRNA与靶DNA非常严格地匹配。他们能够设计出一种改进的超精准的Cas9(被称作HypaCas9),这种HypaCas9保留了它的在靶切割效率,但略微更好地区分人细胞中的在靶位点和脱靶位点。
Chen说,”如果让REC3中的某些氨基酸残基发生突变,那么人们就能够调整Cas9的在靶切割活性和改进的特异性之间的平衡;我们能够找到这样的一个甜美的平衡点,从而确保在预定的靶标上具有足够的切割活性,同时大幅降低脱靶事件。”
通过继续探究Cas9的结构、功能和动力学之间的关系,Doudna和她的团队希望能够进一步地对这种蛋白进行高度灵敏地改造,从而利用它可靠地和高效地产生多种遗传变化。
DOI: 10.1126/science.aao3130
最近,来自英国与荷兰的研究者们开发出了两种新型的家检测一类遗传性癌症的方法–“器官发育”与”CRISPR-CAS9”.根据最近发表在《Science》杂志上的一篇文章,作者们描述了这种方法如何能够更好地理解特定类型的遗传性癌症。
为了更好地理解遗传性癌症发生过程中的各类影响因素的作用,研究者们利用成人小肠上皮细胞分化培养出了离体器官,这种人造器官能够用于研究人体相关的生物学性状。而在这一研究中,作者们利用离体器官进行肿瘤生长的遗传学研究。
利用CRISPR/CAS9技术,作者敲出了离体器官中的一种叫做NTHL1的基因。这一基因天然存在于人类肠道中,敲除该基因的目的是用于研究这种做法能否模拟真实肠癌患者的性状。
在正常的情况下,NTHL1能够编码一类蛋白质用于切除有缺陷的基因,通过去除该基因,研究者们发现离体器官出现了与一名未知类型乳腺癌患者相似的表型。通过对改名患者的遗传图谱进行分析,作者发现该患者存在天然的NTHL1基因的缺陷,进而导致肿瘤的生长。这意味着该技术成功地鉴定出了特定遗传性癌症相关的基因缺陷。
通过结合上述两种技术成功地对一类遗传性的癌症的内在发病原理进行揭示,研究者们证明该方法适用于理解因DNA缺陷导致的遗传性癌症发生的原因。同时,研究者们称目前可以通过对肿瘤组织细胞进行DNA测序对癌症的内在基因缺陷进行鉴定。
doi:10.1101/181255
在2017年8月初发表在Nature期刊上的一项开创性研究中,研究人员利用CRISPR基因编辑技术修复人胚胎中的一种诱导心脏病的基因突变(详情参见生物谷新闻报道:Nature:重磅!利用CRISPR-Cas9成功校正人胚胎中的致病性突变)。但是并不是科学界的每个人都认可他们的结果。
如今,6名科学家针对这项研究的质疑在开放存取预印本服务器bioRxiv上发表了他们的一篇论文。这6名科学家,包括美国斯隆凯特林癌症纪念中心的Maria Jasin,对它的一项意料之外的发现—也就是,这些人类胚胎利用健康的母体DNA而不是利用这些研究人员外在提供的DNA作为模板来校正这段缺陷序列—提出异议。
在这项发表在Nature期刊上的研究中,由来自俄勒冈健康与科学大学的Shoukhrat Mitalipov领导的一个研究团队靶向MYBPC3基因发生的仅4个碱基对的小缺失,已知这种缺失会导致肥厚型心肌病(hypertrophic cardiomyopathy)。他们利用来自一名携带这种缺陷性基因的患上这种疾病的男性的精子让来自健康供者的卵子受精。他们想要观察他们是否能够利用CRISPR切除这个致病的母体DNA片段,以及利用他们已在实验室中制造出的健康序列是否能够替换它。
根据Mitalipov团队的说法,这些经过CRISPR编辑的胚胎确实发生意料之外的事情:这些胚胎并没有利用未发生突变的MYBPC3 DNA序列作为模板,相反它们利用同源母体DNA序列修复这种缺失。
但是Mitalipov和他的同事们提交的数据并没有说服这6名科学家,这是因为”这一壮举并未在之前的CRISPR实验中观察到”。
在这篇提出异议的论文中,这些批评者坚称,”受精卵的细胞生物学行为似乎是阻止母体基因组和父本基因组之间发生的直接相互作用”,但是这种相互作用是Mitalipov和同事们描述的同源重组修复机制所必需的。
这些批评者写道,Mitalipov团队并没有提供”母体等位基因和父本等位基因之间存在新关联的明确证据”。Jasin说,”对基因校正的直接验证”,包括验证母本-父本交换是否发生,是可以做到的。
Jasin团队概述了两种其他的可能性:这些胚胎实际上在母本DNA不存在的情形下发育,这是很容易想到的;这种缺陷性的MYBPC3基因实际上从未被不会致病的DNA替换。
Mitalipov和他的同事们”坚称他们的这项研究的关键发现是人胚胎能够利用来自另一个亲本的这个基因的正常拷贝,高效地修复致病性突变。”他指出这些批评者并未提出反驳性的数据,并且说道,他的团队打算针对他们提出的每项异议作出答复。
Mitalipov写道,”我们认识到这些结果必须通过进一步的研究加以证实”,而且”鼓励其他的科学家通过在人胚胎上开展他们自己的实验和发布他们的结果来验证我们的发现。”
doi:10.1016/j.cell.2017.07.037
如果说CRISPR复合物听起来很熟悉,那是因为它们是新一波基因组编辑技术的最前沿。CRISPR/Cas系统是目前发现存在于大多数细菌与所有的古菌中的一种免疫系统,被用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
在CRISPR/Cas系统中,CRISPR是规律间隔性成簇短回文重复序列(clustered regularly interspaced short palindromic repeats)的简称,涉及细菌基因组中的独特DNA区域,也是储存病毒DNA片段从而允许细胞能够识别任何试图再次感染它的病毒的地方,CRISPR经转录产生的RNA序列(被称作crRNA)识别入侵性病毒的遗传物质。Cas是CRISPR相关蛋白(CRISPR-associated proteins, Cas)的简称,Cas蛋白像一把分子剪刀那样切割细菌基因组上的靶DNA。科学家们已发现他们能够利用CRISPR降解病毒RNA的天然能力,并且使用CRISPR系统从几乎任何一种有机体中移除不想要的基因。
目前已在细菌中发现三类CRISPR/Cas系统,I型和III型系统需要众多蛋白的参与。II型系统就简单得多了,一个Cas9核酸酶利用向导RNA(gRNA)就可以完成识别和切割靶双链DNA,因此II型系统也被称作CRISPR/Cas9系统。
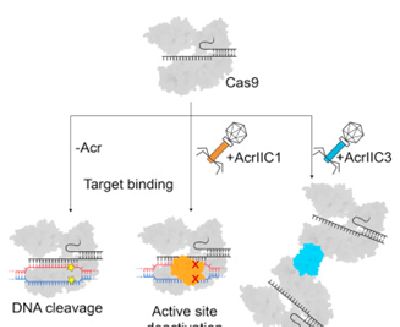
在细菌的免疫系统中,CRISPR-Cas9的作用是靶向结合和摧毁侵入性的DNA,并且被作为一种稳健的基因组编辑技术加以使用。噬菌体编码的小分子抗CRISPR蛋白(anti-CRISPR proteins, Acr)能够让Cas9酶失活,从而为基于Cas9的应用提供一种高效的关闭开关。
在一项新的研究中,来自美国加州大学伯克利分校、马萨诸塞大学医学院、哈佛医学院和加拿大多伦多大学的研究人员证实两种Acr蛋白,即AcrIIC1和AcrIIC3,利用不同的策略抑制Cas9。相关研究结果发表在2017年9月7日的Cell期刊上,论文标题为”A Broad-Spectrum Inhibitor of CRISPR-Cas9″。
AcrIIC1是一种广谱Cas9抑制剂,通过直接结合到Cas9的保守性HNH催化结构域上,阻止多种有差异的Cas9直系同源物切割DNA。AcrIIC1-Cas9 HNH结构域复合体的晶体结构展示了AcrIIC1如何将Cas9限制在一种DNA结合的但是没有催化活性的状态。相反,AcrIIC3阻断单个Cas9直系同源物的活性,诱导Cas9形成二聚体,从而阻止Cas9结合到靶DNA上。
这两种不同的机制允许独自地控制Cas9的靶标DNA结合和切割,而且也为开展允许Cas9结合到靶DNA上但阻止它切割DNA的应用铺平道路。
DOI: 10.1038/nature23875
我们机体细胞中含有22000个基因,但对于每个细胞来说,其常用的基因组合往往各不相同。这种基因表达与抑制的特征最终影响了细胞类型的形成,例如肾脏、大脑、皮肤、心脏等等。
为了调控这种基因表达的特征,基因组中存在很多调控元件,它们受外界信号的影响对基因的表达”开闭”进行精确地调控。其中有一类叫”增强子”的元件,这段序列与基因编码区相隔几万个碱基对,但仍具有增强基因表达的能力。基因表达调控的紊乱会导致很多疾病的发生,但由于它们的功能存在严格的时空特性,即仅仅在特定的条件下、特定的细胞中会发挥作用,因此往往难以研究。
如今,来自加利福尼亚大学的研究者们利用修饰后的CRISPR系统寻找增强子,这一更新后的工具并不具有基因编辑能力,相反地,它能够精确地定位增强子存在的区域。根据最近发表在《nature》杂志上的相关结果,来自UCSF的研究者们利用这种叫做CRISPR activation (CRISPRa)的工具成功地找到了调控免疫细胞发育的增强子。这段序列对于自体免疫疾病的发生具有重要的作用。
CRISPR技术能够使得研究者们快速地理解表达蛋白质的基因的功能。最常用的一项应用就是将其与CAS9酶联合使用,对特定的DNA序列进行剪切。利用这一技术,研究者们能够快速且精确地对任何基因进行编辑,从而观察这些改变对细胞或机体功能的影响。
然而基因占据基因组的比例不足2%,而剩余包括增强子在内的98%的序列难以研究。研究者们能够寻找通过蛋白质与DNA的结合特征寻找潜在的增强子区域,但关于增强子与基因的相互作用则十分困难。此外,由于增强子活性存在严格的时空特性,因此仅仅通过CRISPR-CAS9技术切除增强子区域并不会起到多大帮助。
而来自USCF的Jonathan Weissman教授等人开发出的这种叫做”CRISPRa”的技术则能够对增强子进行精确地激活。与传统的CRISPR-CAS9技术不同,CRISPRa利用修饰后的Cas9酶与CRISPR联合使用,能够在找到特定DNA序列之后进行靶向激活,而非切割。该技术最早是应用于寻找启动子区域,而这一次研究者们则试图寻找增强子区域。
具体地,研究者们研究的是一种编码”IL2RA”的蛋白的基因。该蛋白对于T细胞的功能具有重要的作用。IL-2RA能够决定T细胞启动炎症反应或进行免疫抑制。如果该基因的增强子区域出现故障,那么细胞将难以起到抑制炎症反应的能力,从而导致自体免疫疾病的发生。
通过对IL2RA上游的DNA序列进行连续筛选,作者发现一段序列对于调控IL2RA的产生具有重要的作用,并最终证明其为IL2RA基因的增强子。
研究者们希望下一步对这一技术进行扩展,或许能够同时对更多的基因进行增强子筛选。此外,他们还希望这一方法能够用于研究所有类型细胞的遗传互作情况。(生物谷Bioon.com)

 基因君官网
基因君官网