2016年10月17日/生物谷BIOON/–DNA片段重复在人基因组中是比较常见的。DNA重复一直被提出为一种进化机制,但是它们也能够与人类疾病相关联。如今,在一项新的研究中,来自德国马克斯-普朗克分子遗传学研究所和柏林夏里特医学院(Charité-Universitätsmedizin Berlin)的研究人员证实依赖于DNA片段重复在基因组上的位置,它们能够导致新的被称作拓扑相关结构域(topologically associated domain, TAD)的功能单位形成。他们描述了不同大小的DNA片段重复如何产生新的TAD和重复基因如何能够获得新的功能。这种机制代表着新的基因功能在进化过程中如何产生的一种可能的方式,对理解人类中的基因突变产生深远的影响。相关研究结果发表在2016年10月13日那期Nature期刊上,论文标题为“Formation of new chromatin domains determines pathogenicity of genomic duplications”。
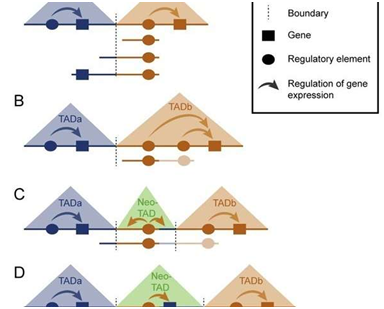
TAD是基因组中的在空间上分隔开的区域。它们是平均长一百万个碱基对的DNA片段,含有一个或多个基因和它们的被称作增强子的调节元件。增强子控制一个基因何时在哪个细胞中开启或关闭。TAD彼此之间通过边界元件(boundary element)分隔开,因此一个TAD中的基因活性独立于相邻TAD中的基因活性。
通过研究SOX9基因区域中不同大小的DNA片段重复,研究人员发现TAD的一种之前未知的功能。SOX9基因负责表达一种在骨骼发育和男性性功能发育中发挥重要功能的转录因子。通过分析基因组的三维结构,他们能够证实两个长的TAD位于SOX9区域。它们当中的一个含有SOX9基因和它的调节元件;另一个含有KCNJ2和KCNJ16两个基因(两个钾离子通道)和它们的调节元件。
不同类型的重复
SOX9基因区域中的重复能够导致显著不同的临床现象。为了理解这些差异,研究人员研究了三种重复,它们都包括SOX9基因的调节元件,以及其他的不同长度的DNA片段。
研究的第一种序列重复在人类中导致性别由女性反转为男性。尽管有两条X染色体,但是受影响的个人在形态学上是男性的。研究人员发现这种重复仅影响在SOX9 TAD 中存在的这种DNA片段和调节元件。然而,令人吃惊的是,包含这个区域的更长的序列重复延伸到邻近的基因KCNJ2和KCNJ16,因而含有相邻TAD的序列,不过对性别决定没有临床影响。相比之下,更长的不仅包含SOX9区域中的这种非编码性DNA而且也含有附近的KCNJ2基因的序列重复导致库克斯综合征(Cooks syndrome),即一种手足遗传异常的疾病,它的特征在于缺乏指甲以及缩短的手指和脚趾。
TAD内重复(intra-TAD duplication)和TAD间重复(inter-TAD duplication)
论文通信作者Stefan Mundlos说,“依赖于重复出现的位置,我们不得不区分TAD内重复和TAD间重复。在性别反转中,TAD内的调节元件发生重复,因此由此产生的影响仍然局限于这个TAD内。因此,仅仅这个TAD中的基因不再受到调节,这意味着它过多或过少地被激活。就SOX9基因而言,这个基因的活性增加,导致男性性别发育,即便受影响的人在遗传上是女性。”
鉴于TAD彼此之间在功能上分隔开,TAD内重复仅影响一个TAD,而不会影响邻近的TAD。相比之下,对TAD间重复而言,不仅SOX9区域的调节元件发生重复,而且两个TAD之间的边界元件也发生重复。这种边界元件重复确定了一个新的TAD(neo-TAD, 新TAD),这个新的TAD包含基因组中的这个重复区域,并且将它与基因组的其他部分隔离开。
Mundlos说,“一个新TAD的影响依赖于它含有基因组中的哪些序列元件。如果这个新TAD仅含有调节元件而不含有基因,那么它对有机体没有影响。附近的基因因被TAD边界元件隔离开不会受到这些调节元件的影响。然而,如果一个新TAD含有调节元件和来自邻近TAD的一个基因,那么该基因能够受到这个新TAD中的这些调节元件(增强子)的调节,从而导致基因异常表达,这可能触发畸形或疾病。”
携带基因和调节元件的TAD重复
正是研究人员研究的第三种TAD重复触发库克斯综合征。这个新TAD不仅含有SOX9基因的调节元件,而且也含有KCNJ2基因的一个拷贝。这个新TAD中的KCNJ2基因会受到SOX9基因中的调节元件的调节。因此,在发育期间,它在错误的时间和错误的组织中被激活,产生与这个综合征相关联的畸形。
通过在理解基因异常时将这个TAD结构考虑在内,科学家们能够比之前更加准确地预测突变的影响。比如,这会与导致遗传疾病和癌细胞中的基因变化的重复相关联,其中在癌细胞中,重复经常会发生。
重复是进化驱动力之一。基因重复使得基因拷贝产生新的不同于原始基因的性质成为可能,在这个过程中,原始基因仍然不会受到影响。通过能够将新TAD中的调节元件和基因进行新的组合,重复可能代表着一个出现新的基因功能的进化机制。(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷APP。
Formation of new chromatin domains determines pathogenicity of genomic duplications
Martin Franke, Daniel M. Ibrahim, Guillaume Andrey, Wibke Schwarzer, Verena Heinrich, Robert Schöpflin, Katerina Kraft, Rieke Kempfer, Ivana Jerković, Wing-Lee Chan, Malte Spielmann, Bernd Timmermann, Lars Wittler, Ingo Kurth, Paola Cambiaso, Orsetta Zuffardi, Gunnar Houge, Lindsay Lambie, Francesco Brancati, Ana Pombo, Martin Vingron, Francois Spitz & Stefan Mundlos
 基因君官网
基因君官网