
据国外媒体报道,近日瑞典科学家宣布对人类健康胚胎的遗传基因进行了编辑修改,目前胚胎依旧发育良好。研究人员对什么实现了精确编辑?为何这项研究会富有争议? 根据美国国家公共电台的报道,在近期实验中,斯德哥尔摩卡罗林斯卡研究所生物学家雷德里克·兰纳(Fredrik Lanner)以及其同事使用基因编辑工具注入人类胚胎,对胚胎DNA做出了精准改变。相关基因编辑是在人类胚胎刚刚受精几天后完成的,此时胚胎还处于发育的早期阶段。
研究人员表示,他们希望这项研究有助于掌握胚胎早期发育状况,未来或将对治疗不孕不育症以及预防流产产生积极作用。以下是关于相关研究的五个关键问题:
一、这并不是科学家首次尝试编辑人类胚胎基因
2015年,中国科学家进行了一项研究,试图改变人类胚胎中的基因,特别是改变涉及供血障碍β地中海贫血症的相关基因。一年之后,中国另一支研究小组也尝试编辑人类胚胎以抵御艾滋病毒对人体的感染。但在以上两个实验中,经过编辑的人类胚胎并未能完全发育成人类婴儿。据推测这可能是由于在试管授精期间胚胎由两个精子受精完成,因此包含了一组多余的染色体,使胚胎在发育关键时期无法继续发育存活。
二、经过编辑的胚胎将不会用于怀孕生育
相比之下,兰纳编辑的人类胚胎非常健康。从理论上讲,该胚胎能够导致怀孕生育。根据NPR报道,该胚胎来自于一对夫妇的捐赠。但是兰纳表示,他不会让胚胎发育超过14天,最初计划仅仅是让该胚胎发育7天时间。兰纳指出:“我反对以任何方式培育‘设计婴儿’。”
三、这项最新研究的目的在于掌握发育中的基因
兰纳和同事将使用一种称之为“CRISPR-Cas9”的基因编辑技术,以此开启或者关闭胚胎发育早期阶段的一些特殊基因。通过这种方法,研究人员希望掌握更多基因在胚胎发育过程中的作用,尤其是导致人们不孕不育的基因。在研究的早期阶段,兰纳和其同事研究了88个人类胚胎早期发育阶段的基因情况,这将有助于研究人员确定新的研究中经过编辑的基因。
四、人类胚胎编辑仍有争议
虽然这项最新研究中兰纳和同事明确表示胚胎发育时间不会超过14天,但是这项研究仍受到一些科学家们的关注与担忧。美国加利福尼亚州基因和社会研究中心的马尔西·达诺夫斯基(Marcy Darnovsky)在接受NPR采访时指出,最令人担忧的一个问题是,人类胚胎的基因编辑技术是最新的,研究人员很容易犯错,导致新的人类遗传疾病的出现。
另一个关注的问题是,这项研究或将会朝向“设计婴儿”的方向发展。反对者表示,应当对该技术进行更多讨论,以防止该技术的滥用。在二月份的一份声明中,达诺夫斯基指出,“目前,关于这种对社会造成潜在影响技术问题的相关讨论才刚刚开始。现在要确保基因编辑技术不会被用于设计婴儿。”
五、人类胚胎的基因编辑技术正逐渐被人们接纳
近期,在以提高人体健康为由的情况下,各种科研活动开始被允许实验人类胚胎编辑技术,。在2015年12月召开的人类基因编辑国际峰会上,研究人员就人类胚胎编辑实验的实施以及限制做了相关讨论。
该峰会指出,人类胚胎编辑技术不得用于怀孕生育。峰会表示,用于生育的人类胚胎编辑技术是“不负责任”的!
然而,峰会成员也表示,诸如兰纳这种使用人类基因编辑技术的基础研究是可以接受的。据悉,英国一个研究小组在早期胚胎发育阶段被批准使用了CRISPR技术,这项研究可使人类胚胎存活,但是依据相关规定胚胎发育7天就将被终止。(生物谷 Bioon.com)
图片来源:medicalxpress.com
2017年4月7日 讯 /生物谷BIOON/ –日前,一项刊登在国际杂志Cancer Discovery上的研究报告中,来自美国杜克癌症研究所(Duke Cancer Institute)的研究人员通过研究发现了当细胞处于压力状态下其所经历的一种未知的步骤过程,相关研究或为科学家们理解DNA损伤的分子机制提供了新的线索和思路,DNA损伤一直是科学家们研究机体衰老和癌症的核心。
研究者Michael Kastan博士说道,我们发现了一种全新的通路,当细胞暴露于放射、化学物以及氧化性压力下时,其能够帮助细胞有效处理DNA的损伤;这或许就能够帮助我们解释DNA损伤发生后细胞如何被编程来生存、死亡、突变或者进入到衰老状态。
这项研究的思路源于科学家们对p53基因的研究,该基因主要参与了细胞循环的调节以及细胞的程序性死亡过程;当功能正常时,p53就能够阻断肿瘤的形成,而且该基因也是人类癌症中最常见的一种突变基因,研究者Kastan进行的这项最新研究就阐明了p53在调节细胞应对DNA损伤效应中的关键角色。
科学家们对p53的功能比较了解,但本文研究中,研究人员深入剖析了选择性的基因剪切在影响基因功能中的重要作用,当单一基因编码多个蛋白时其就会发生选择性的基因剪切。当细胞暴露于特殊的X射线辐射下时,研究者就能够观察到这种机制,但该研究对于科学家们深入理解其它形式的细胞压力和DNA损伤也具有重要的意义。Kastan博士表示,很多其它重要的细胞内基因似乎都会被这种新型通路所调节,目前我们正在进行其它研究来对此进行证实。
最后研究者表示,这种新鉴别出的通路能够诱导p53和其它基因产物出现特殊类型的改变,当然这就提出了一种可能性,即研究者就能够选择性地调节这种改变,从而来保留p53基因的有益行为,从而以此作为一种特殊方法来降低放疗对机体所带来的副作用。(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转发,转载需授权!点击 获取授权 。更多资讯请下载生物谷 app.
原始出处:
Jing Chen, John Crutchley, Dadong Zhang, et al. Identification of a DNA Damage-induced Alternative Splicing Pathway that Regulates p53 and Cellular Senescence Markers. Cancer Discovery (2017). DOI: 10.1158/2159-8290.CD-16-0908.
2017年4月7日讯 /生物谷BIOON /——根据宾夕法尼亚大学的Ronnie Sebro、波士顿大学公共卫生学院Josée Dupuis(通讯作者)、加州大学旧金山分校Neil Risch最新发表在PLOS Genetics上的一项研究,两夫妻相像可能并不一定是偶然,也可能是由于结婚的两个人具有相同的祖先:这对不同人群的基因有着很重要的影响。
直到最近,大多数人都会在邻近的地区择偶。经过很多代之后,这种邻近的婚姻关系创造出了一种基因结构,有可能导致这类人群的遗传研究发生偏差。在一项关于美国人多代择偶模式的初步研究中,研究人员调查了参与弗雷明汉研究中的三代白人夫妻的基因相似性,这项研究起始于1948年,一直在研究弗雷明汉居民的心脏健康。
使用这些遗传学数据,研究人员确定了879对夫妇的祖先的特征,结果发现来自北欧、南欧和德系犹太人血统的人倾向于选择具有相同背景的配偶。但是在连续世代中,人们选择相同祖先背景的配偶的可能性较低。他们还发现择偶膜式导致彼此之间具有更多的基因相似性,这超过了研究人员的预期。但是这种择偶模式导致的基因结构已经随着时间慢慢减少。
这项发现反映了弗雷明汉的人口模式,以及这些模式在过去60年间的改变。一群人群的基因相似性是遗传学研究中的一个重要考虑因素,因为在鉴定疾病相关基因区域时,它会导致假阳性,影响人们对一种疾病随着基因遗传的程度的评估。(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转发,转载需授权!点击 获取授权 。更多资讯请下载生物谷 app.
原文出处:
Sebro R, Peloso GM, Dupuis J, Risch NJ (2017) Structured mating: Patterns and implications. PLoS Genet 13(4): e1006655. DOI: 10.1371/journal.pgen.1006655


2017年4月6日/生物谷BIOON/—在一项新的研究中,来自美国华盛顿州立大学的研究人员发现一种特定的基因如何参与三种不同的动物(包括人类)经历的睡眠质量。这种基因和它的功能为科学家们探究睡眠如何发挥作用和动物为何迫切地需要睡眠开辟一种新的途径。相关研究结果发表在2017年4月5日的Science Advances期刊上,论文标题为“Normal sleep requires the astrocyte brain-type fatty acid binding protein FABP7”。
论文通信作者、华盛顿州立大学埃尔森-弗洛伊德医学院助理教授Jason Gerstner说,“睡眠必需发挥着某种重要的功能。但是作为科学家,我们仍然不能够理解这种功能是什么。一种更接近于发现这一点的方法是理解它是如何受到调节的,或者哪些过程在不同动物物种中都存在。”
当作为美国威斯康星大学的一名博士生时,Gerstner就研究了哪些基因的表达在醒睡周期(sleep-wake cycle)发生变化,结果发现在小鼠整个大脑中,FABP7基因的表达在一天中发生变化。
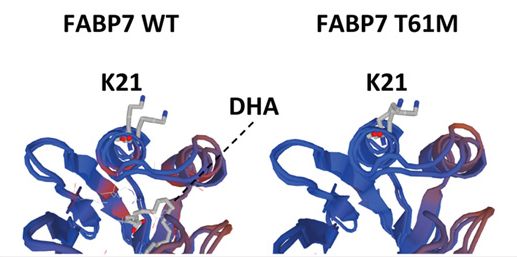
Gerstner和他的同事们观察到相比于具有完整FABP7基因的正常小鼠,这种基因遭受敲除的小鼠睡觉时更容易醒。这提示着这种基因是哺乳动物正常睡眠所必需的。
为了观察FABP7是否确实人类正常睡眠所必需的,Gerstner和来自日本的同事们研究了来自将近300名日本男性的数据,这些男性接受为期7天的睡眠研究,包括分析他们的DNA。结果发现他们中的29人具有基因FABP7变异体。正如那些基因敲除小鼠那样,这29人往往睡觉时更容易醒。尽管他们具有与其他男性一样的睡眠量,但是他们的睡眠并不好,这是因为当他们应当睡眠时,他们醒来多次。
最终,这些研究人员构建出转基因果蝇。他们将发生突变的和正常的人FABP7基因插入到果蝇的星形胶质细胞(神经胶质细胞的一种)中。长期以来,神经胶质细胞(glial cell)被认为仅是给神经元(大脑中的信息处理者)提供支持作用。但是科学家们最近已发现如同神经元那样,神经胶质细胞释放神经递质和控制行为。
为了监控这些果蝇的睡眠,这些研究人员使用一种商业的“果蝇活动监控器(Drosophila Activity Monitor)”:利用红外光束自动地记录活动变化以便确定果蝇是睡着还是醒着。如果这种红外光束持续至少5分钟,那么这种监控器就作出结论:果蝇睡着了。结果证实携带发生突变的FABP7基因的果蝇在正常的睡眠时间期间更加频繁地中断这种红外光束。正如缺乏发挥正常功能的FABP7基因的小鼠和人类那样,FABP7发生突变的果蝇睡觉时更容易醒。
Gerstner说,“这提示着在这三种物种的星形胶质细胞中存在着某种调节深度睡眠的内在机制。”
再者,他说,“我们首次真正地对一种特定的细胞和分子通路在这三种物种中的复杂行为中发挥的作用获得新的见解。”
特别令人关注的是,果蝇已在地球上存在了大约6000万年。
Gerstner说,“这提示着我们发现了一种在进化过程中持续存在的古老机制。”
尽管这些研究人员对发现一种强烈地影响睡眠的基因感到激动人心,但是他们强调几乎可以肯定的是,其他的基因也参与这个过程。
FABP7蛋白参与“脂质信号转导(lipid signaling)”,将脂肪运送到细胞核中以便激活控制生长和代谢的基因。如今,Gerstner和他的同事们将观察这种功能可能如何与关于睡眠为何重要的当前理论存在交叉。这些理论包括睡眠对神经元活性、能量使用与储存、记忆与学习是重要的。(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷APP。
原始出处:
Jason R. Gerstner, Isaac J. Perron, Samantha M. Riedy et al. Normal sleep requires the astrocyte brain-type fatty acid binding protein FABP7. Science Advances, 05 Apr 2017, 3(4):e1602663, doi:10.1126/sciadv.1602663
2017年4月5日/生物谷BIOON/—大多数DNA并不编码蛋白。了解这种基因组“暗物质”如何和何时在基因调节的何处发挥作用是一个巨大的任务。如今,科学家们开发出的一种工具可能提供帮助。在一篇于2017年4月3日在线发表在Nature Biotechnology期刊上的论文中,来自美国杜克大学的研究人员描述了一种高通量筛选技术:利用CRISPR-Cas9表观基因组编辑鉴定人细胞基因组中的调节元件。这篇论文的标题为“CRISPR–Cas9 epigenome editing enables high-throughput screening for functional regulatory elements in the human genome”。论文通信作者为来自杜克大学的Gregory E Crawford、Timothy E Reddy和Charles A Gersbach。
Gersbach说,“结果证实导致更常见的复杂疾病(如心血管疾病、糖尿病和神经系统疾病)的大多数基因变异实际上发生于基因之间的调节区域。令人兴奋的事情是有方法对非编码基因组的功能进行标注。”
美国纽约大学的Neville Sanjana(未参与这项研究)在写给《科学家》杂志的电子邮件中写道,“这种非编码基因组是巨大的,鉴定哪些区域在调节蛋白编码基因中发挥着重要作用是充满挑战性的。”他解释道,这项研究“利用CRISPR组合筛选技术有助我们了解非编码基因组中的功能性区域位于何处。”
Gersbach和同事们构建出靶向两个感兴趣的基因位点β-globin和HER2周围的几百万个碱基中的潜在调节元件的向导RNA(gRNA)文库。他们随后产生整合着荧光蛋白的细胞系,其中这种荧光蛋白指示靶基因激活。
这些研究人员将核酸酶活性已被灭活的两种Cas9蛋白版本(被称作dCas9)— dCas9抑制版本(dCas9KRAB)和dCas9激活版本(dCas9p300)—中的一种导入到他们产生的细胞系中。dCas9KRAB招募让组蛋白H3K9发生甲基化的蛋白,从而导致异染色质形成和靶序列上的基因抑制。dCas9p300结合到靶DNA增强子或启动子上,促进组蛋白H3K27发生乙酰化,从而导致基因激活。
接下来,这些研究人员将较低水平的gRNA文库导入到他们产生的细胞系中以便确保单个gRNA存在于每个细胞中。他们随后基于荧光分选这些细胞,并且对存在于发生特别高水平和低水平靶基因表达的细胞中的gRNA进行测序。
序列鉴定印证了已知的调节元件,并且揭示出其他的DNA序列的新作用。很多这些序列(尽管不是所有序列)出现在dCas9KRAB筛选和dCas9p300筛选中。一些序列似乎对一种细胞类型中的基因发挥着调节作用,但是对另一种细胞类型中的相同基因并不会起着调节作用。尽管这些观察到的基因表达变化是微妙的,但是这些研究人员证实了单个DNA序列的调节作用。
Reddy告诉《科学家》杂志,“我们知道这种表观基因组的几个方面与基因调节变化存在着极强的关联性,而且我们总是努力将这些观察结果转化为对基因实际上是如何受到调节的真正理解。”
Reddy说,“我们在此之前并不知道我们观察到的这种特定的表观遗传修饰是否存在一种因果关系。但是,我们如今确实从这项研究和来自我们的实验室和其他人的其他研究了解到对这种表观基因组进行修饰确实在调节一些靶基因中发挥着作用。”
Reddy、Gersbach和他们的同事们正在扩大这种筛选技术以便研究不同细胞类型和不同组织类型中整个基因组的潜在调节元件。他们也计划利用这种技术更好地理解基因调节异常导致的疾病。(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷APP。
原始出处:
Tyler S Klann, Joshua B Black, Malathi Chellappan et al. CRISPR–Cas9 epigenome editing enables high-throughput screening for functional regulatory elements in the human genome. Nature Biotechnology, Published online 03 April 2017, doi:10.1038/nbt.3853

中国研究人员4日报告说,他们运用基因治疗技术,让1型糖尿病小鼠体内产生大量欧米茄-3脂肪酸,成功逆转疾病进程。这为治愈饱受1型糖尿病折磨的患者带来了新希望。
这项由广东工业大学赵子建及李芳红两名教授领军完成的研究发表在新一期美国《临床检查杂志》上。1型糖尿病是一种自身免疫疾病,其患者自身免疫系统会错误攻击并摧毁分泌胰岛素的胰岛细胞,从而导致胰岛功能丧失并最终发展为1型糖尿病。1型糖尿病多发于青少年,因此也曾被称为青少年糖尿病。
据赵子建介绍,1型糖尿病患者一旦发病就无法逆转,病人将终身依赖胰岛素注射,并要经常监控血糖。目前,世界上还没有药物或技术可控制自身免疫并促使胰岛细胞再生,以达到逆转自身免疫进程并治愈糖尿病的目标。
赵子建和李芳红领军的团队从国外多年的临床研究中得到启示:有1型糖尿病遗传家族史的婴幼儿在断奶后长期服用深海鱼油,可以显着降低1型糖尿病的发病风险。但他们也发现,如果想通过补充鱼油逆转自身免疫失衡和糖尿病发展进程,需要的剂量大幅超出目前临床许可的剂量,在现实中难以实现。
为此,研究人员通过基因治疗手段表达一种特异的酶,使得小鼠体内能够产生大量欧米茄-3脂肪酸EPA和DHA。
结果显示,这种新疗法矫正了自身免疫系统失衡,逆转了1型糖尿病的发展进程。血液中的胰岛素回归到正常水平,血糖也降低到正常范围,胰腺中还出现大量新生的分泌胰岛素的胰岛细胞。这意味着,新疗法可帮助实现长期血糖稳定,让患者彻底摆脱对外源胰岛素的依赖。
赵子建说,这是第一次通过单一的治疗技术在控制和逆转自身免疫系统失衡的同时,促进了胰岛细胞新生,使得治愈1型糖尿病成为可能。新疗法还可能用于治疗2型糖尿病以及其他一些自身免疫失调疾病,如多发性硬化症、系统性红斑狼疮、类风湿性关节炎等。

基因治疗是指将外源正常基因导入靶向,以纠正或补偿因基因缺陷或异常引起的疾病,从而达到治疗多种疾病的目的。上个世纪九十年代,基因疗法首次用于治疗“重度联合免疫缺陷症”(SCID),至今已经进行了两千余例的人体试验。早期临床试验结果表明,基因疗法在治疗白血病、血友病、地中海贫血、帕金森症、阿尔茨海默病等上效果显著,甚至能够令盲人重获光明,而更多的动物模型试验显示,基因治疗大有根治更多顽疾的可能。
近年来从事癌症研究的科学家们也相继不断开发出治疗癌症的新型基因疗法,而且也取得了一定的可喜成绩,比如今年5月份刊登在国际杂志Oncotarget上的一项研究报告中,来自意大利的研究人员就发现,利用基因疗法或许可以很好地对抗恶性胶质瘤,这对于开发治疗恶性胶质瘤的新型疗法或提供了新的希望;
当然还有很多利用基因疗法治疗癌症的报道,本文中,小编就对此进行了汇总,与各位一起学习。

近日,英国研究者采用一种基因疗法,成功治愈了一个患有耐药性白血病的一岁女孩,成为免疫细胞疗法治愈“不可治愈”的癌症的全球首个案例。
该患儿名为Layla Richards,在位于伦敦中心的大奥蒙德街医院(Great Ormond Street Hospital)接受治疗,该医院在治疗白血病和其他癌症方面有领先优势。经过几个月的隔离治疗以后,Layla已经摆脱癌症,在家里恢复得不错。医生认为她的治疗结果是“简直就是一个奇迹”,专家也表示这代表人类在治疗白血病方面向前迈进了一大步。
Layla被诊断出癌症时只有14周。就在断奶不久之后,她出现了心跳加快的症状。血液检测证实Layla患有急性淋巴细胞白血病中较有侵略性的一种,这是儿童白血病最常见的形式。
医生对她进行了数轮化疗,随后又进行了骨髓移植治疗,企图帮助她摆脱癌症,但七周之后,家人被告知Layla体内的癌细胞又回来了。
医生告诉Layla的父母,已经没有任何方法可以挽救Layla了,并且建议临终关怀。但是Layla的母亲Lisa Foley表示不想放弃,要求医生尝试一切方法,即使是从没有在人身上试验过的方法。随后,医院专家告诉这家人,他们正在开发一项新的试验性疗法。
doi:10.1007/s13566-015-0239-y
来自美国休斯顿卫理公会医院的研究人员进行了一项长期临床研究,研究结果表明放射治疗结合”自杀基因治疗”技术可以为前列腺癌病人提供安全有效的治疗。”自杀式基因治疗“技术通过对前列腺癌细胞进行基因修饰使得癌细胞向病人免疫系统发送信号实现”自杀”过程。相关研究结果发表在国际学术期刊Journal of Radiation Oncology上。
共有66名前列腺癌病人参与了1999年到2003年间的II期临床研究,研究人员将参与者分为两组,其中一组病人的肿瘤细胞只存在于前列腺组织,研究人员将该组命名为Arm A,这些病人只接受放射治疗,而另外一组病人携带更具侵袭性的前列腺癌细胞,研究人员将该组命名为Arm B,这组病人要同时接受放射治疗和激素治疗。Arm A组内的病人在研究过程中接受了两次试验性基因治疗,而Arm B组的病人接受了三次基因治疗。

【3】Nat Commun:新型基因疗法或可有效抑制癌症转移
doi:10.1038/ncomms12868
癌细胞在机体中扩散被称之为癌症转移,其实引发乳腺癌患者死亡的主要原因;近日,一项刊登于国际杂志Nature Communications上的研究报告中,来自MIT的研究人员开发了一种新型的基因疗法,该疗法或有望抑制乳腺癌发生转移。文章中,研究者利用microRNAs来控制癌症转移,microRNAs分子是一种能够调节基因表达的小型非编码RNA分子。
据研究者Natalie Artzi介绍,这种新型疗法能够结合化学疗法,在癌症扩散之前治疗早期阶段的乳腺癌;我们的想法是,如果癌症在早期阶段能够被诊断出来,除了利用化疗来治疗原发性肿瘤外,利用特殊的microRNAs分子进行治疗或许也是一种不错的选择,研究者的目的就在于抑制引发癌症转移的癌细胞发生扩散。通过microRNAs进行的基因表达的调节被认为在抑制癌细胞发生扩散上扮演着重要作用;近来研究者通过研究发现,这种基因表达调节的干扰,比如称为单核苷酸多态性(SNPs)的遗传改变或许对于基因表达的水平有着明显的影响,而且还会引发患癌风险的增加。
【4】基因疗法帮助治疗癌症
据报道,目前一种新的基因疗法已能帮助患癌症的狗延长寿命,专家估计下一步这种新的基因疗法将用于人类,帮助治疗癌症病人甚至可以实现人类的“长生不老”。
美国著名的德克萨斯伍德兰兹 VGX Pharmaceuticals Inc.制药公司首席研究员德勒吉亚·奥克利医学博士称,这种新基因疗法最直接的作用是减轻癌症带来的并发症,增强病人的肌肉力量和改善病人不断减轻的体重与贫血。专家指出,50%以上的癌症患者都会产生这些并发症,通常病人会出现食欲不振和疲劳、肌肉无力、体重减轻。由于无法获得更多的营养,所以癌症病人的存活率不断下降,新的基因疗法正是以此为突破口,采用特定的治疗目标,先降低并发症的影响然后再提高病人的存活率。
研发人员德勒吉亚·奥克利医学博士说:“我们的基因疗法可以欺骗人体内的癌症细胞,在人体内自然产生一些生长激素,这些激素可以恢复患者的肌肉功能,并且抵抗癌症带来的并发症。”专家介绍称,这种疗法使用了一种滤毒性DNA分子,被称为质粒。质粒是一种染色体外的遗传物质,能够编码控制生长激素的释放(简称GHRH)。这种质粒可以刺激内源性生长激素和另一生长物质胰岛素生长因子·1 (IFG·1)产生合成作用,对于普通人来说,质粒所产生的生长激素可以有效的减缓人体代谢衰老和防止人体器官的衰竭,从而实现“长生不老”。

doi:10.1073/pnas.1408538111
近日,来自凯斯西储大学的研究人员通过研究开发了一种新型的可以削弱并杀灭癌细胞的治疗性手段,相关研究发表于国际杂志PNAS上,研究人员表示,他们开发的这种包含遗传和生化的混合型技术可以增加肿瘤抑制性蛋白的水平,从而直接靶向作用癌细胞进而摧毁癌症。
如果实验室的研究发现在动物模型中被证实的话,那么该研究或许就会增强放疗和化疗治疗癌症的效力,而这关键还在于促进“好”蛋白质—p53结合蛋白1(53BP1)的产生,以便可以抑制癌症。研究者Youwei Zhang说道,我们的研究发现或许可以帮助开发新型的基因疗法,来增加53BP1的产量从而杀灭癌细胞,目前我们正在设计增加53BP1水平的分子。
而本文研究还涉及DNA的修复,DNA的损伤是机体DNA化学结构的不规律改变而致,从而会损伤甚至杀灭细胞,而对DNA的致死性改变则是染色体中DNA双链的破碎,DNA双链的破碎往往是通过活性氧而引发。我们的机体可以产生两种修复路径,其中一种可以提供快速但不完整的修复,即将破碎的DNA链连接在一起,而第二种路径则是利用完整未受损伤的DNA链的信息来指导损伤细胞对破碎的DNA进行修复,文章中研究人员就揭开了一种名为UbcH7的基因在调节DAN双链损伤修复过程中的新型作用,剔除UbcH7后可以引发细胞中53BP1蛋白水平的增加。
原文链接:Treating Cancer with CRISPR?
根据美国国家卫生研究院(NIH)的说法,美国重组DNA顾问委员会(Recombinant DNA Advisory Committee,RAC)下周将审查宾夕法尼亚大学申请首次利用革命性的基因编辑技术CRISPR治疗人类癌症的临床试验。利用CRISPR技术,科学家们能够准确地切割靶DNA。
这项临床研究将从癌症患者体内提取出免疫系统的T细胞。接着,研究人员将利用CRISPR对T细胞进行基因修饰,并将基因修饰后的T细胞灌注回病人体内,这样它们将靶向摧毁肿瘤细胞。
NIH科学政策副主任Carrie Wolinetz在一篇博客帖子中披露了这一审查信息。宾夕法尼亚大学正在开发的这种癌症免疫疗法旨在靶向攻击骨髓瘤、黑色素瘤和肉瘤。
CRISPR技术是在不到四年前开发出来的,但是已正在冲向临床应用。在此之前,一家位于美国马萨诸塞州剑桥市的生物技术公司Editas医药公司(Editas Medicine)说,它打算在2017年开展一项利用CRISPR治疗一种罕见的眼部疾病的临床试验。
相比之下,这项新申请提出的利用CRISPR对人T细胞进行基因编辑治疗癌症的临床试验有可能更早开展。宾夕法尼亚大学并没有立即对寻求评论的要求作出回应,而且开展这项临床研究的时间也不能够确定。
据报道,宾夕法尼亚大学寻求NIH批准利用CRISPR技术剔除T细胞中的两个基因:一个基因是PD-1,它是人体免疫反应的一种关键性的关闭开关,抑制T细胞攻击肿瘤的能力,因此若没有这个基因,T细胞可能就能够让逃避免疫系统检测的肿瘤细胞现形,无处遁逃,当然剔除这个基因也可能给病人带来新的风险;另一个基因是一种T细胞受体编码基因,它能够调动人体的天然防御进行自我保护。

所谓基因疗法,就是利用正常基因填补或替代基因疾病中某些病变或缺失的基因的治疗方法。近年来,英国牛津和美国费城的一些研究人员宣布,他们对因患有罕见基因疾病而影响视力的病人们进行了治疗,成功使他们的视力获得改善。意大利的科学家们也宣布,他们使患有另外两种基因疾病的病人病情得到了减轻。这些研究结果,以及Web of Science网站上记录的引文统计,都着眼于基因疗法中的一个类别——而它从诞生伊始,就可谓是备受阻挠。
1980年,加州大学洛杉矶分校(UCLA)的一名研究人员马丁·J·克莱因(Martin J. Cline)受到了美国研究机构的谴责,因为他试图使用基因疗法治疗地中海贫血(thalassemia),这在当时看来是一种违背道德的行为。克莱因原本获准在该疗法中使用两种各自独立的基因,然而在进行实验时,他采用的却是两种与同一质粒载体相连的基因。也就是说,他成了首次将重组DNA应用于人体的人。然而,这种疗法却并未起到什么作用,随之而来的舆论骚动也使得他没能对失败的原因进行深究。九十年代初期,在获得完全批准的情况下,人们又做了一些尝试,用同样的方法治疗儿童严重联合免疫综合征(severe combined immunodeficiency in children),其中一项治疗就是由上文中提到的意大利研究组展开的。接着,在1999年,一名病人在试验中死于一系列不良反应。这一事件引起了公众的质疑,其它试验中一些普遍存在的问题也随即被揭露出来。于是,科学家和相关机构又一次受到了人们的谴责,并被施以罚款。
【8】Science:新型基因突变或为癌症疗法的开发提供新思路
DOI: 10.1126/science.1234907
日前,西奈山伊坎医学院的科学家通过研究发现了人类或动物组织中的一种新型基因突变,或许是癌症的一种潜在的新型靶点疗法,比如治疗乳腺癌以及脑癌等,这种名为PTEN-long的突变可以使得细胞维持健康状态,同时抑制肿瘤细胞的发育。这一里程碑式的研究发表在6月6日的《科学》(Science)杂志上。
在这项新研究中,科学家发现了一个肿瘤抑制基因PTEN的突变,随后确定其为乳腺癌、前列腺癌和脑癌等癌症第二种最常见的突变。PTEN编码生成一种由403个氨基酸组成的脂质磷酸酶蛋白,PTEN蛋白对于细胞生长、增殖和存活至关重要。PTEN遗传失活可导致肿瘤形成。
研究小组对人类细胞进行了分析,发现一个PTEN变异体具有一段额外的蛋白质序列,比正常PTEN长43%。他们将这一新变异体称之为PTEN-Long。像PTEN一样,PTEN-Long具有相同的酶活性;而不同的是,它可以通过细胞分泌出来,并进入到其他细胞内,表明添加的蛋白质序列发挥了肿瘤抑制基因递送系统的作用。

【9】Hum Gene Ther:新型基因疗法使抗肿瘤免疫反应持久
doi: 10.1089/hum.2012.202
根据在Human Gene Therapy杂志中发表的一项研究揭示:引入一种新的改性的、免疫刺激的人类干细胞是可行和有效的,能实现持久的免疫治疗,来治疗白血病和恶性淋巴瘤。
Satiro Nakamura De Oliveira和大卫格芬医学院的同事、加州大学洛杉矶分校、得克萨斯大学MD安德森癌症中心和休斯敦大学研究人员,描述了他们开发的能递送嵌合抗原受体或CARS的基因转移方法,新方法能使得免疫系统靶向来源于B淋巴细胞的肿瘤细胞。
作者在文章“Modification of Hematopoietic Stem/Progenitor Cells with CD19-specific Chimeric Antigen Receptors as a Novel approach for Cancer Immunotherapy”中写道,通过在人类造血干细胞包装CARS,血液中的免疫治疗受体将在相当长的一段时间保持存在。(生物谷Bioon.com)
本文系生物谷原创编译整理,欢迎转发,转载需授权!点击 获取授权 。更多资讯请下载生物谷app.
生物谷更多精彩盘点!敬请期待!