中国科学家在Cell子刊Trends in cancer发表融合基因评论
基因融合一直被认为是肿瘤独有的特征。最近弗吉尼亚大学李辉实验室发现几乎所有正常器官和组织中都存在融合基因,且具有极其重要的生理功能。他的研究方向是融合基因在肿瘤和正常发育过程中的病理和生理功能以及分子机制。这篇评论总结了融合基因领域的进展和瓶颈以及未来发展方向。目标是寻找肿瘤早期诊断和临床预后和治疗的标志性融合基因。
融合基因(Fusion gene)是指两个基因的全部或一部分序列相互融合为一个新的基因的过程,其有可能是染色体易位、中间缺失或染色体倒置所致的结果,通常具有致瘤性。1960 年,宾夕法尼亚大学教授 Peter Nowel和Fox Chase癌症中心的 David Hungerford 首次发现此类染色体变异。1973 年,芝加哥大学的 Janet Rowley 确认了费城染色体的形成机制来自于染色体易位,并在白血病中发现了第一个融合基因BCR-ABL。随后,在诸多实体瘤如尤文肉瘤、滑膜肉瘤、前列腺癌、肺癌、乳腺癌、卵巢癌等中相继发现了融合基因的存在。目前,越来越多的融合基因在不同肿瘤中被报道。
融合基因领域最成功的例子就是开发了针对融合基因BCR-ABL激酶抑制剂STI-571(伊马替尼,格列卫)。格列卫一直是临床上治疗慢性粒细胞白血病的经典药物;另外一个代表就是前列腺癌SLC45A3-ELK4 融合基因,目前针对该靶点的药物在临床试验中;再有一个代表就是PAX3-FOXO1融合基因一直是横纹肌肉瘤的诊断标准。但因为融合基因的研究有很多技术上的瓶颈,一直很少有突破。
李辉实验室在融合基因领域分子机理有两大理论上的突破。率先报道融合基因的反式剪接在正常发育中出现。该评论第一作者是博士生贾月萌和博士后谢仲秋。总结了实验室近几年在RNA领域取得的两大突破:一是RNA反式剪辑”RNA trans-splicing”,发现JAZF1-JJAZ1融合基因在子宫内膜细胞和PAX3-FOXO1在胚胎发育和干细胞肌肉分化过程中出现。而且发现这两个融合基因在肿瘤中是DNA水平融合(DNA translocation), 在正常细胞中是RNA水平上融合(RNA trans-splicing)。两个单独的RNA可以拼接在一起并产生一融合RNA,翻译成融合蛋白在正常生理发育过程中行使功能。成果发表在顶尖刊物Science, 2008 by Li H(highlighted in Nature Review Genetics and Cell, chosen by NIH official to present to the White House as one of the three major findings funded by NIH that year)和顶尖刊物Cancer Discovery, 2013 by Yuan H; 二是在肿瘤里两个相邻的基因在相同的方向转录,相邻基因的顺式剪接”Splicing of Adjacent Genes (cis-SAGe)” 发表在Cancer Discovery 封面文章 2012 by Zhang Y和PLoS Genet, 2015 by Qin F

(生物谷Bioon.com)
原文摘要:
Intergenically Spliced Chimeric RNAs in Cancer
Gene fusions and their encoded products (fusion RNAs and proteins) are viewed as one of the hallmarks of cancer. Traditionally, they were thought to be generated solely by chromosomal rearrangements. However, recent discoveries of trans-splicing and cis-splicing events between neighboring genes suggest that there are other mechanisms to generate chimeric fusion RNAs without corresponding changes in DNA. In addition, chimeric RNAs have been detected in normal physiology, complicating the use of fusions in cancer detection and therapy. By contrast, ‘intergenically spliced’ fusion RNAs represent a new repertoire of biomarkers and therapeutic targets. We review here current knowledge on chimeric RNAs and implications for cancer detection and treatment, and discuss outstanding questions for the advancement of the field.
英生物银行启动大规模基因测序计划
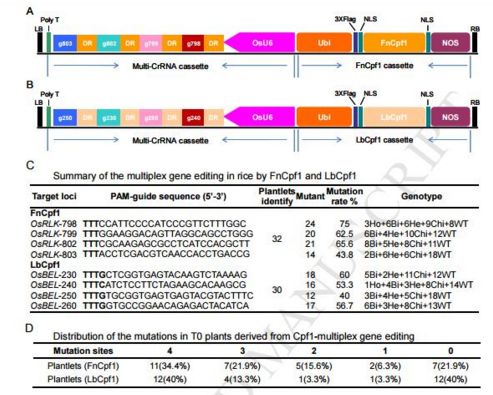
上海生科院利用 CRISPR/Cpf1 系统简单高效实现水稻多基因定点编辑
基因编辑技术成本降低:或被“生物骇客”利用制造生物武器
北京时间9月18日消息,据国外媒体报道,一位业内顶尖的专家警告称,业余的“生物骇客”在处理生物的基因构造时,可能会研发出新型的生物武器。
约翰·帕林顿教授(John Parrington)是牛津大学的一名分子生物学家,他指出,便宜的基因编辑工具正变得越来越容易获取。这让业余的科学家们有了可乘之机,可以改变细菌、酵母菌等生物的基因,赋予它们原本在自然状态不具备的特性。
虽然这些活动中大多数都是无害的,如研发出能够识别饭店中鱼的种类的测试方法、或者发明能够使啤酒具备特殊风味的酵母菌等,但越来越多的人担心,这一技术可能会被人错误地利用,从而造成损害。

生物骇客可能会利用基因编辑技术来发明有害的病毒或细菌。如果这些病毒或细菌发生泄露、或是被用作生物武器的话,就会造成大规模的伤害,因而引起了安保界的恐慌。
FBI(美国联邦调查局)非常担心生物骇客的种种行动,因此在大规模杀伤性武器局下面专门设立了一个分支机构。
帕林顿教授在英国科学节发表演讲时表示,科学界和安保界均担心,不法分子可能会利用该技术发明一种新型的致命病毒或细菌。
他在演讲中指出:“我们都不知道将来会发生什么。安保界人士都在纷纷猜测这件事的发展趋势将会如何。”
全世界正在涌现出越来越多的生物骇客团体,业余“科学家”们纷纷聚到一块儿自学生物。例如,伦敦的一组生物骇客正在研发一种特殊的3D打印技术,把果汁和细菌产生的纤维素整合到一起。

有些生物骇客已经开始利用基因编辑工具CRISPR对酵母菌和植物进行改造了。
去年,《自然》杂志报道称,生物骇客还利用了一系列尖端技术。例如,他们已经开始利用基因编辑工具CRISPR对酵母菌和植物进行改造了。一支团队试图改造酵母菌,让其产生牛奶中含有的一种名叫“酪蛋白”的物质,从而生产出“素食”奶酪。还有些人希望通过改造酵母菌来改变啤酒的口味。
日本的一些生物骇客还希望将一种基因重新引入当地的一种蓝色康乃馨体内,使其恢复到原本的白色状态。
但FBI担心不法分子会对该技术进行滥用。为此,他们正努力与该领域的科学家达成合作,希望能找到一些对抗潜在风险的方法。
FBI大规模杀伤性武器局的特别探员爱德华·尤(Edward You)去年表示:“合成生物技术带来了巨大的好处,但随之而来的还有一些风险。我们应该赶紧识别出这些风险,并开始采取相应的限制措施。”

有人担心,随着基因编辑技术成本越来越低、越来越容易获取,不法分子可能会利用该技术改变传染病细菌的基因,创造出新的病原体,并将其用作生物武器。
2010年,尤先生提出警告称,随着基因编辑技术和开展生物实验的成本降低,与之相关的风险将会越来越高。
“如今做坏事的壁垒越来越低,因此不法分子造成的风险将会比从前更甚。”
日本科学家开发光控技术可精确调节基因表达

Sci Rep:关键基因突变导致女性不孕

Am J Hum Genet:研究找到罕见致盲、致聋遗传病的基因突变
2017年3月25日讯 /生物谷BIOON /——日前科学家宣布他们已经找到了导致一种罕见疾病的遗传因素,这种疾病会导致新生儿耳聋、失明、患白化病、骨头脆弱等。这种综合征叫做COMMAD,当小孩遗传一个基因(MITF)的两个突变(从父母处各遗传一个)时就会发生这种疾病,同时父母还可能由于另一种叫做华尔登布尔氏综合症2A的罕见遗传疾病而失聪。
来自美国国家眼科研究所(NEI)的研究人员宣称还需要进一步的研究了解MITF在胎儿早期发育过程中的作用以及这个基因的突变如何造成华尔登布尔氏综合症2A和COMMAD。
COMMAD代表一系列由于这种疾病导致的症状,包括眼周组织缺失、骨密度异常导致易骨折、眼睛小或者异常、异常的大头、白化病(皮肤、眼睛和头发缺少黑色素)及耳聋。
因为耳聋的人通常会选择与耳聋的人结婚,因此发现COMMAD的遗传因素至关重要。研究人员解释说,这些耳聋的人也许并不知道他们的疾病与华尔登布尔氏综合症2A相关。
研究领导作者Brian Brooks博士在NEI新闻发布会上说道,耳聋夫妇在怀孕之前应该考虑遗传咨询,如果具有患华尔登布尔氏综合症2A的潜在风险,他们就可能将MITF突变遗传给下一代,导致小孩患COMMAD。
Brooks是NEI儿科、发育和遗传眼科学带头人。
这项研究描述了两个不相关的先天患有COMMAD的儿童,他们遗传了来自父母的两个MITF突变基因。
大多数先天聋人没有患华尔登布尔氏综合症2A,研究人员解释说患有该疾病的人丧失听力的同时会出现头发变灰、蓝眼睛、皮肤白皙,有时还会有视力问题。
这项研究最近发表在American Journal of Human Genetics上。(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转发,转载需授权!点击 获取授权 。更多资讯请下载生物谷 app.
原文出处:
Brian P. Brooks et al.Biallelic Mutations in MITF Cause Coloboma, Osteopetrosis, Microphthalmia, Macrocephaly, Albinism, and Deafness.American Journal of Human Genetics.DOI: http://dx.doi.org/10.1016/j.ajhg.2016.11.004
HMG:心脏病发作的记忆储存在我们的基因中
2016年9月17日/生物谷BIOON/–遗传因素和环境因素影响我们的心血管疾病风险。如今,在一项新的研究中,来自瑞典乌普萨拉大学的研究人员发现心脏病发作的记忆能够通过表观遗传变化储存在我们的基因中。相关研究结果于2016年9月15日在线发表在Human Molecular Genetics期刊上,论文标题为“Epigenome Wide Association Study Reveals Differential DNA Methylation in Individuals With a History of Myocardial Infarction”。
在出生时,我们遗传来自我们的父母的基因。在我们的一生当中,开启或关闭基因的DNA化学修饰—所谓的表观遗传变化—会发生。这些变化能够导致不同的疾病产生。在当前的这项研究中,研究人员研究了之前发生过心脏病的人体内的表观遗传变化。
论文共同作者、乌普萨拉大学免疫学、遗传学与病理学系研究员Åsa Johansson说,“在心脏病发作期间,人体通过激活某些基因来作出反应。在这种疾病的急性期期间,这种机制保护心脏组织,并且在心脏病发作之后恢复人体健康。因此,与心脏病发作相关联的表观遗传变化很可能也会发生。”
这项研究的结果表明在经历过心脏病发作的个人体内存在很多表观遗传变化。几个这样的变化发生于与心血管疾病相关联的基因当中。然而,确定这些变化是否导致心脏病产生或者它们是否作为一种与心脏病发作相关联的基因激活记忆继续存在仍然是不可能的。
Åsa Johansson说,“我们希望我们的新的研究结果应当会增加人们了解表观遗传变化在心脏病发作的临床表现中的重要性,而且就长远而言,这可能导致人们开发出更好的药物和治疗方法。”(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷APP。
Epigenome Wide Association Study Reveals Differential DNA Methylation in Individuals With a History of Myocardial Infarction
Mathias Rask-Andersen, David Martinsson1,*, Muhammad Ahsan1, Stefan Enroth1, Weronica E Ek1, Ulf Gyllensten1 and Åsa Johansson
相关会议推荐

2016(第三届)健康管理产业峰会:慢病管理趋势新探讨
会议时间:2016.11.24-2016.11.25 会议地点:上海
重磅!Nat Methods单细胞基因组突变检测取得突破性进展

2017年3月25日讯 /生物谷BIOON /——近日来自爱因斯坦医学院的研究人员宣布开发并验证了一种能够准确鉴定单细胞基因组基因突变的新方法,相关研究发表在Nature Methods上,文章通讯作者为Jan Vijg博士,他是爱因斯坦医学院遗传学系主任和分子遗传学Lola and Saul Kramer主席。
在研究人员能够分析单细胞基因组之前,他们首先需要获得足够的DNA,这个过程叫做全基因组扩增(WGA),但是WGA通常会产生核算序列错误,造成突变的假阳性。在他们的这篇新文章中,Vijg博士及其同事描述了一种能够准确鉴定突变(单核苷酸变异分析)是否存在于单细胞基因组的方法。
研究人员开发的新方法将他们开发的两种技术结合在了一起:叫做单细胞多重置换扩增(SCMDA)和单细胞变异“访客”技术——可以修复基因扩增过程中发生的核苷酸序列错误的技术。通过比较发现这种方法比目前市场上用于基因组分析的技术效果更好。
“能够鉴定人体单细胞基因突变很重要,因为这可以在癌症早期告诉我们患癌的风险。”Vijg博士说道。他举例说那些在很年轻的年龄就患乳腺癌的女性,其中一些是由于遗传了突变的DNA修复基因BRCA1/2,这些缺陷导致乳腺细胞在发育过程中发生一系列突变,最重的导致乳腺癌。“但是许多女性在没有BRCA1/21突变的情况下也会很早患癌症。”他补充道,“这些女性也有基因修复缺陷,但是我们不知道,因为DNA修复过程很复杂。史上首次,我们的基因组分析方法允许我们直接评估她们患乳腺癌的风险。我们能够对几个单细胞进行测序,以检测这些细胞中有多少基因突变,以及这些基因突变是否远高于不患癌症的病人的细胞中的基因突变。”
除了可以评估人体患癌风险,这种可以鉴定单细胞基因突变的新方法还可以帮助揭示基因突变在人体衰老中的作用。
这篇文章叫做“Accurate identification of single nucleotide variants in whole genome amplified single cells”。(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转发,转载需授权!点击 获取授权 。更多资讯请下载生物谷 app.
原文出处:
Xiao Dong et al. Accurate identification of single-nucleotide variants in whole-genome-amplified single cells, Nature Methods (2017). DOI: 10.1038/nmeth.4227
 基因君官网
基因君官网
