2017年3月11日/生物谷BIOON/—在一项新的研究中,来自美国伊利诺伊大学厄巴纳-香槟分校的微生物学教授Bill Metcalf和博士后研究员Dipti Nayak首次记录了在古生菌(Archaea,也译作古细菌,或古菌)中使用CRISPR-Cas9介导的基因组编辑。他们的突破性工作有潜力在未来极大地加快研究这类有机体,包括对全球气候变化的影响。相关研究结果于2017年3月1日在线发表在PNAS期刊上,论文标题为“Cas9-mediated genome editing in the methanogenic archaeon Methanosarcina acetivorans”。
Nayak解释道,“在大多数情形下,作为我们的模式古生菌,乙酸甲烷八叠球菌(Methanosarcina acetivorans)的倍增时间是8到10小时,而大肠杆菌能够在大约30分钟内增殖一倍。这意味着进行遗传学研究和获得突变体能够需要数月时间,而同样的事情在大肠杆菌中开展仅需三天。在通常情况下,CRISPR-Cas9能够让我们做的事情就是加快这整个过程。它解决了一个重大的瓶颈:在这种古生菌中开展遗传学研究。”
Nayak继续说道,“再者,利用我们之前的技术,必须一步一步地引入突变。利用这种新的技术,我们能够同时引入多种突变。我们能够利用CRISPR指数级地扩大这个突变体产生过程。”
CRISPR起初是作为细菌和古生菌中的一种免疫防御系统发挥作用。通过鉴定出和储存短的外源病毒DNA片段,Cas蛋白能够在未来快速地识别这种DNA片段,也因此能够快速地破坏这种DNA片段,从而保护细菌和古生菌免受病毒再次入侵。
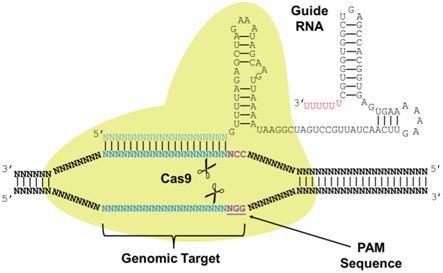
自从发现CRISPR-Cas9以来,它就经过改进在实验室中对基因组进行编辑。通过将Cas9与一种经过特定改造的向导RNA(gRNA)配合使用,这种CRISPR系统能够在任意位点上切割细胞的基因组以至于能够移除现存的基因或者加入新的基因。这种系统已被广泛地用于编辑真核系统,如酵母,植物,鱼,甚至人细胞。然而,在原核生物中使用这种系统遇到了障碍,这部分上是由于它们的不同的细胞过程。
为了在细胞中使用CRISPR系统,研究人员必须开发出一种将细胞偏好的DNA修复系统考虑在内的操作方法:在CRISPR“分子剪刀”切割染色体后,细胞的修复系统介入进来,通过一种能够被用来移除或添加附加的遗传物质的机制修复这种DNA损伤。在真核细胞中,这种修复机制为非同源末端连接(Non-Homologous End Joining, NHEJ)。尽管这种机制用于CRISPR介导的基因组编辑中,但是它往往在修复过程中产生遗传错误:作为DNA梯子中的横档,核苷酸经常在切割位点上被加入或移除。
NHEJ机制在包括古生菌在内的原核生物中是非常罕见的;相反,它们的DNA损伤更多的时候是通过一种被称作同源重组修复(homology-directed repair, HDR)的机制加以修复的。通过将DNA损伤与一种DNA模板进行比较,HDR机制获得一种“确定性的模板”,其最终结果能够被提前预测,并且能够按照研究人员的需要加以精确地调整。
Nayak解释道,在很多方面,HDR机制确实适合于基因组编辑:“由于NHEJ的存在,我们想要在真核生物中利用CRISPR-Cas9进行定向编辑。就这点而言,大多数古生菌菌株并没有NHEJ机制倒是个好消息,因此,它们的唯一能够修复DNA的途径就是这种确定性的同源修复机制(即HDR)。”
尽管看起来似乎违反直觉,Nayak和Metcalf的首批CRISPR-Cas9应用之一就是在乙酸甲烷八叠球菌中引入NHEJ机制。Nayak说,尽管通常不大适合用于基因组编辑,但是NHEJ也有优于HDR机制的地方:“如果你仅想要移除一个基因,如果不在乎如何移除…,那么NHEJ机制实际上更加高效。”
Nayak说,通过这种引入的NHEJ修复系统开展基因敲除研究,即单个基因被移除或沉默以便观察会产生什么变化和这个基因可能影响哪些过程,未来的研究将能够组装出乙酸甲烷八叠球菌和其他的古生菌物种的基因图谱。
Nayak说,“乙酸甲烷八叠球菌是遗传上最容易处理的古生菌菌株之一。产甲烷菌是一类每年产生几十亿吨这种强效温室气体的古生菌,在全球碳循环中发挥着关键的作用,因此显著地促进全球气候变化。”通过研究乙酸甲烷八叠球菌(也是一种产甲烷菌)和其他的有机体,Nayak和Metcalf希望能够更加深入地理解古生菌遗传学特征以及它们在更加广泛的环境过程中发挥的作用。
总之,这项研究代表着研究和操纵古生菌的一个激动人心的新方向。Nayak作出结论,“我们开展这项研究的目的在于确定在古生菌中进行CRISPR-Cas9基因组编辑是否是可行的。我们发现这不仅是可行的,而且它表现得非常好,甚至可与真核生物中的表现相比拟。”(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷app。
原始出处:
Dipti D. Nayak, William W. Metcalf. Cas9-mediated genome editing in the methanogenic archaeon Methanosarcina acetivorans. PNAS, Published Online: 1 March 2017, doi:10.1073/pnas.1618596114.
 基因君官网
基因君官网