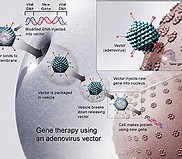


2016年9月5日讯 /生物谷BIOON/ –来自美国克利夫兰的研究人员去年曾经在非裔美国病人的结肠癌中发现一些新的基因突变,最近他们又发现携带这些突变的肿瘤恶性程度很高,并且容易出现复发和转移。这些发现或可部分解释为何相比于其他人群非裔美国人患结肠癌的几率和死亡率最高。
相关研究结果发表在国际学术期刊JNCI上。
去年该研究团队曾在非裔美国结肠癌病人中发现15个新突变基因,这些基因在患有结肠癌的白种人中几乎不会发生突变。该研究调查了携带这些突变的非裔美国结直肠癌病人的结果。
该研究共包含66名处于临床I-III期的结直肠癌病人,研究人员发现携带突变的病人出现癌症转移的几率更高,而相比于不携带突变的病人来说携带突变的III期病人复发的几率几乎是其三倍。
该文章作者Joseph E. Willis表示这项研究是非常有意义的,能够帮助进一步探明相比于其他人群为何结直肠癌在非裔美国人中恶性程度更高。据了解自从1960年以后,白种人男性结直肠癌病人的死亡率下降了30%,而非裔美国籍男性结直肠癌病人的死亡率上升了28%。
另外一位研究人员Dr. Markowitz这样说道:“我们想知道对于非裔美国人和白种人来说结肠癌是否在分子上是同一种疾病。或者结肠癌是否是同一种疾病但在不同种族群体中存在不同。这项研究给了我们答案,对于非裔美国病人来说结肠癌在分子上是一种不同的疾病。”(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷APP.

Adverse Clinical Outcome Associated With Mutations That Typify African American Colorectal Cancers
Zhenghe Wang*, Li Li*, Kishore Guda, Zhengyi Chen, Jill Barnholtz-Sloan, Young Soo Park, Sanford D. Markowitz and Joseph Willis
African Americans have the highest incidence and mortality from colorectal cancer (CRC) of any US racial group. We recently described a panel of 15 genes that are statistically significantly more likely to be mutated in CRCs from African Americans than in Caucasians (AA-CRC genes). The current study investigated the outcomes associated with these mutations in African American CRCs (AA-CRCs). In a cohort of 66 patients with stage I-III CRCs, eight of 27 CRCs with AA-CRC gene mutations (Mut+) developed metastatic disease vs only four of 39 mutation-negative (Mut-) cases (P = .03, Cox regression model with two-sided Wald test). Moreover, among stage III cases (n = 33), Mut+ cancers were nearly three times more likely to relapse as Mut- cases (7 of 15 Mut+ vs 3 of 18 Mut-; P = .03, Cox regression model with two-sided Wald test). AA-CRC mutations may thus define a high-risk subset of CRCs that contributes to the overall disparity in CRC outcomes observed in African Americans.
厦门2017年1月10日电 /美通社/ — 总部位于厦门的肿瘤精准检测领域领先企业艾德生物与全球领先的制药公司勃林格殷格翰今日共同宣布:双方签署了一项合作协议,启动艾德生物-勃林格殷格翰肺癌EGFR突变血液检测项目。该项目将致力于非小细胞肺癌EGFR突变血液检测在中国大陆的推广,实现一管血检测非小细胞肺癌患者EGFR基因突变状态,让更多非小细胞肺癌患者都有机会从EGFR靶向药物治疗中受益。肺癌血液EGFR突变检测项目中将采用艾德生物最新的、专门为血液基因突变检测而开发的高敏感检测技术ADx-Super-ARMS®。
EGFR突变检测可通过组织检测和血液检测两种方式实现。相比于组织检测,血液检测具有无创、取样方便、实现动态检测、克服肿瘤异质性对检测的影响等独特的优点,而且部分晚期患者无法取得可用的组织,因此血液EGFR突变检测的开展与推广将使更多的非小细胞肺癌患者有获得靶向治疗的机会,实现非小细胞肺癌从恶性病治疗向慢性病管理模式的转变。目前,血液EGFR突变检测并未得到广泛开展,各地区间、医院间的检测方法及流程存在较大差异,极大地影响了非小细胞肺癌患者的诊断和个体化治疗方案的选择。通过肺癌EGFR突变血液检测项目,艾德生物携手勃林格殷格翰致力于推动肺癌EGFR突变血液检测在医院内的标准化、流程化,最终实现EGFR突变血液检测普及化的目标。同时双方还将共同对实验室技术人员提供培训和指导,助力院内检测能力的提升,推动中国精准医学的临床普及发展。
该项目中将采用的艾德生物的ADx-Super-ARMS技术使EGFR突变液体活检更加灵敏且更易于实现,能够在120分钟内提供检测结果3,可广泛应用于多种诊断实验室。目前该技术在国内是唯一的,且比国外类似技术的灵敏度更高。
“艾德生物能够为临床提供高度可靠且有效的诊断产品与方法,我们为此感到自豪。这些诊断方法将有助于临床决策的制订,并且对非小细胞肺癌患者的治疗起到了关键性指导作用,”艾德生物首席执行官郑立谋博士表示。“随着对个体化治疗的理解逐步加深,两家企业在中国市场战略合作的展开与深入,共同致力于标准化EGFR突变血液检测在中国市场的推广,实现一管血检测EGFR基因突变状态,旨在让更多非小细胞肺癌患者获得靶向治疗的机会,造福更多的肿瘤患者。”
作为一家以研发为驱动力的制药公司,勃林格殷格翰正积极开发包括生物制药产品和小分子药物在内的靶向治疗药物,涉及肺癌及其它具有未满足的医疗需求的肿瘤治疗领域。目前,勃林格已在全球上市两个治疗非小细胞肺癌的靶向治疗药物,其中阿法替尼是针对EGFR突变的不可逆靶向治疗药物。与第一代、可逆的EGFR靶向治疗药物相比,阿法替尼能够与EGFR不可逆地结合,从而达到关闭细胞信号通路、抑制肿瘤生长的目的。一项大型研究表明,阿法替尼与第一代可逆的EGFR靶向治疗药物吉非替尼相比,能够降低肺癌进展风险和治疗失败风险达26%,治疗两年后接受阿法替尼治疗的患者存活数是接受吉非替尼治疗的两倍4。目前阿法替尼已在全球70多个国家和地区获批上市,在2016年4月获得国家食品药品监督管理总局优先审批资格。
勃林格殷格翰中国专科产品事业部副总裁杜瑞先生说:“勃林格殷格翰致力于研发突破性的、有潜力改变临床实践的肿瘤治疗药物,而肺癌是我们研发的重点领域。目前中国非小细胞肺癌患者EGFR基因突变检测率总体较低,我们希望通过与艾德生物的合作,凭借精准可靠且方便的检测技术,提高EGFR基因突变的检测率,从而使更多的肺癌患者有机会从靶向药物的治疗中受益。”
解放军307医院全军肿瘤中心刘晓晴教授表示:“艾德生物和勃林格殷格翰的此次合作,不仅有利于推动血液检测EGFR突变技术的普及,也能发现更多EGFR突变阳性的非小细胞肺癌患者,并使之接受针对性的分子靶向治疗。第二代不可逆的EGFR-TKI靶向药物阿法替尼,可以在保证生活质量的情况下,进一步提高EGFR突变阳性肺癌患者的治疗疗效,延长生存。”中山大学附属第一医院病理科王连唐教授表示:“艾德生物自主研发的Super-ARMS®技术检测灵敏度媲美数字PCR,同时保留了ARMS简便快速,特异性好,技术普及度高等特点,适合作为血液EGFR检测的临床普及技术在医院中广泛开展。艾德生物与勃林格殷格翰的此次合作,将有力推动血液EGFR检测的标准化进程并加速EGFR突变检测率的提升。”
关于EGFR突变血液检测
EGFR突变是非小细胞肺癌重要的靶向治疗分子标志物,通过对患者血液中游离肿瘤DNA(ctDNA)的分析,能够确定患者肿瘤中的EGFR基因突变状态,从而指导患者的治疗决策。
关于非小细胞肺癌
肺癌是全球最常见的恶性肿瘤,死亡率居恶性肿瘤之首,其中约85%为非小细胞肺癌5。EGFR是中国非小细胞肺癌患者最常见的驱动基因,中国非小细胞肺癌患者中EGFR的突变率约为50%2。EGFR酪氨酸激酶抑制剂(EGFR-TKI)是目前临床广泛应用于治疗EGFR基因突变阳性非小细胞肺癌患者的靶向药物。研究表明,该类药物可以使EGFR突变阳性患者显著获益,例如阿法替尼。
关于阿法替尼
酪氨酸激酶抑制剂(TKI)是一种靶向治疗,能够在癌细胞内部发挥作用,阻断肿瘤生长所需要的信号。阿法替尼是第二代TKI,是首个获批的不可逆ErbB家族阻断剂,是一种口服、每日1次的靶向疗法。
阿法替尼在70多个国家获批作为EGFR突变阳性非小细胞肺癌(NSCLC)患者的一线治疗。阿法替尼还在欧洲、美国和其他市场获批用于治疗在铂类化疗期间或之后发生疾病进展的肺晚期鳞状细胞癌(SqCC)患者。
文献资料
1. Tsao AS et al. J Thorac Oncol. 2016 May;11(5):613-38
2. Zheng D et al. Oncotarget. 2016 Jul 5;7(27):41691-41702
3. 艾德生物内部数据
4. Park K, et al. Afatinib versus ge-tinib as fi-rst-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2b, open label, exploratory, randomised controlled trial. Lancet Oncol 2016
5. 晚期非小细胞肺癌分子靶向治疗专家共识(2013版)
新浪科技讯 北京时间3月1日消息,“人类基因组计划”与“曼哈顿原子弹计划”、“阿波罗登月计划”并称为自然科学史上的“三大计划”。继人类基因组计划之后,生命科学领域又将迎来一件大事——比人类基因组计划更宏大的地球生物基因组计划(Earth BioGenome Project, EBP)即将启动,目标是破译地球上所有生命的基因组。用与两架轰炸机等价的投入,换取全世界所有基因资源,这个项目,你支持吗?





图片来源:medicalxpress.com
2017年3月2日 讯 /生物谷BIOON/ –近日,来自乌普萨拉大学的研究人员通过对数千个相关的酵母细胞进行详细分析发现,当很多基因都能够调节单一特征时,其通常会在一个大型的网络中共同协调发挥作用,理解这些基因的作用模式或许就能够帮助有效预测个体机体的遗传组成如何影响机体的特征表现,相关研究刊登于国际杂志Nature Genetics上。
如今研究人员可以在数天之内对个体机体的完整基因组图谱进行绘制,而且遗传学研究的最大瓶颈也不再是寻找个体间DNA差异的问题了,相反研究者所面临的最大挑战却是鉴别出影响机体单个细胞或整个有机体功能的数百万个差异,以及理解这些功能差异发生的原因。假设不同基因所产生的效应是相互独立的情况下,研究人员通常会每次对一个基因突变进行研究,如果这样的话,研究者希望能够鉴别出单个最重要的基因突变,并且利用相应的结果来有效预测个体患病或者遭受药物副作用的风险。
研究者Simon Forsberg博士表示,如今很多公司都能够提供基于DNA的服务来进行谱系研究寻找“亲戚”,但我们希望未来能够根据基因特性来预测个体机体的特征,比如人们可以进行疗法定制,同时医生也能够给予个体一些关于健康和生活方式的建议。
文章中,研究人员通过对成千上万个遗传特性不同的酵母细胞进行DNA以及特性的详细分析,研究结果表明,对于基因而言在一起协同发挥作用非常正常,一旦我们知道某些基因的作用方式,相关信息或许就能够被用来深入理解这些基因在调节机体特性的重要性,同时还能够通过细胞的遗传组成来帮助预测单一酵母细胞的特性表现。研究者Carlborg说道,毫无疑问,很少有遗传学家会认为,单个基因突变会对所有个体产生相同的效应,但如今我们就有可能通过收集大量足够的实验性数据来调查单个基因所产生的效应的重要性。
研究者发现,很多基因实际上都会在一个大型网络中互相协作,尤其是一些充当“主要调节子开关”的基因,当其功能被关闭后,基因网络中其它的基因突变就不会对机体特性产生任何影响了。一些基因的效应或许会完全依赖于网络中其它基因的功能;本文研究结果显示,在很多情况下,通过阐明单一基因的效应或许很难预测其对机体整体的影响。
最后研究者Carlborg表示,我们希望本文研究能够帮助其它科学家对来自人类、植物以及其它动物的遗传学研究的数据进行分析和解释,如果我们不考虑基因互相协作发挥功能的方式的话,那么理解这些基因所带来的效应或风险就显得尤为重要了,未来,研究人员想通过更为深入的研究,来理解如何利用DNA信息来预测个体患病或遭受药物疗法所带来的副作用的风险。(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转发,转载需授权! 点击 获取授权 。更多资讯请下载生物谷 app.
原始出处:
Simon K G Forsberg,Joshua S Bloom,Meru J Sadhu,et al. Accounting for genetic interactions improves modeling of individual quantitative trait phenotypes in yeast. Nature Genetics, 27 February 2017. doi:10.1038/ng.3800
2016年9月3日/生物谷BIOON/–在一项新的研究中,来自美国辛辛那提儿童医院医学中心的研究人员发现发育中的血细胞在最终决定变成哪种类型细胞之前陷入竞争性的基因调控网络之间的拉锯战之中。相关研究结果于2016年8月31日在线发表在Nature期刊上,论文标题为“Single-cell analysis of mixed-lineage states leading to a binary cell fate choice”。论文通信作者为Nathan Salomonis博士、Harinder Singh博士和H. Leighton Grimes博士。
研究人员报道当发育中的血细胞被众多激活和关闭的基因信号触发时,它们在最终变成特定的细胞类型之前在变动的多种细胞系状态之间来回移动。尽管他们仍然不能精确地理解这些细胞如何选择一种最终的命运,但是他们的研究提示着竞争性的基因网络诱导动态的不稳定性,从而导致混合细胞系(mixed-lineage)状态,而这些混合细胞系状态是为准备决定新形成的细胞所必需的。
Singh说,“它有点处于混乱状态,但是次序就是从这种混乱中产生的。这一发现有助我们解决发育生物学上的一个基本问题—这些中间状态和决定细胞类型选择的基因调节网络的性质是什么。”
根据Grimes的说法,尽管这些发现还需开展进一步的广泛研究来更好地理解这种基因过程的来回移动的性质,但是这项研究可能最终为导致疾病的发育错误提供新的认识。
Grimes问道,“血细胞如何知道变成中性粒细胞或单核细胞?你的骨髓三分之二是由这种活动占据的,而且细胞数量必须保持精致的平衡。这两种细胞中的任何一种太多或太少都能够杀死你。”
在当前的这项研究中,研究人员特别地研究中性粒细胞和单核细胞(巨噬细胞)这两种血细胞—免疫系统中至关重要的细胞组分—的形成。他们利用一种新的飞速发展的被称作单细胞RNA测序的技术研究自然状态下发育的小鼠血细胞,其中单细胞RNA测序可鉴定出单个细胞的基因表达程序和它们的推定的调节物。
大数据生物学
研究人员将实验室生物学技术与辛辛那提儿童医院开发的一种新的生物信息学计算机程序(即ICGS)结合在一起。ICGS(Iterative Clustering and Guide-Gene Selection, 迭代聚类与引导基因选择)让人们对单细胞RNA测序产生的巨大数量的数据获得综合的认识。
ICGS
ICGS给研究人员提供一种直观的平台,该平台能够分析所有的测序数据和生物学数据来鉴定细胞—在这项研究中,指的是发育中的血细胞—的多种转移或变化的基因组和细胞状态。
动态不稳定性
人们之前已提出中性粒细胞和巨噬细胞这两种血细胞是由于一种双稳态基因调节网络(能够显示两种稳定状态中的一种)产生的。但是不同的细胞转换状态和发育背后的分子动力学特征仍然是未知的。
通过在不同的实验室生物学之间进行重复性地反复研究和计算分析,研究人员说他们对发育中的血细胞的分析捕获到一种普遍的混合细胞系中间状态。这些中间状态表达一种基因组合,包括能够产生所有血细胞类型的干细胞典型的那些基因,以及红细胞、血小板、巨噬细胞和中性粒细胞特异性的一些基因。这似乎反映了竞争性的基因程序。
研究人员也发现这些发育中的血细胞经历一种罕见的状态,在这种状态下,它们遭遇到被称作“动态不稳定性”的混乱。这似乎是由两种对抗性的髓系细胞基因调节网络所导致的。这两种对抗性基因网络中的两种关键组分是Irf8和Gfi1,即两种参与血细胞形成的基因。这两种基因编码转录因子,这意味着它们编码的蛋白产物控制着哪种基因信息用于细胞形成中。当Irf8和Gfi1被剔除时,研究人员发现这些罕见的细胞能够停留在一种中间状态。
当继续开展研究时,研究人员想要更加清晰地理解是什么最终导致发育中的血细胞处于动态不稳定性的中间状态并从中选择特定的命运。他们提出两种同时存在的抵抗性基因网络的影响产生内部波动,而这些波动最终能够被未知的机制稳定化从而选择两种不同的细胞命运中的一种。(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷app。
Single-cell analysis of mixed-lineage states leading to a binary cell fate choice
Andre Olsson, Meenakshi Venkatasubramanian, Viren K. Chaudhri, Bruce J. Aronow, Nathan Salomonis, Harinder Singh & H. Leighton Grimes
doi:10.1038/nature19348
PMC:
PMID:
Delineating hierarchical cellular states, including rare intermediates and the networks of regulatory genes that orchestrate cell-type specification, are continuing challenges for developmental biology. Single-cell RNA sequencing is greatly accelerating such research, given its power to provide comprehensive descriptions of genomic states and their presumptive regulators1, 2, 3, 4, 5. Haematopoietic multipotential progenitor cells, as well as bipotential intermediates, manifest mixed-lineage patterns of gene expression at a single-cell level6, 7. Such mixed-lineage states may reflect the molecular priming of different developmental potentials by co-expressed alternative-lineage determinants, namely transcription factors. Although a bistable gene regulatory network has been proposed to regulate the specification of either neutrophils or macrophages7, 8, the nature of the transition states manifested in vivo, and the underlying dynamics of the cell-fate determinants, have remained elusive. Here we use single-cell RNA sequencing coupled with a new analytic tool, iterative clustering and guide-gene selection, and clonogenic assays to delineate hierarchical genomic and regulatory states that culminate in neutrophil or macrophage specification in mice. We show that this analysis captured prevalent mixed-lineage intermediates that manifested concurrent expression of haematopoietic stem cell/progenitor and myeloid progenitor cell genes. It also revealed rare metastable intermediates that had collapsed the haematopoietic stem cell/progenitor gene expression programme, instead expressing low levels of the myeloid determinants, Irf8 and Gfi1 (refs 9, 10, 11, 12, 13). Genetic perturbations and chromatin immunoprecipitation followed by sequencing revealed Irf8 and Gfi1 as key components of counteracting myeloid-gene-regulatory networks. Combined loss of these two determinants ‘tr apped’ the metastable intermediate. We propose that mixed-lineage states are obligatory during cell-fate specification, manifest differing frequencies because of their dynamic instability and are dictated by counteracting gene-regulatory networks.
你可能会与跟自己有共同特征的人结婚,彼此有相似的智力、身高、体重。近日,一项针对数万对新婚夫妇的研究显示,这并非偶然。而且,这些选择参数是由基因决定的。

为了完成该调查,澳大利亚昆士兰大学遗传学家Peter Visscher 实验室的博士后Matthew Robinson及同事,分析了包含人类身体和基因信息的大型数据库。他们提炼了一个人的身高和身体质量指数(BMI)等性状基因标记,以预测其伴侣的身高和BMI。
研究人员计算了2.4万多对夫妻的欧洲祖先数据后,发现人们的身高基因标记和伴侣的实际身高之间存在较大的统计相关性。他们还发现,BMI方面也存在这种相关性:人们通常会选择与自己有类似基因的伴侣。相关研究报告刊登于《自然—人类行为学》期刊。
这是人类存在选型交配的证据。这种性别选择模式是指个体更倾向于选择具有相似特质的伴侣。这种伴侣选择模式在自然界中也有迹可循,例如“鸟以群分”。
此外,研究人员还检验了在其他特质上的选型交配,例如教育。他们研究了一个包含7780对夫妇的英国数据库,寻找这些夫妻在与受教育年限有关的基因标记上的一致性。当然,这并不意味着人们依据受教育实际年数选择配偶,而是他们倾向于选择具有与受教育程度有关的相似兴趣的另一半。
Robinson表示,这些发现表明,伴侣选择也能“影响与人类特征有关的基因组结构”。选型交配有助于将身高等特征传递给后代。这也提示了能预测一个家族成员遗传特征的基因模型,例如,推断该家族是否有精神分裂症等疾病的遗传风险。
下一步,研究人员希望验证夫妻间更多的相似特征。对于自己的另一半,Robinson提到,“我们都有博士学位,而且都是高个子,正好满足这一理论”。(生物谷Bioon.com)