

相关会议推荐

2016癌症、炎症与免疫–微环境下的对话
会议时间:2016.09.02-2016.09.03 会议地点:上海


2017年2月27日讯 /生物谷BIOON/ –威尔康奈尔医学院和纽约基因组中心的一项最新研究在癌细胞内发现了一种新的基因突变类型,或为了解癌症起源提供线索,同时也为开发新的治疗方法提供靶点。
借助下一代基因测序技术,科学家们已经知道癌症的根源在于破坏蛋白质序列的突变。突变会导致细胞合成异常活跃或发生功能紊乱的蛋白,也会导致细胞无法合成一些蛋白,最终导致癌症的发生。在最近发表在Cell上的这项研究中,研究人员介绍了一种可能导致癌症发生的新型突变:在基因组的非编码区域发生微小DNA序列(1到50个碱基)的插入或缺失,也叫做“indels”。
“这些非编码区域也有重要作用,因为它们包含了一些能够影响基因调控的序列。我们已经知道这些区域有非常重要的生物学意义,问题在于这些区域如何影响癌症发育。”文章作者Dr. Marcin Imielinski教授这样说道。
在这项研究中,研究人员对几个公共数据库中肿瘤样本的基因序列信息进行了分析,着重研究基因组中占98%的非蛋白编码区域。他们从肺腺癌这种最常见的肺癌开始,发现这些样本的基因组中最常见的indel突变区域位于编码表面活性蛋白的基因中。
之前没有研究将这些对健康肺功能非常重要的基因与肺癌联系在一起。但是它们在发展为肺腺癌的细胞类型中存在高水平特异性的表达。
研究人员还对12种其他类型癌症的基因组进行分析,发现在肝脏、胃和甲状腺肿瘤中存在类似的模式。
“在每一种癌症中,非编码的indel突变都会聚集在对器官功能非常重要的基因上,但是这些基因之前都未与癌症联系在一起。”Imielinski教授表示。这些非编码的indel突变非常常见,20%~50%的相关癌症中都存在这种突变。
“这种突变发生的频率与最著名的致癌突变一样高,任何基因或序列以这种频率发生突变都可能导致癌症发生。如果我们可以证明这一点,那将会是令人感到非常兴奋的结果。”
“这些突变可以用作生物标志物帮助我们进行癌症的早期诊断,或者当存在转移灶无法定位原发灶的时候可以用于指示原发灶。这项研究的发现可以有许多可能的临床应用。”(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷APP.
原始出处:
Marcin Imielinski et al. Insertions and Deletions Target Lineage-Defining Genes in Human Cancers, Cell (2017).

图片来源:medicalxpress.com
2017年1月10日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Nature Genetics上的研究报告中,来自阿伯丁大学的研究人员通过研究鉴别出了一种关键基因,该基因在确定人类机体肌肉质量上扮演着重要作用,机体的肌肉质量和一系列健康因子直接相关,其中就包括人类的寿命。
此前研究中,研究人员通过对老年人进行研究发现了机体肌肉量和预期寿命之间的关联。肌肉是机体中一种必不可少的关键组织,其能够发挥多种机体功能,比如让我们机体移动或者让我们自由呼吸。然而机体中骨骼肌肌肉量的水平却因人而异,存在着明显差异。
如果个体进行力量锻炼的话,其机体中骨骼肌量(skeletal muscle mass)的水平就会增加,但遗传因素在确定机体肌肉量的水平上同样扮演着相同重要的角色;如今研究人员通过研究鉴别出了影响小鼠机体肌肉量的关键基因,此外研究者此前通过研究还发现该基因和癌症的扩散存在直接关联,这对于后期科学家们开发新型疗法来靶向作用该基因就提供了新的思路和希望。
研究人员希望未来能够开发出新型药物来帮助他们理解该基因对肌肉组织的影响,如果有多重药物能够靶向作用相同的基因,那么研究者或许就能够找到对人类肌肉副作用娇小的药物。最后研究者表示,本文研究中所发现的新型基因在调节机体肌肉量上扮演着关键角色,同时未来他们有望开发出靶向作用该基因的新型药物来为治疗人类一系列疾病提供思路和希望。(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转发,转载需授权!点 击 获取授权 。更多资讯请下载生物谷 APP.
Genome-wide association of multiple complex traits in outbred mice by ultra-low-coverage sequencing
Jérôme Nicod, Robert W Davies, Na Cai, Carl Hassett, Leo Goodstadt, Cormac Cosgrove, Benjamin K Yee, Vikte Lionikaite, Rebecca E McIntyre, Carol Ann Remme, Elisabeth M Lodder, Jennifer S Gregory, Tertius Hough, Russell Joynson, Hayley Phelps, Barbara Nell, Clare Rowe, Joe Wood, Alison Walling, Nasrin Bopp, Amarjit Bhomra, Polinka Hernandez-Pliego, Jacques Callebert, Richard M Aspden, Nick P Talbot et al.

2017年2月27日讯 /生物谷BIOON/ –Wistar研究所的科学家们发现一种抗糖尿病药物可以通过激活一个抗衰老基因进而抑制一个参与转移进展和抵抗靶向治疗的蛋白来抑制老年黑色素瘤病人体内黑色素瘤的生长。相关研究结果在线发表在国际学术期刊Clinical Cancer Research上。
黑色素瘤是一种与衰老相关的疾病,老年人患这种疾病的风险更高预后情况也更差。相比于化疗来说,靶向治疗方法能够帮助提高整体生存率,但是癌细胞对药物的抵抗限制了这类治疗方法的应用。
Wistar的科学家们曾经发现肿瘤微环境存在一些衰老相关的变化,这些改变会驱动黑色素瘤进展和治疗抵抗。他们还发现Wnt5A这种蛋白能够促进肿瘤细胞的转移以及对治疗药物的抵抗和不良预后,Klotho是可以调节Wnt5A的一种抗衰老蛋白。
在这项新研究中研究人员用一种促进Klotho表达降低Wnt5A水平的药物处理小鼠,发现这种药物可以抑制老年小鼠体内已经产生治疗抵抗的黑色素瘤的生长,但是在年轻小鼠身上并没有这种效果。
该研究团队使用了一种人造皮肤模型来重新建立黑色素瘤细胞与年轻或衰老的肿瘤微环境之间的联系。他们观察到Klotho,Wnt5A,黑色素瘤细胞以及肿瘤微环境之间存在错综复杂的相互调控关系。他们还发现利用抗糖尿病药物罗格列酮可以改变Klotho表达进而降低Wnt5A的表达水平。重要的是,罗格列酮联合靶向治疗药物可以共同抑制年轻和老年小鼠体内的肿瘤生长,单独使用罗格列酮反而会促进年轻小鼠体内的肿瘤生长而抑制老年小鼠体内肿瘤的生长。
“我们认为Klotho的表达水平存在一个阈值效应,根据病人的年龄确定是否可以从这种治疗方法中获益,”文章第一作者Reeti Behera博士这样表示。“之前已经有研究检测过罗格列酮在癌症治疗方面的作用,但是结果并不理想。我认为他们可能错过了一些重要信息,没有考虑到衰老和肿瘤微环境。”
该研究为开发治疗老年黑色素瘤病人的方法奠定了基础。未来还需要更多研究在人类病人中进行进一步证实。Klotho是一种分泌蛋白可以在病人血清中得到检测,这也可以帮助确定哪些病人适合接受罗格列酮疗法的治疗,但也有待得到进一步验证。(基因宝jiyinbao.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷APP.
原始出处:
Reeti Behera,et al. Inhibition of age-related therapy resistance in melanoma by rosiglitazone-mediated induction of Klotho. Clinical Cancer Research, February 2017.
2016年10月20日,美国《细胞》(Cell)杂志刊登一篇有趣的故事,美国劳伦斯伯克利国家实验室的科学家在研究蛇的进化过程中,突发奇想地用蛇的一段DNA将小鼠的同源DNA进行替换,结果小鼠的四肢明显变短,似乎像蛇一样不长腿了。原来,蛇的祖先是有四肢的,在进化过程中由于这段DNA功能发生变化,导致四肢慢慢消失了。
“画蛇添足”并非多余
全球现存蛇的种类多达3000多种,虽然与蜥蜴等同属爬行动物,但是却看不到四肢,主要靠腹部的鳞片“滑行”。大多数人都把蛇看成是无腿的爬行动物,以至于中国历史名着《战国策》中那位“画蛇添足”的仁兄,因为给蛇画上了腿,既没有喝到酒,更被后人耻笑了两千年。不过最新考古发现,蛇也曾长过腿,而且还长了四条腿。
2015年7月24日的美国《科学》(Science)杂志公布了一项惊人的考古新发现,英国朴茨茅斯大学的戴夫·马蒂尔(Dave Martill)博士在一家德国索伦霍芬博物馆里参观时,意外地发现一块在巴西出土、距今已有1.1亿年的白垩纪化石上,竟然有一条长有四条腿的蛇。通过仔细分析和比对,马蒂尔博士等人认为这块化石的确是蛇类化石,而非蜥蜴的,因为这个化石上的动物身体修长,有类似蛇的牙齿和一排用于爬行的腹鳞。
这条已沉睡上亿年的古蛇标本被从巴西挖掘后,辗转来到德国索伦霍芬博物馆,只是作为白垩纪大型化石展的一个普通化石进行展览,很长时间并没有引起人们的注意,直到马蒂尔博士发现了它。或许是因为它太小了,这条古蛇的体长仅为20厘米,研究人员推测它应该是条幼蛇,它的前腿只有约1厘米长,而后腿则稍微大一些,而且四肢均有明显的五指,可能便于抓捕猎物或者辅助交配。
蛇起源于一种已灭绝蜥蜴的假说,之前已被多个只有两只后腿的蛇化石标本所证实,不过一直缺少四脚蛇化石的直接证据,因此马蒂尔博士等人的发现正好填补了这一空缺。在这些只有后腿的蛇化石考古发现中,大多数研究都将蛇的祖先指向海洋蜥蜴——沧龙,一种与恐龙同时代、并同恐龙一起灭绝的海洋大型生物。不过,根据这条四脚蛇的头盖骨和身体的比例,以及缺乏像大多数海洋动物一样扁平的尾巴等特征,马蒂尔博士等人推测这种蛇是由陆地上的掘穴蜥蜴而非海洋蜥蜴进化。

一小段DNA在作怪
考古学家们为大家描绘出一幅较为完整的蛇类进化图:大约1.1亿年前,掘穴蜥蜴进化成拥有四只脚的蛇,大约9500万年前,由于腿脚在蛇的爬行运动中失去用处,而且变得碍事,蛇的前腿逐渐退化,不久蛇的后腿也随之退化了,现存的某些大蟒蛇还保留有后腿的痕迹。
但是,蛇的腿为什么会退化呢?最近,一些分子生物学家找到了另外的答案。为了弄明白蛇的四肢退化原因,美国劳伦斯伯克利国家实验室阿卡索·维瑟尔(Axel Visel)教授领导的研究小组将目光聚焦在一个叫音猬基因(Sonic hedgehog gene)的远距离增强子ZRS上。
音猬基因是胚胎发育一种非常重要的基因,对胚胎体节发育和肢芽形成起着重要作用。音猬基因首先在果蝇身上被发现,因该基因突变的果蝇胚胎呈多毛团状,酷似受惊刺猬而得名,几乎存在于所有动物和人。而ZRS增强子位于音猬基因的上游约100万个碱基对的位置,对脊椎动物四肢发育至关重要。一旦这个增强子序列发生突变,可能导致动物的四肢发育异常,其中一些突变导致了人的多指症。
研究人员分析了6种蛇类的ZRS增强子序列,包括缅甸蟒蛇、红尾蚺、扁颈眼镜蛇、斑点响尾蛇、极北蝰和玉米蛇,分别代表蛇类进化过程中的不同形态阶段,其中前两种蛇还保留有后肢残迹,后四种蛇的四肢则完全退化。在将这些序列与人、小鼠、牛、海豚、象鼻鲨、鸡、蝙蝠、蜥蜴和腔棘鱼等其它16个物种的同源序列进行比对后,研究人员惊奇地发现这6种代表性蛇类的ZRS增强子均缺失了一段17个碱基对序列,其中玉米蛇的ZRS增强子序列则全部缺失,这也是ZRS增强子区域内唯一的一段在所有蛇类全部缺失,而在蜥蜴和鱼类等其它物种中都高度保守的序列,因此推测其与蛇的四肢退化有关。
小鼠像蛇一样不“长腿”
为了进一步研究这些增强子ZRS缺失序列的功能,维瑟尔教授研究小组利用CRISPR/Cas9这一最新的基因组编辑技术,将小鼠增强子ZRS序列替换成其它物种的同源序列,包括人和腔棘鱼的序列。在这些基因序列被替换的小鼠胚胎中,研究人员观察到,替换成眼镜蛇ZRS序列的小鼠完全检测不到音猬基因的表达,蟒蛇ZRS序列替换小鼠则只有极其微弱的表达,但是这些小鼠的四肢均显着缩短,而且成年后四肢也没有能长出,而其它物种的ZRS序列均没有影响小鼠的四肢发育,就连本身不长腿的海豚、鲨鱼和腔棘鱼等鱼类ZRS序列也没有蛇类ZRS序列的威力,序列替换后小鼠的四肢也发育正常。
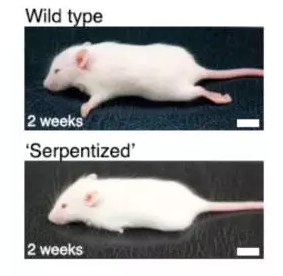
显然,缺失17个碱基对序列的音猬基因增强子ZRS越来越像是蛇类四肢退化的“罪魁祸首”了,这一进化史上的悬案似乎结案了,但是维瑟尔教授研究小组研究得正起劲,完全没有停下来的意思,很快,他们又将这一段缺失序列补回到蟒蛇的增强子ZRS上,同样采用CRISPR/Cas9技术,将该重构的蟒蛇ZRS序列替换掉小鼠的同源序列,结果小鼠的四肢发育完全正常,进一步证实了蛇类音猬基因增强子ZRS的17个碱基对序列缺失是蛇类四肢退化的主要原因。
不过维瑟尔教授研究小组让小鼠来验证增强子ZRS的功能并非首创,应该是受日本科学家的启发。早在2005年,日本国家遗传学研究所Tomoko Sagai等人将小鼠的音猬基因增强子ZRS全部删除,得到的小鼠四肢也大大缩短,第一次利用基因工程小鼠模型证明了增强子ZRS对动物四肢发育至关重要的作用。维瑟尔教授研究小组发现完全缺失增强子ZRS序列的玉米蛇也正与这一研究结果相吻合。

蛇的四肢能回来吗?
也可能有人会脑洞大开,如果用蜥蜴的ZRS序列将蛇的同源序列替换掉,会不会培育出拥有四只脚的蛇呢?正如维瑟尔教授研究小组2016年10月20日在美国《细胞》杂志上论文所声称的那样,他们并不希望制造出这种四脚蛇,而且可能还存在其它的基因或调控序列对动物四肢的发育起到一些重要作用。
几乎就在维瑟尔教授研究小组发表论文的同时,美国霍华德·休斯医学研究所的弗朗西丝卡·利尔(Francisca Leal)和马丁·科恩(Martin Cohn)也在《当代生物学》(Current Biology)发表论文,公布了他们所发现的蟒蛇后肢并没有完全退化的秘密,同样也涉及音猬基因调控四肢发育的特异增强子ZRS突变,除了维瑟尔教授研究小组发现的那个缺失片段,他们还发现了该增强子的另外两段缺失序列都可能也与蟒蛇后肢并没有完全退化有关,而这三段缺失的序列共同作用,使得蟒蛇的ZRS增强效应减弱了近90%。他们进一步的研究认为,这三段缺失的序列原本正好是音猬基因一些转录因子的结合位点,蟒蛇的序列缺失让这些转录因子无法正常工作,使得音猬基因表达水平大幅减弱,最终导致蟒蛇前肢完全退化,后肢部分退化。
弗朗西丝卡·利尔和马丁·科恩在验证其突变序列的功能时,同样借助于基因工程小鼠。他们将蟒蛇和蜥蜴的增强子ZRS序列分别与一种报告基因——LacZ基因构建成一个新基因,分别显微注射到小鼠受精卵,培育出11.5天的转基因小鼠胚胎。通过染色,LacZ基因产物会呈蓝色,可以通过蓝色深浅直观地判断LacZ基因表达水平的高低,结果含蜥蜴增强子序列的小鼠胚胎前后肢报告基因均有较强的表达,而含蟒蛇增强子序列的小鼠胚胎前后肢报告基因则只有很微弱的表达,表明缺失了三段序列的蟒蛇ZRS增强子的确与其四肢退化有关。不过该研究并没有对小鼠四肢发育进行后续研究,也没有培育出维瑟尔教授研究小组那样活的转基因小鼠,无法从转基因小鼠四肢骨骼发育形态进一步确证这些突变序列的功能。(生物谷 Bioon.com)