图片来源:btownerrant.com
编者按: 1946年10月14日,克雷格·文特尔(Craig Venter)出生于美国犹他州盐湖城的一个平民家庭。自由的生活造就了他保持终身的好奇心、竞争热情、冒险精神和创造力。他对学校的正规教育没什么好感,不断做出叛逆行为,痛恨死记硬背和考试,成绩糟糕。不过,文特尔认为正规教育毁灭了那些规规矩矩读书的孩子的创造力。
多年后,文特尔对自己的基因分析结果表明,他携带有大量的、可能导致注意缺陷以及多动障碍的基因片段。
高中毕业后,文特尔应征入伍,智商测试值达142,是同批数千新兵中最高的。他以医疗兵身份受训并前往越南,其间私拆档案拿走了因自己顶撞上级获得的处分文件,但他也曾在训练中因无私帮助受到不公正体罚的黑人同袍而被禁闭。
在越南他竟试图跳海游回美国,幸而游到半道醒悟而返。基因分析显示,文特尔的某个产生肌肉运动控制酶的基因正常,这使得他的肌肉耐力远高于常人,否则他很可能回不来。他在越南每天面对的生和死引导他走上了研究生命奥秘的人生道路。
1969年退役后,文特尔进入大学,在著名生物化学家内森·卡普兰的引导下走上生物科研之路。他的优秀毋庸置疑——1975年博士毕业时收到3份offer,而他的同门连获得一次面试都困难。
他进入纽约大学医学院,然而口无遮拦地抨击老教授博士生的灌水毕业论文使他得罪了人,最终老教授负责的委员会拒绝给他终身教职,但他仍从其他系获得了教授职位,后带着自己的团队转入美国国家卫生研究院工作。
当时,已有人提出对人类的全基因组进行测序,但效率低下的测序技术使得许多专家认为这是“天方夜谭”。文特尔大胆跳进了这一风口,将自己的研究方向转为兴起不久的基因组学,取得了诸多成果,然而这背后是艰辛的学术资源之争。
为了获取更多资源以推进研究,文特尔投身商业界创办了塞雷拉基因组公司(Celera Genomics),并进行与人类基因组计划互相竞争的研究计划,取得了举世瞩目的成就。
但当他摆脱了学术界的山头之争和政府部门的繁文缛节的时候,他也不得不应付投资人追求短期商业利益的压力。2002年,塞雷拉公司董事会将凡特解雇。他重回学术圈。
2010年5月,克雷格·文特尔研究院宣布世界首例人造生命——DNA完全人造的单细胞细菌,文特尔将“人造生命”命名为“Synthia”(意为“人造儿”)。
近日,DT君有幸对克雷格·文特尔进行了独家专访。
如今,在美国加州拉霍亚市的人类长寿公司(Human Longevity Inc.)中,分布在3个房间中的20多台自动化基因测序仪器24小时工作,每15分钟完成一份人类DNA样本的测序工作,成本不超过2000美元。克雷格·文特尔是人类长寿公司的共同创始人,这家公司是在2013年创办的。
在访问中,文特尔在电脑上向我们展示了最近的科研成果——对1000人进行了DNA测序,然后只靠DNA数据重建他们的面容。
文特尔称,可以根据DNA预测人的面貌、身高、身体质量指数、虹膜颜色、头发颜色和发质。他希望,不久之后凭DNA预测的相貌可以跟照片媲美。
不过,他也表示,凭DNA猜相貌只不过是小儿科,而终极目的是靠DNA发现主动脉和脊髓的潜在疾病。
截至今日,不得不承认,人类对基因和疾病关系的认识依旧十分肤浅,即使对那些已经研究比较透彻的基因序列,用来指导药物研发也不断碰壁。
例如,文特尔通过对自己的测序发现,自己携带胆固醇酯转移蛋白(cholesteryl ester transfer protein ,CETP)基因的有利变种,因此自己的心脏病和中风的概率低于常人。
随着研究的深入,科学家发现基因和疾病的关系越来越复杂。文特尔毫不畏惧这种复杂性。他认为,对基因大数据和其他医疗数据进行综合分析可以破解这种复杂性。
AstraZeneca公司的一位负责人Ruth March表示,人类长寿公司的技术已经可以比较成千上万人的基因序列,并从中发现细微的差异,这将对疾病机理和药物研发产生重大推动。
但除了比较基因序列,为了彻底揭开人类2万个基因中蕴含的生命之谜,科学家们还需要将一个人的基因与他的其他信息进行比对。数据已经显示,基因的表达效果与环境因素以及后天行为都存在关联,而人体的药物反应记录、核磁共振片子和其他医疗记录都是宝贵的资料。
文特尔相信,只要综合分析这些资料,人类长寿公司就有望实现精准医疗,针对患者量身定做最佳医疗方案。
然而,分析100万份基因产生的PB级别的基因数据,并寻找基因和疾病的相关性,需要惊人的计算量。因此,文特尔招募了弗兰茨·奥克(Franz Och)。奥克之前是谷歌翻译项目的首席专家,在编写语言翻译系统方面具有顶级水平。奥克称,实质上,基因分析就是将基因“语言”中代表疾病的各种词语,翻译成人类语言中代表对应疾病的词语,因此,也可以看做一个语言翻译问题。
然而,一个人的基因数据包含64亿个字母,因此难度很大。比如,一个阿尔茨海默症患者的大脑海马部分退化早在表现出症状的多年前就开始了。而利用机器学习对比患者的基因和大脑核磁共振图像,可以发现预示着阿尔茨海默症风险的基因序列。基于这样的方式就可以对疾病进行早期诊断和预防。

人类长寿公司首席执行官和肿瘤治疗项目负责人肯·布鲁姆(Ken Bloom)称,公司将根据患者的基因来设计针对性的癌症疫苗。该疗法首先扫描患者正常细胞的基因和肿瘤细胞的基因,并据此设计针对性疫苗,而疫苗将使得人体免疫系统可以识别并攻击这种癌细胞,从而彻底防止癌细胞卷土重来。
文特尔对DT君表示,他的目标是在10年之内对至少1百万人进行DNA测序,并利用基因数据、DNA捐赠者的医疗记录和其他医疗数据,来识别对应于DNA特定序列和疾病的一一对应关系。这样,可以通过基因测序及早发现癌症和心脏病等疾病的风险,及早预防或进行有针对性的治疗。
现年69岁的文特尔已经从包括通用动力投资基金、生物技术公司Celgene和Illumina在内的投资人那里募集了3亿美元来支持测序设备的运转。此外,人类长寿公司已经和英国医药巨头-AstraZeneca公司,以及罗氏制药公司控股的南三藩市制药企业Genentech签订合作协议,从这两家企业获得基因样本。

与此同时,他在2015年发起了一个十分胆大、称为健康核心(Health Nucleus)的项目。健康核心项目顾客需支付2.5万美元,到达公司总部后,在私密诊室中花90分钟由主治医生记录其家族病史并采集血液样本。接着,患者将接受包括全身核磁共振扫描、4D超声心脏扫描(可以实时观察心内血液的三维流动情况)等项目在内的各项医学检测。
随后,患者可以回家,但是在接下来的2周,胸口要贴一个创可贴大小的传感器来记录心电数据。通过一个手机app,患者可以点击手机屏幕上的一个3D人体的各个部位,比如心脏和大脑。系统会提示患者对应于该部位的基因信息和该部位是否有疾病风险的信息。
目前,220位患者已经付款参与该项目。
大众一时间不太适应这么激进的服务。纽约大学蓝港医学中心(Langone Medical Center)生物伦理学教授阿瑟·卡普兰(Arthur Caplan)是文特尔的多年故交,也曾担任过文特尔之前所创立公司的顾问。
他表示,健康核心项目引起了伦理和社会层面的不少疑问,比如,谁会为这种基因测序和个人化医疗付钱?这些基因医学服务值这么多钱吗?卡普兰表示,至少目前,保险公司的医疗保险不覆盖基因测序,因此购买这种服务必须自掏腰包。因此,不太可能人人都享受得起基因医疗服务,这种服务的购买者只能是富裕阶层。
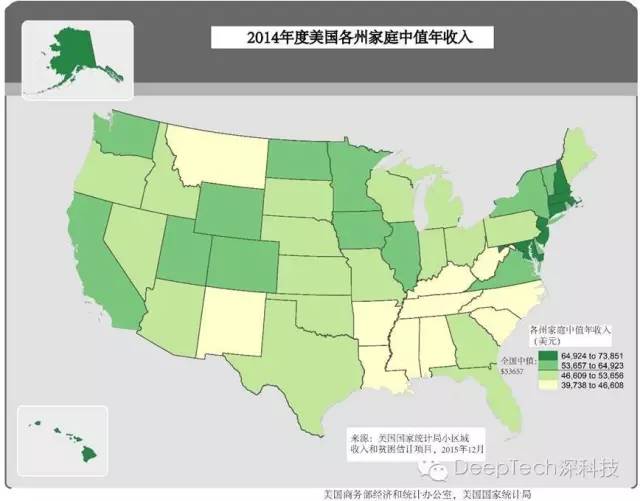
2014年度美国各州家庭年收入中值。来源:美国国家统计局
上图是美国2014年各州家庭年收入的中值示意图。“中值”即该州一半人口的家庭年收入在此数以下。从图中可见,即使是家庭收入普遍较高的州,2万5千美元也超过了家庭年收入中值的三分之一。因此,若无医保支持,普通美国人享受基因测序服务确实很困难。需要注意的是,如果仅仅做人体全基因测序,那么花不了这么多钱。
2014年《麻省理工科技评论》评选的年度全球50家最佳创新企业中就有Illumnia,它在2014年1月宣布,其研发的基因检测芯片已经将对一个人进行全基因测序的成本降低到1000美元。
但是,作为一种新产品,文特尔的服务不仅是基因测序,还要使用最先进的医疗仪器进行全面体检,同时还要把个人的基因数据、体检结果和家族病史综合分析获得结果,因此价格必然高于单纯的基因测序。
对于价格高昂的质疑,文特尔表示,癌症晚期的化疗以及其他治疗,通常要花费比基因测序的2.5万美元多得多的钱,并且最终很可能还是救不了患者的命,难道还需要更多理由来证明,旨在针对性预防疾病的基因测序的钱比治疗晚期癌症的钱花的值吗?
不过,文特尔已经在应对这个问题。他已经雇佣保险精算师来证明人类长寿公司的测序服务是物有所值的,希望借此来敦促保险公司将基因测序服务纳入医保范围。(生物谷Bioon.com)

 基因君官网
基因君官网