
资讯出处:Inherited gene that leads to Huntington’s causes changes in brain development from a young age

资讯出处:Inherited gene that leads to Huntington’s causes changes in brain development from a young age
2018年5月9日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Nature Genetics上的研究报告中,来自剑桥大学等机构的研究人员通过研究在男性Y染色体上发现了特殊的白血病保护性基因,这种Y染色体基因或能保护个体有效抵御急性髓性白血病(AML)和其它类型的癌症。
图片来源:medicalxpress.com
文章中研究人员调查了这种名为UTX的X染色体基因如何促进个体患急性髓性白血病,该基因在很多肿瘤中都处于突变的状态,然而研究人员在Y染色体上发现了另一种名为UTY的相关基因,该基因能够保护缺失UTX基因的雄性小鼠免于急性髓性白血病的发生,随后研究人员对急性髓性白血病和其它癌症类型进行研究后发现,UTX的缺失会伴随UTY的缺失,从而就证实了UTY的抗癌角色或许能够延伸到急性髓性白血病中。
急性髓性白血病是一种恶性的血液癌症,其影响着各年龄段的人群健康,该病通常发生于骨髓细胞中,而且会诱发患者出现危及生命的改变和出血,几十年来主流的急性髓性白血病疗法一直并未改变过。女性拥有一对X染色体,而男性则拥有一个X染色体和一个Y染色体,X和Y染色体能够共享许多基因,但仅有一部分基因(包括UTY)仅会在Y染色体上出现,这些Y染色体特异性基因被认为含有一些雄性性征所需要的遗传性信息,而研究人员并不清楚其还有什么样的作用,本文研究或能改变研究人员分析Y染色体的方式,并且改善研究人员理解急性髓性白血病和其它癌症的发病机制。
研究者Malgorzata Gozdecka博士说道,这是我们发现的首个能保护机体抵御急性髓性白血病的Y染色体上的特殊基因,此前研究人员发现,Y染色体的唯一功能就是产生雄性特征,但我们的研究结果则发现,Y染色体或许还能保护机体抵御急性髓性白血病等多种癌症。Brian Huntly教授表示,通常人们认为,随着年龄增长男性的细胞中会缺失Y染色体,本文中研究者发现,Y染色体的缺失会增加人们患癌症的风险,同时研究人员还在文章中描述了这一过程发生的分子机制。
在这项研究中,研究人员对人类细胞和小鼠细胞中的UTX基因研究来阐明其在急性髓性白血病发生过程中扮演的关键角色,由于UTY基因能够扮演一种关键的肿瘤抑制基因,而且研究人员还阐明了UTX的缺失诱发急性髓性白血病发生的机制,UTX似乎能够扮演一种常见的支架,其能将大量的调控蛋白结合在一起,来控制基因的表达,而这种功能能被UTY来完成,当UTX/UTY缺失时,这些蛋白就无法正确调节基因的表达,从而就可能促进癌症发展。
研究者表示,十几年来治疗急性髓性白血病的疗法并未改变过,目前研究人员继续开发出治疗这种白血病的新型疗法,本文研究或能帮助研究人员深入理解该病的发生机制,同时也能为研究人员提供新型药物靶点来开发新型药物干扰诱发白血病的过程。研究人员希望本文研究或能帮助研究人员开发改善白血病患者预后的新型干预措施。
最后Alasdair Rankin博士说道,如今急性髓性白血病患者的生存率依然很低,而当前的疗法主要包括强化性的化疗,其通常与干细胞移植结合在一起,仅能治疗一部分患者;本文研究或能帮助研究人员发现恶性白血病的发病机制,理解该过程对于开发治疗急性髓性白血病的新型靶向药物至关重要,也能帮助患者尽快远离一些无效的化学疗法。(生物谷Bioon.com)
原始出处:
Malgorzata Gozdecka, Eshwar Meduri, Milena Mazan, et al. UTX-mediated enhancer and chromatin remodeling suppresses myeloid leukemogenesis through noncatalytic inverse regulation of ETS and GATA programs. Nature Genetics (2018) doi:10.1038/s41588-018-0114-z

2017年11月19日/生物谷BIOON/—根据在2017年10月26日~30日举办的美国癌症研究协会(AACR)-美国国家癌症研究所(NCI)-欧洲癌症治疗研究组织(EORTC)国际分子靶标与癌症治疗会议(International Conference on Molecular Targets and Cancer Therapeutics)上提供的数据,在分析的40%的非小细胞肺癌(NSCLC)病例中检测到一种特定的基因变化允许癌细胞逃避免疫系统检测。这些数据提示着这种基因变化是在肿瘤进化的晚期发生的。相关研究结果于2017年10月26日在线发表在Cell期刊上[1],论文标题为“Allele-Specific HLA Loss and Immune Escape in Lung Cancer Evolution”。论文通信作者为英国伦敦大学学院癌症研究所的Charles Swanton博士和Nicholas McGranahan博士。
This study is being simultaneously published in Cell.
Swanton实验室研究生Rachel Rosenthal说,“癌症的一种特征是癌细胞能够逃避免疫系统破坏。通过与McGranahan博士一起,我们开发出一种方法来分析我们是否在肺癌中观察到一种潜在的免疫逃避机制—人白细胞抗原(human leukocyte antigen, HLA)位点的杂合性丢失(loss of heterozygosity, LOH),以及如果我们发现它发生的话,研究它的发生率和它如何可能影响肿瘤进化。”
Rosenthal解释道,HLA I类分子在癌细胞表面上的存在是被称作CD8阳性T细胞的免疫细胞识别和破坏癌细胞所必不可少的,并且人体的大部分细胞含有两套编码HLA I类分子的基因:一套基因遗传自母亲,另一套基因遗传自父亲。她说,有时,基因变化能够导致一套基因丢失;当这种被称作LOH的事件在HLA位点上发生时,它有潜力促进免疫逃避。
Rosenthal补充道,“我们观察到HLA LOH是一种高度频繁发生的事件,而且是在肺瘤进化晚期和在强大的选择压力下发生的。这些数据对我们理解这种肿瘤如何可能逃避免疫系统破坏和开发靶向新抗原的免疫疗法产生影响。”
这些研究人员开发出一种被称作LOHHLA的计算工具来分析来自肺癌样品的下一代测序数据,并且确定在这些样品中存在的HLA等位基因数量。
根据Rosenthal的说法,鉴于HLA基因是人类基因组中的最为多样化的基因之一,其中的一些HLA基因亚型具有上千种等位基因,很少有HLA测序片段成功地与人类参考基因组相匹配。她说,这意味着鉴定出杂合位点是不可能的,而这又是LOH分析所必需的。LOHHLA利用患者的已知HLA等位基因来检测LOH,从而解决了使用人类参考基因组的问题。
这些研究人员获得90名登记参加TRACERx(tracking cancer evolution through therapy, 通过治疗追踪癌症进化)研究的NSCLC患者在治疗前的肿瘤样品,并利用LOHHLA分析了来自这些肿瘤样品的下一代测序数据。他们在40%的患者中检测到HLA LOH。在此之前,通过分析来自692名初治NSCLC患者的癌症基因组图谱(The Cancer Genome Atlas)下一代测序数据和之前公布的来自37种配对的原发性NSCLC/脑转移瘤样品的下一代测序数据,一种类似的HLA LOH发生率也被观察到[2]。
进一步分析表明HLA LOH与较高的亚克隆新抗原负荷(subclonal neoantigen burden)、APOBEC介导的突变、细胞溶解活性上调和PD-L1阳性相关联。Rosenthal说,这突显了免疫系统主动地塑造肿瘤,并提出HLA LOH对通过免疫反应施加的选择压力作出反应。
她也解释道,HLA LOH的亚克隆发生率,它们在肿瘤转移位点上的富集和它们的平行发生都提示着HLA LOH是一种免疫逃避机制,是在NSCLC肿瘤进化后期筛选出来的。
根据Rosenthal的说法,这项研究的主要限制在于当前仅考虑来自NSCLC患者的肿瘤。(生物谷 Bioon.com)
参考资料:
1.Nicholas McGranahan, Rachel Rosenthal, Crispin T. Hiley et al. Allele-Specific HLA Loss and Immune Escape in Lung Cancer Evolution. Cell, Published online:26 October 2017, doi:10.1016/j.cell.2017.10.001
2.Priscilla K. Brastianos, Scott L. Carter, Sandro Santagata et al. Genomic Characterization of Brain Metastases Reveals Branched Evolution and Potential Therapeutic Targets. Cancer Discovery, doi:10.1158/2159-8290.CD-15-0369

细胞和基因治疗领域(CGT)近几个月经历了史无前例的进展,这在几年前几乎不可想象。现在是时候暂停一下,回顾一些最近的亮点。
两种嵌合抗原受体(CAR)T细胞治疗产品:诺华(Novartis)的Kymriah和Kite/Gilead的Yescarta,因疗效显着得到FDA批准。
美国FDA顾问团队(和患者)一致推荐Spark Therapeutics的腺相关病毒(AAV2)基因疗法Luxturna用以治疗罕见的失明。该方法通过视网膜下注射病毒进行基因治疗。
来自蓝鸟生物(bluebird Bio)STARBEAM临床试验,体外慢病毒治疗肾上腺脑白质营养不良(CALD)获得持续阳性结果,上个月发表在《新英格兰医学杂志》(NEJM)上。
根据《NEJM》本月发表的一篇论文, AveXis公司的编码SMA1的AAV9病毒在单次剂量给药后显着改善脊髓性肌萎缩症患儿的存活率和运动功能。
这确实是令人兴奋的时刻——创新的步伐似乎令人难以置信。以细胞和基因治疗为基础的活性药物由于其引人注目的临床数据而进入主流视野,几十家大大小小的公司正在推进下一代CGT疗法。现在,有必要反思一下,我们到底走得多快、走了多远。
一夜成名
直到2010年,很少有人能预测到CGT领域能够如此迅速地取得今天的进展。
基因疗法曾经被叫停。1999年,在宾夕法尼亚州佩恩市进行的鸟氨酸转氨甲酰酶缺乏症(OTCD)基因治疗试验中,在一名叫做Jesse Gelsinger的患者意外死亡后,AAV基因治疗几乎完全进入停滞状态。大多数早期涉足该领域的私营企业放弃了这个方向,只剩下几个勇敢的学术界研究者继续艰难推动该领域的前行。
在腺病毒载体出现安全危机之后不久,体外逆转录病毒疗法也引起了关注:在第一批患有“泡泡男孩”病(一种严重联合免疫缺陷,SCID)的患者中,部分患者在接受了用逆转录病毒转导的细胞移植后,发展为急性白血病。这些癌症可能是由于逆转录病毒引起的外源基因对基因组的随机整合造成基因功能的破坏而导致的。这导致体外逆转录病毒治疗也被亮了红灯。对该领域的投资兴趣在21世纪的第一个十年里的大部分时间内都十分有限。
在这同一时期,当时已经有将近20年研究历史的CAR-T技术也只有很有限的临床数据:最初的构建体系缺乏正确的配置来满足高效的体内刺激和增殖,而这是有效抗癌所必须的。
成功的苗头在7-10年前出现
2008年,在罕见失明病例中,经眼给药的AAV2临床试验显示出疗效。2009年,具有里程碑意义的《NEJM》论文报导了一项仅有10名患者的小型试验,离体逆转录病毒基因治疗在因腺苷脱氨酶缺失导致的严重联合免疫缺陷(ADA-SCID)的患者中得到了治愈结果,并且安全性更高。2009年末在《科学》杂志上发表的对两名ALD患者的慢病毒给药也报导了积极结果。2010年,关于下一代CAR-T的报导开始出现。2011年8月,一篇《NEJM》论文总结了在宾夕法尼亚进行的CD19 CAR-T治疗慢性淋巴细胞白血病(CLL)患者的病例,结果显示显着阳性。同一个月,纽约Memorial Sloan Kettering癌症中心的研究人员在《Blood》杂志上发表了10例急性淋巴细胞白血病(ALL)患者的临床试验数据。
所有这些样本量非常小的研究开始改变CGT领域的势头——滋生了早期的乐观主义。这种乐观主义推动了最初的资助,推动研究持续进展,并开始从学术界到工业界转移。这些积累导致了近年来的投资大潮。
在这一背景下,我们值得反思创新的步伐,因为这些小型研究引起了全世界的关注:CART领域仅仅用了六年就从报导第一个真正有效的患者数据到获得两项FDA批准。对于任何候选药物来说,这都是一个快速的临床周期,而对于一个完全新颖的、前所未有的细胞活性药物来说更是如此。
然而,虽然在某种意义上这种发展速度似乎很快,但在其它一些方面,这一速度在生物技术的历史上也是特别缓慢的。正如Magenta首席执行官Jason Gardner在一年前的博客帖子中所写的那样,CGT领域显然站在了巨人的肩膀上,并从几十年的基础工作中受益。早期的SCID移植工作始于1992年左右;近二十年来一直停留在学术探索和技术验证层面,但最终,体外逆转录病毒细胞疗法Strimvelis在2016年春季在世界上首次得到了治疗ADA-SCID的批准。第一个CAR-T概念是由Zelig Eshhar于1989年在《PNAS》上描述的,距今年CAR-T首次获FDA批准已近30年。
经过几十年的努力,CGT才“一夜成名”。
来自于小样本的强大数据
CGT领域发展史的突出特点是:真正引人注目的早期临床数据有催化作用。药物研发的一个公理就是“伟大的药物很早就崭露头角”,在CGT领域尤其如此。在很多情况下,虽然患者为数不多,但数据已经足够清楚。在存在大量无法治愈的严重疾病的前提下,如果CGT有疗效,人们通常在患者数量不多时也能快速地看到显着结果。在临床研究的后期阶段也是如此:Luxturna的3期临床研究只有21名患者; 而Strimvelis是在完成18名患者的临床研究后被批准的。
这种显着疗效常常是因为病理生理学和基因疗法的作用之间的确切联系:用内源性连续表达基因产物来纠正丢失的基因。早期的外源酶替代突破也强调了这一点。在遗传疾病之外,像CAR-Ts这样的工程细胞可以选择与人体强大的免疫系统联合来攻击癌细胞上的特定抗原。
鉴于这些疗法的复杂性,明确的早期疗效或对生物标志物数据的强大信心,对驱动投资界对CGT的热情是至关重要的。
新兴的离体慢病毒CGT公司AvroBio就是一个很好的例子。该公司成立于2015年,由Atlas Venture提供种子资金并孵化,AvroBio的愿景是通过离体慢病毒干细胞移植治疗,来治愈溶酶体贮积病(LSDs)。AvroBio建立在来自于Jeff Medin和Roscoe Brady(后者是几个LSDs遗传缺陷的发现者),以及Lund大学的Stefan Karlsson和加州大学圣地亚哥分校(UCSD)的Stephanie Cherqui实验室近二十年的临床前研究基础上。基于法布里病小鼠模型的临床前工作,并与加拿大多中心FACTs小组合作,最近开始了有史以来第一次治疗法布里病的离体慢病毒移植治疗临床试验,患者人数为1人,其初步结果尤为引人注目。
如上图所示,在最近的加拿大罕见病组织(Canadian Organization of Rare Disease, CORD)会议上,在用慢病毒转导的自体CD34阳性细胞移植6个月后,第一名患者的α-半乳糖苷酶A酶活性水平现在完全进入正常范围,在他的整个一生中没有内源性表达的酶。假设酶活性水平与长期结果相关,这似乎是合理的,则该患者可能被治愈。这是法布里病患者社区的激动人心的时刻,也是AvroBio公司的激动时刻,因为其在法布里病,戈谢病,胱氨酸血症和庞贝疾病领域,治愈性的离体慢病毒CGT的组合进展。其中三种疗法将在明年的这个时候进入临床测试。
监管机构也重视这些突破性的数据
CGT领域的高影响力早期临床数据不仅令投资者感到兴奋,监管机构也已经开始认识到这些疗法的力量,特别是在治疗罕见遗传疾病方面。
2017年5月,在美国食品和药品法研究所的年度会议上,CBER主任Peter Marks强调了“治愈21 世纪法案”在推动新工具方面的影响,如再生医学高级疗法(RMAT)指定。最后,RMAT程序将有助于加快新的CGT临床计划,以获得FDA的批准。
此外,Marks继续说,“对于罕见疾病基因治疗试验,即使是无对照的单臂临床研究,如果获得令人瞩目的结果,也可能足以获得批准……”。
考虑到CGT产品涉及新颖的和史无前例的技术——病毒/细胞的制造和处理、以及移植手术—— 让FDA和其他监管机构给出像RMAT的指南,将极大地促进该领域的发展。这些不是传统的药片,它们的临床和监管都将需要新方法和新标准。
值得期待的美国血液学会会议ASH17
即将在2017年12月召开的美国血液学会(ASH)年会预告将突出CGT领域的进展,并加强这些活性药物“主流化”。ASH17摘要清单近期公布,又激起了很多热情。
在CAR-T方面,许多优秀的工程化T细胞疗法在一系列适应症方面取得进展。来自蓝鸟和诺华的BCMA CAR-T 在50-60名合并的患者中继续提供强有力的总体缓解率(ORR)。来自Juno,Novartis和Kite / Gilead等多家CAR-T开发者的更新的DLBCL数据继续显示高总体缓解率。范围广泛的下一代方法,如可切换CAR-T,同种异体CAR-T,以及UNUM制药正在进行的用抗体联合T细胞受体的工程T细胞与利妥昔单抗共同治疗难治性NHL的临床试验(ATTCK-20-2),也让我们拭目以待。
在慢病毒CGT领域,我们看到:在载体(如更好的启动子,构建体)方面的真正改进、更有效的病毒和细胞生产、更高(和更高质量)的细胞剂量——这些都将导致更好的移植效率(即较高的“载体拷贝数”),反映于在造血谱系细胞中存在更多的基因被纠正的细胞。蓝鸟(LentiGlobin)和意大利圣拉斐尔特里松基因疗法研究院SR-TIGET(GLOBE LV)将公布在治疗血液病如地中海贫血方面的数据。蓝鸟在新的镰状细胞病研究中观察到升高的载体拷贝数(VCN),显示出改良的生产方式等的积极影响。此外,SR-TIGIT将突出展示使用新的骨内输送路线(将移植细胞直接注入骨内以获得更高的植入率,更高的VCN)的数据。SR-TIGIT与Bioverativ合作,将展示针对血友病B的肝脏导向的“免疫隐形”体内慢病毒疗法。最后,与细胞移植治疗相关,Magenta Therapeutics将就CD34 + HSC扩增和靶向非遗传毒性调节方案等做多个口头和海报展示,这些都代表了CGT领域发展的重要方向。
获得非常值得肯定的成就,慢病毒治疗领域的两位先驱Luigi Naldini和Marina Cavazzana将在会议上举办讲座。这些信息表明,CGT领域已经进入主流,站在巨人肩上,一夜成名。(生物谷Bioon.com)
2018年1月19日讯 /基因宝jiyinbao.com /——一项关于罕见血糖问题家族的研究发现一个对胰岛素(重要的糖尿病调节荷尔蒙)调节至关重要的基因。
图片来源:CC0 Public Domain
该研究由伦敦玛丽皇后学院、英国克塞特大学和范德比尔特大学一起完成,于最近发表在PNAS上,将为罕见和常见形式的糖尿病带来新的疗法。
除了最常见的1/2型糖尿病之外,约1-2%的糖尿病是由于遗传紊乱。缺陷基因通常会影响胰腺中产生胰岛素的细胞(bata细胞)的功能。
该研究团队研究了一个独特的家族:该家族部分成员患糖尿病,而另一部分成员的胰腺长出了产生胰岛素的肿瘤。这些肿瘤叫做胰岛瘤,通常会导致低血糖,而糖尿病则会导致高血糖。
首席作者Márta Korbonits教授说道:“我们最初非常惊讶,因为这两种完全相反的情况出现在了同一个家族。我们的研究表明,同一个基因缺陷影响了胰岛中生成胰岛素的beta细胞,最终导致了两种相反的医学疾病。”
该团队还发现男性更容易发展成为糖尿病,而胰岛瘤常见于女性,但是出现这些差异的机制还不清楚。
Korbonits教授补充道:“令人兴奋的是我们可以使用这项发现去开发新手段帮助beta细胞再生,从而治疗常见的糖尿病。”
研究人员找到了基因MAFA上发生的基因突变,该基因控制beta细胞产生胰岛素。令人意外的是,这个基因缺陷在该家族的糖尿病和胰岛瘤病人体内都存在,同时研究人员在另一个不相关的出现相似情况的家族成员中也发现了这个基因缺陷。
这是第一次发现这个基因缺陷与疾病相关。突变导致合成的蛋白质异常稳定,在细胞中长期存在,因此在beta细胞中的含量显著高于其正常形式。
该文章第一作者Donato Iacovazzo博士说道:“我们相信这个基因缺陷在疾病发展过程中至关重要,我们现在正在进行进一步研究以确定这个缺陷如何影响胰岛素的产生从而导致糖尿病和胰岛瘤。”
Faye Riley是Diabetes UK的研究通讯官,她说道:“在Diabetes UK,我们致力于了解所有形式糖尿病的情况,这项研究给了我们重要的认知改变:单一基因如何影响胰岛素生成beta细胞以及这如何导致罕见糖尿病。这也是一个关于研究罕见糖尿病如何帮助我们了解常见形式糖尿病的极好的案例。”(生物谷Bioon.com)
参考资料:
Donato Iacovazzo el al., “MAFA missense mutation causes familial insulinomatosis and diabetes mellitus,” PNAS (2018). www.pnas.org/cgi/doi/10.1073/pnas.1712262115
2018年5月17日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Nature Medicine上的研究报告中,来自Bellvitge医学研究所(IDIBELL)的科学家们通过研究发现,DNA微小改变的遗传或会改变基因PM20D1的表达,同时这还与个体阿尔兹海默病患病风险增加直接相关。
图片来源:IDIBELL
研究者Johannes Graff说道,在过去7年里,我们对阿尔兹海默病和其它痴呆症(和路易氏小体相关的痴呆症或帕金森疾病)患者进行研究,绘制出了这些患者大脑中所发生的表观遗传学改变的详细图谱;此前研究人员通过研究阐明了DNA序列改变的遗传如何诱发机体大脑的分子损伤。
这种改变与神经保护性基因PM20D1的活性丧失直接相关,任何携带这种DNA改变的人群患阿尔兹海默病的可能性都较高,因此在未来研究中,携带这些突变的人群常常会成为临床预防试验的最佳候选者;本文研究结果强调了科学家们需要进行多项合作,将每组个体不同领域的表观遗传学经历、遗传学特性、生物信息学信息以及神经科学特征相结合,而本文研究中研究人员就证明了多学科研究在解决诸如痴呆症等复杂和毁灭性疾病上的有用性。
阿尔兹海默病是一种神经变性疾病,由于西方国家老龄化程度的加剧,如今人群中阿尔兹海默病的发病现象越来越频繁,而且目前并没有治疗该病的有效疗法。如果患者早期进行干预的话,仅有部分特定药物能够减缓患者疾病的进展情况,除了年龄因素外,研究人员并不清楚是否还有其它因素会导致该病发生。和高风险相关的遗传因素或许组成了最小比例的患者群体,但在同一个家庭中,似乎有一些病例的聚集程度要比偶然机会要高一些。(生物谷Bioon.com)
原始出处:
Jose V. Sanchez-Mut, Holger Heyn, Bianca A. Silva, et al. PM20D1 is a quantitative trait locus associated with Alzheimer’s disease. Nature Medicine volume 24, pages598–603 (2018) doi:10.1038/s41591-018-0013-y
本文中,小编整理了多篇文章解读科学家们近期在基因疗法治疗人类疾病上取得的重要研究成果,分享给大家!
【1】EMBO Mol Med:科学家利用基因疗法成功治愈2型糖尿病和肥胖小鼠 未来有望应用于人体!
doi:10.15252/emmm.201708791
近日,来自巴塞罗那自治大学的科学家们通过研究,利用基因疗法成功治愈了小鼠的肥胖和2型糖尿病,相关研究刊登于国际杂志EMBO Molecular Medicine上。研究者表示,我们利用了一种名为腺相关病毒载体(Adeno-associated viral Vector,AAV)来携带FGF21(成纤维细胞生长因子21)基因的疗法(AAV-FGF21疗法)进行研究,单次使用这种载体就能操纵肝脏、脂肪组织和骨骼肌,使其持续产生FGF21蛋白,这种蛋白是由机体多个器官自然分泌的一种特殊激素,其能在很多组织中发挥作用,维护正常的能量代谢,通过基因疗法来诱导动物机体产生FGF21蛋白就能够帮助减肥,并且降低机体对胰岛素的耐受性,从而治疗肥胖和2型糖尿病。
目前研究人员已经在两种不同的肥胖小鼠模型中成功进行了试验,即饮食或遗传突变所诱导的肥胖,此外,研究者还观察到,当给予健康小鼠应用这种特殊的基因疗法,就能促进小鼠健康老龄化,并且抑制年龄相关的特种增长和胰岛素耐受性的产生。利用AAV-FGF21疗法治疗后,小鼠体重就会下降,同时其脂肪积累的水平和脂肪组织的炎症水平也会降低,同时肝脏中的脂肪含量、炎症及纤维化也会被逆转,而且机体胰岛素的敏感性会增加。
【2】Molecular Therapy:脂质体纳米颗粒增强基因疗法治疗囊泡性纤维化的疗效
doi:10.1016/j.ymthe.2018.05.014
尽管数年前研究人员就开始采用基因治疗纠正囊性纤维化跨膜电导调节体(cystic fibrosis transmembrane conductance regulator,CFTR)来治疗囊性纤维化,但是基因疗法治疗囊性纤维化的潜力并没有得到该有的关注。
通过纳米颗粒输送mRNA是一种将遗传物质输送进入大量广泛分布细胞群体(例如呼吸道上皮细胞)的强有力技术。为了研究纳米颗粒输送mRNA治疗囊性纤维化的临床应用前景,来自俄勒冈州立大学药学院药学系等单位的科学家们近日开发出了一种基于临床相关脂质的脂质体纳米颗粒(lipid-based nanoparticle,LNP),并用它包装和输送化学修饰的CFTR mRNA(cmCFTR)进入病人来源的支气管上皮细胞,结果发现莫定位CFTR数量增加,恢复了其作为氯离子通道的主要功能。
【3】Nature子刊:利用CRISPR/Cas9增强基因疗法治疗遗传病的潜力
doi:10.1038/s41434-018-0003-1
基因疗法有潜力治疗遗传病,但是令科学家感到沮丧的一个主要问题依然存在:利用健康的基因替换“不好的”基因往往只是短暂地修复。在通常情况下,健康的替代性基因仅在几周内发挥作用。
如今,在一项新的研究中,来自美国华盛顿大学圣路易斯医学院的研究人员将基因编辑工具CRISPR/Cas9与一种失活的病毒相结合,将健康基因运送到活的小鼠体内的精确位置。更为重要的是,这些研究人员证实所运送的健康基因在小鼠体内正确地保持活性至少6个月的时间。 根据他们的说法,这种类型的基因表达的持续时间通常为四至六周。他们在六个月的时间内结束了对小鼠的实验,不过他们表示,这种基因表达的持续时间相当于这种修复能在小鼠体内持续终生。相关研究结果近期发表在Gene Therapy期刊上,论文标题为“Targeted in vivo knock-in of human alpha-1-antitrypsin cDNA using adenoviral delivery of CRISPR/Cas9”。
David T. Curiel博士说,“多年来,基因疗法存在的一种限制是很难实现长期的基因表达来治疗疾病。我们证实长期表达α-1-抗胰蛋白酶编码基因可治疗α-1-抗胰蛋白酶缺乏症(alpha-1-antitrypsin deficiency),其中α-1-抗胰蛋白酶缺乏症是最常见的遗传性肺气肿形式。如今,我们正在将这种技术应用于治疗血友病。血友病是一种血液不会正确地凝固的遗传病。”
【4】Nat Genet:揭开困扰科学界50年的奥秘 科学家们有望开发出治疗常见血液疾病的新型基因疗法
doi:10.1038/s41588-018-0085-0
近日,一项刊登在国际杂志Nature Genetics上的研究报告中,来自澳大利亚新南威尔士大学的研究人员通过研究利用CRISPR基因编辑技术成功将有益的天然突变引入到了血细胞中,从而就能增强血细胞和胎儿血红蛋白的产生,相关研究或能帮助研究人员开发治疗镰状细胞贫血和其它血液障碍的新型疗法。
这项研究中,研究人员解开了困扰科学家们50年的秘密,即一小部分人群机体中所携带的特殊突变如何运作来改变人类机体基因的表达。研究者Crossley说道,这种有益的突变是有机的,其不会向细胞中引入新的DNA,这种良性的突变对多种血液疾病患者是非常有益的。地中海贫血或镰状细胞贫血的患者机体的血红蛋白常常会出现缺陷,这种关键的分子能够在肺部“拾起”氧气分子并且其运输到机体其它器官组织中,上述疾病患者通常需要终生进行输血或药物治疗。
【5】Nat Commun:双剑合璧!神药二甲双胍协助基因疗法治疗肝癌!
doi:10.1038/s41467-017-02733-4
特拉华大学和伊利诺伊大学的科学家们已经找到了一种杀伤肝癌细胞、抑制肿瘤生长的新方法。首先,他们沉默了细胞内一种关键的酶,然后再加入了一种强效药。这项最新研究成果最近发表在《Nature Communications》上。
肝癌目前很难治疗,而这项将加速肝癌新疗法的发展。手术通常不是肝癌的选项,而可供选择的药物疗效却不佳。据NIH统计,超过82%的肝癌患者在确诊后5年内死去。
这个项目起源于伊利诺伊大学的实验室,研究人员培养了肝癌细胞并操纵了细胞内一种叫做己糖激酶2的酶的表达,随后研究人员使用了二甲双胍处理细胞,二甲双胍是一种可以降低肝脏产糖的糖尿病药物。
特拉华大学化学和生物工程学教授Maciek R. Antoniewicz课题组设计了一系列实验检测癌细胞如何对缺失己糖激酶2做出反应,该酶可以帮助细胞代谢葡萄糖。
【6】Cell Rep:基因疗法有助于治疗中风等大脑损伤
doi:10.1016/j.celrep.2018.02.102
最近,科学家们找到了一种能够促进大脑机能恢复的关键基因,该发现或许有助于治疗中分以及脊髓损伤等疾病。
最近这项由来自UT西南医学中心O’Donnell脑科学研究所的做出的研究表明,大脑星形细胞中一种基因的开启能够帮助脑细胞快速地从损伤中恢复。
根据该研究的作者,来自UT西南医学中心的神经学系主任Mark Goldberg博士的说法,这项研究虽然主要检测了脊髓损伤的情况,但对于一系列其它大脑损伤同样具有借鉴意义。
“我们都知道星形细胞能够帮助大脑以及脊髓从损伤中快速修复,但我们并没有充分理解这些细胞激活的机制。如今,我们能够分析细胞活性开启或关闭是否能够促进伤愈的过程”。这项发表在《Cell Reports》杂志上的文章发现星形细胞中的LZK基因能够促进胶质细胞增生。在这一过程中,星形细胞能够在受损神经元周围增殖并且结痂。
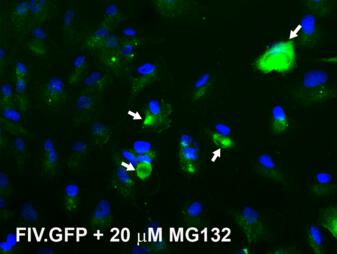
【7】IOVS:利用基因疗法治疗青光眼有戏!蛋白酶体抑制增加眼睛小梁网中的基因运送效率
doi:10.1167/iovs.17-22074
当通过降低眼内压力来测试治疗青光眼的基因时,来自美国威斯康星大学麦迪逊分校的研究人员偶然发现了一个问题:他们无法有效地将基因运送到控制眼内液体压力的细胞中。基因仅在进入细胞之中才能够发挥作用。
青光眼是最为常见的致盲性疾病之一,是由于眼内压力过高造成的,其中眼内压力过高通常是眼睛中的液体排出管(fluid drain)堵塞引起的。威斯康星大学麦迪逊分校眼科与视觉科学教授Paul Kaufman说,“大多数青光眼病例能够通过每日药物处理来加以治疗。在理论上,替代性基因可能恢复持续多年的正常液体流动,而无需每天自行给予眼药水,毕竟后者是不便利的,而且可能具有局部的甚至全身的副作用。
【8】Sci Trans Med:病毒基因疗法能够提高癌症治疗后乳房重构的效果
doi:10.1126/scitranslmed.aar2041
最近一项研究结果表明,利用病毒载体进行基因治疗能够保护机体免受放射性癌症治疗带来的负面效应。未来这项研究将被用于提高乳腺癌患者治疗后的乳房修复手术,保护患者不会出现伤疤、皮肤皱缩以及周围组织的损伤。
现代的放疗技术越来越精准,但仍旧会在治疗几个月到一年之内对周围组织(包括皮肤、血管)产生一系列的负面效应。而作者开发的这一技术能够有效提高女性乳腺癌患者治疗手的乳房重建手术的效果。相关结果发表在最近一期的《Science Translational Medicine》杂志上。
首先,作者给大鼠接种了携带有SOD2蛋白相关基因的慢病毒载体,该蛋白能够限制放疗后的有害颗粒引发的细胞压力反应。此外,作者进行了第二次的接种实验,同样利用慢病毒载体靶向抑制一类叫做CTGF的蛋白的活性,该蛋白参与了放疗后疤痕形成的过程。
为了更好地模拟临床实践,以及确保其仅仅对癌症之外的的健康组织产生影响,作者首先将病毒载体注入大鼠修复组织的血管中,之后再将这一组织移植进入体内。
doi:10.1126/science.aan4672
经过三十年挫折的磨砺,基因疗法(通过修改人的DNA来治疗疾病的过程)不再是医学上的未来事情,而是当前临床治疗工具包的一部分。 2018年1月12日,发表在Science期刊上的一篇标题为“Gene therapy comes of age”的论文深入地且及时地回顾了导致开发出几种成功地治疗严重疾病患者的基因疗法的关键进展。
美国国家卫生研究院(NIH)下属的国家心脏、肺部与血液研究所(NHLBI)血液部门高级研究员Cynthia E. Dunbar博士为这篇论文的共同通信作者。这篇论文也讨论了新兴的基因组编辑技术。根据Dunbar和她的同事们的说法,包括CRISPR/Cas9在内的这些方法将为精准地校正或改变个人基因组提供方法,这应该会转化为更加广泛的和更加有效的基因疗法。
基因疗法旨在将遗传物质导入到细胞中来补偿或校正异常的基因。举例来说,如果一个发生突变的基因导致损伤或促进一种必需的蛋白消失,那么基因疗法可能能够引入这个基因的正常拷贝来恢复该蛋白的功能。
【10】Cell Stem Cell:基因疗法能够恢复I型糖尿病小鼠的血糖水平
doi:10.1016/j.stem.2017.11.020
I型糖尿病是一类慢性的自体免疫疾病,主要病因是免疫系统攻击摧毁了产生胰岛素的beta细胞,从而导致血糖含量无法控制。根据最近发表在《Cell Stem Cell》杂志上的一篇文章,一种基因疗法能够提高糖尿病小鼠beta细胞长期的存活率,并且能够使得血糖水平得到长期的稳定。利用AAV病毒载体运送两个名为Pdx1以及MafA的蛋白进入胰腺,能够对alpha细胞进行重编程,进而使其转变为能够产生胰岛素的beta细胞。
“这项研究首次描述了一种能够转化的,简单的治疗这一自体免疫疾病的疗法,而且并不会出现免疫抑制疗法产生的副作用”。该研究的资深作者,来自匹司堡大学医学院的George Gittes说道。
世界上有9&的人受到了糖尿比你的困扰,而治疗该疾病的主要目标则是维持与恢复beta细胞的活性。然而,传统的细胞移植疗法会由于自体免疫系统的攻击而难以存活,因此治疗结果往往不佳。另外一个潜在的疗法是通过遗传工程的手段将其它细胞转变为beta细胞,为了验证这一方法的有效性,来自匹斯堡大学的研究者们通过AAV载体将两个小鼠胰腺蛋白Pdx1与MafA转入I型糖尿病小鼠体内,试图将充足的alpha细胞转变为beta细胞。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
据悉,北京诺思兰德生物技术股份有限公司近日完成“重组人肝细胞生长因子裸质粒注射液”Ⅲ期临床用样品制备,其生产规模为500L。据调查,500L规模的裸质粒基因治疗药物制备是迄今为止全球范围内首次达到的最大生产规模。
裸质粒是指没有结合蛋白、脂类或者对其有保护作用其他分子的质粒DNA,因其具有自主复制的能力,并可以表达所携带的遗传信息,被用于生物制药、农业、食品等行业,尤其在生物制药领域应用广泛。裸质粒基因治疗药物是通过裸质粒载体将外源基因导入靶细胞,并在体内表达相应蛋白,来达到治疗疾病的目的。随着基因治疗药物的快速发展,裸质粒基因治疗药物研究和应用受到研究机构和制药企业的广泛关注。截至2017年11月,全球范围内以裸质粒型基因治疗药物的临床方案(包含DNA疫苗)约有428个,其中处于临床Ⅰ期阶段有320个,II期临床阶段有91个,Ⅲ期临床阶段有17个。
截至目前,全球范围内尚未有裸质粒基因治疗药物批准上市,裸质粒生产大部分处于实验室和中试规模,仅美国、德国、日本等国家的几家公司能专业制备裸质粒基因治疗药物,其规模基本上在100-200L。裸质粒的规模化生产是实现裸质粒基因治疗药物产业化和商业化亟待解决的问题。
诺思兰德公司开发的“重组人肝细胞生长因子裸质粒注射液”是由pCK载体和杂合肝细胞生长因子基因组成的一种裸质粒基因治疗药物,现已完成Ⅱ期临床研究。该药物实现500L规模生产,是裸质粒基因治疗药物开发进程中的一次重大突破,也是该公司开展Ⅲ期临床试验的必要前提。诺思兰德科研团队通过多年努力,攻克裸质粒发酵、前处理、纯化等环节的技术难题,不断优化工艺参数及条件,自主创建了“NL-DNA-Tech”裸质粒基因治疗药物生产技术,其生产工艺稳定,产品质量可靠,符合规模化生产要求。
本次诺思兰德生产的“重组人肝细胞生长因子裸质粒注射液”临床样品,其收率大于60%、纯度大于97%、超螺旋比例大于90%,全项检验均符合该品的质量标准。
诺思兰德董事长许松山先生表示:“重组人肝细胞生长因子裸质粒注射液”Ⅲ期临床试验用样品的成功制备,不仅是对公司科研能力的一次检验,也是本品Ⅲ期临床试验顺利开展的一种保证,具有重大而深远的意义。公司将继续开展相关研究,进一步扩大生产规模,将建设自动化、智能化的世界领先的裸质粒药物规模化生产体系。(生物谷Bioon.com)