动脉网据外媒获悉,近日,基因检测初创公司10x Genomics又筹集了3500万美元。本次融资是该公司D轮融资的延续,10x Genomics将用这笔资金继续推进研发工作和扩大产品营销。
在2018年4月,10x Genomics就已筹集了5000万美元的D轮融资,由Meritech Capital领投,Fidelity investment(富达投资集团)、Wells Fargo(富国银行)、Venrock、Foresite Capital和软银(Softbank)共同参与投资。对于此次不创建新轮融资,而是延续D轮,该公司联合创始人Serge Saxonov表示,这样做是为了提高融资效率。
10x Genomics是基因检测领域的领导者,成立于2012年,总部位于美国加利福利亚州,在英国、法国、瑞士等十余个国家都设有办事处。该公司拥有革命性的DNA测序技术,可以帮助人们识别以往难以接触到的基因组信息,从而加快生物基因科学的发展。
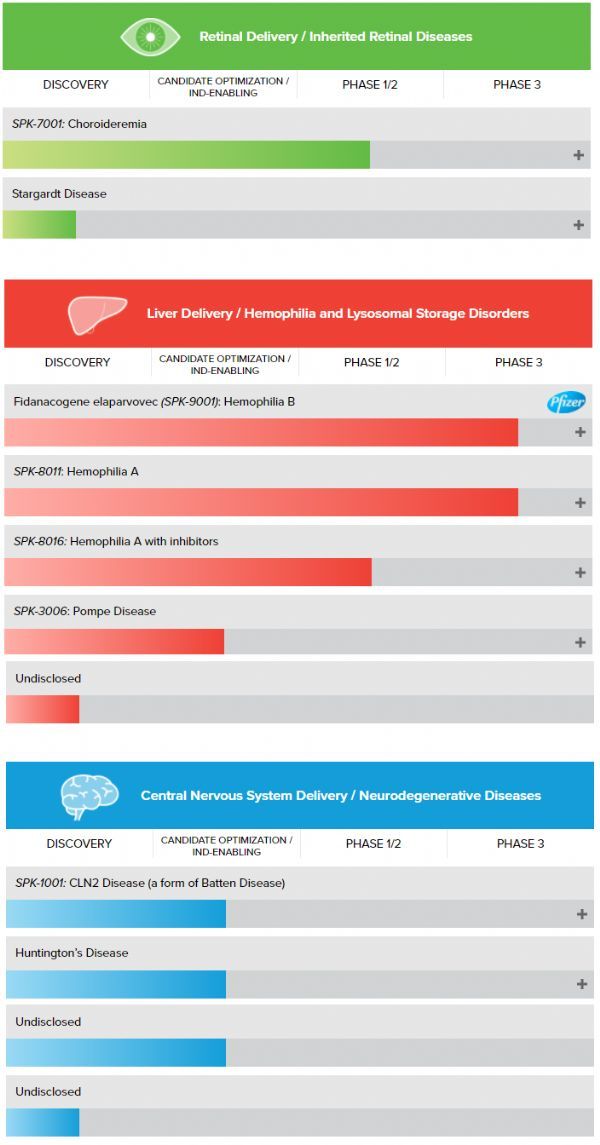
在2015年至2017年两年间,该公司收入增长了20倍。10X Genomics正计划继续扩张10倍,成为世界上最大的基因检测公司之一。据第37届摩根大会公布,10x Genomics在2017年的年收入为7100万美元,在2018年的收入为1.46亿美元,总收入增加了一倍以上。目前,10x Genomics市值已达到420亿美元,预计到2022年,公司市值会增涨到530亿美元。
10x Genomics究竟有何过人之处,竟在短短七年间,成为基因检测领域里备受瞩目的独角兽?
创新测序技术满足精准测序需求
10x Genomics主要有两种技术,一个是可以测试DNA短序列的Linked-Reads,另一个是对单细胞进行RNA测序的scRNA-Seq。
Linked-Reads能够对DNA进行短读取以获取大量基因组信息。它通过对HMW DNA进行分区和编码,形成新的数据信息,再从这些短读取的信息中,获得完整的基因组信息。这种创新技术可以应用到多种检测过程当中,比如在对遗传病的病理研究当中,一些遗传病对应的突变基因序列只能进行短读取,例如位于NGS死区的区域。这时Linked-Reads就能检测到这个隐蔽的基因区域,让研究人员能实验、分析到以往无法检测到的基因区域,满足生物研究对获取细胞精确信息的迫切需求。
除了在遗传病领域的应用,Linked-Reads还可以应用在癌症研究、农业环境的基因组学、人类基因组变异的这三个领域。通过Linked-Reads技术,短读取还原完整基因组信息,精确直观地从基因上找到产生问题的源头。
10x Genomics的第二种技术单细胞RNA测序(scRNA-Seq)技术,能够分析整个细胞群的RNA,并测量出大部分细胞的平均目标数值。scRNA-Seq通过分析单个细胞的转录,捕获样本中的异质性。无论是免疫T细胞还是病变肿瘤细胞都会出现异质性,这些细胞都可以进行单细胞RNA测序。这种对单细胞转录分析的方式保证了试验的准确性。
目前,scRNA-Seq实现了同一样本中数十万细胞的逐个细胞分子的表征分析,已经可以探索复杂的组织系统,例如免疫系统。
值得一提的是,10x Genomics应用专有技术还开发了一个Chromium系统,这个系统是一个试剂输送系统。它可以对大于100kb长度的DNA分子进行分区测序,然后将同区域产生的所有片段信息共享到一个条形码上,将分区与条形码一一对应,几分钟内便能产生10万条以上的条形码。从这些条形码的短读数据可以映射出原始DNA长分子的遗传信息。
现在,10x Genomics可以将以上几步过程整合到“短读序列发生器”中完成,轻松集成繁杂的实验步骤,简化工作流程。
经验丰富的领导团队助力10x蒸蒸日上
10x Genomics的联合创始人Serge Saxonov博士,在2016年被评为高盛百强年度最具吸引力的企业家。他曾是著名基因检测公司23andMe的研发总监,在创建10x Genomics之前,博士还是QuantaLife的副总裁,负责推进该公司ddPCR核心技术。Quantalife专注开发并商业化液滴PCR平台,但在2011年已出售给Bio-Rad Laboratories公司。
2012年,Serge Saxonov和Ben Hindson联合创立了10x Genomics公司。Ben Hindson博士是10x Genomics的首席科学家,也曾是Quantalife的联合创始人兼首席科学家。他在自己的研究领域持有多项专利,并发表了大量专业文章。
此外,该公司的首席商务官Brad Crutchfield先生,曾在QIAGEN、Illumina、Bio-Rad Laboratories、NanoString Technologies等国际知名生物公司担任相关职务,拥有三十多年的商业销售和营销领导经验。
10x Genomics的董事会主席John Stuelpnagel博士,拥有加州大学洛杉矶分校的MBA学位。他曾是Illumina的联合创始人兼首席执行官,帮助Illumina成为了生物领域的龙头企业,此外John Stuelpnagel还担任CW Group风险投资家、Ariosa执行主席、Sequenta董事长。John Stuelpnagel各种职称加身,是一位行业权威度高、经验丰富的专家。
特有的测序技术和经验丰富的管理团队成为10x Genomics蒸蒸日上的源源动力。10x Genomics在过去半年就收购了两家生物公司,分别是专注于表观遗传学的Epinomics和二维基因表达技术开发商Spatial Transcriptomics。
10x Genomics在2018年已经推出了一系列新产品,包括单细胞ATAC-seq。在2019年年初,又推出了第三版单细胞基因表达试剂盒。并且10x Genomics应用Spatial Transcriptomics开发的技术,在2019年研制了一种新产品,将薄组织切片覆盖在含有核酸探针的载玻片上,将保留空间信息的条形码附着于mRNA分子,然后将其制备用于测序。(生物谷Bioon.com)
 基因君官网
基因君官网