科学家们对人类基因进行编辑的正确方法是什么?以下这5条必读!
2019年8月23日 讯 /生物谷BIOON/ –自从科学家们首次利用CRISPR技术对基因进行精准编辑以来,他们一直在努力在研究何时以及如何在伦理上做到这一点,那么使用CRISPR对人类机体基因进行编辑到底合理吗?如果对人类生殖细胞进行编辑会将编辑后的遗传信息传递给子代吗?
图片来源:en.wikipedia.org
8月13日,人类生殖系基因组编辑临床应用国际委员会(International Commission on The Clinical Use of Human Germline Genome Editing)召开会议,讨论了编辑人类胚胎的指导方针,目标就是提供一个全球研究人员可以参考的框架,以确保他们的工作符合科学共识。早在2017年,美国国家科学院委员会就已经提出了相关的建议,他们呼吁科学家们应该谨慎行事,但却又模棱两可,以至于中国科学家贺建奎表示,他们利用基因编辑技术所产生的一对双胞胎女孩去年年底已经出生,而且一直在进行追踪研究。
以下有五条事项能够帮助探讨如何基于人类道德开发并监管一项存在潜在风险的新技术。
1、自愿暂停
目前并没有人会否认CRISPR的潜力,其有望帮助临床医生未来治愈遗传性疾病,无论是对于患病的成年人还是尚未出生的胎儿都是如此;但显然科学家们还有很多工作要去完成。2015年,一组科学家们就呼吁自愿冻结关于种系编辑(改变精子、卵子或胚胎)的研究,直至人类道德问题被解决。
化学生物学家Jeff Bessen表示,这种方法在科学界是有先例的,在科学界许多人认为,在不阻碍研究进展的情况下,放慢节奏、正确地强调安全和伦理是非常有意义的。
2、在继续前行前的严格障碍
美国国家科学院2017年的一项报告旨在为科学界提供关于这一问题的明确指导;研究者Rosa Castro解释道,该报告为修饰体细胞开了绿灯,为修饰生殖细胞开了黄灯,所产生的变化或许会遗传给吼道,该报告的目的是确保进行生殖细胞的编辑将仅用于预防严重的疾病,而且必须是在没有合理替代方案的情况下在强有力的监督下开展。
图片来源:sagaciousnewsnetwork.com
3、科学地前行
由研究人员此前宣布,他们成功利用CRISPR技术修饰了人类胚胎,尽管经过编辑的胚胎并未植入到女性体内,也并未出生,但生物伦理学家Jessica Berg教授表示,在研究人员迈出允许转基因胚胎发育并出生的关键一步之前,解决基因编辑的伦理问题至关重要。
那么在胚胎中能够编辑的项目类型是否有限制呢?如果是这样的话,应该需要什么?这些问题还涉及到谁要设定限制以及应该如何控制基因编辑技术的使用。当然了,我们可能还会关心谁来控制使用这项技术的后续研究,是否应该需要州或联邦政府进行监管?此外,还有一些关于成本和使用权的重要问题需要考虑。
4、基因编辑婴儿的出生
2018年,中国科学家贺建奎宣布他们已经完成了对胚胎生殖细胞的编辑,后来这些胚胎被植入到母体内,最终一对基因编辑双胞胎女婴出生了,当时全世界都表示非常震惊,研究人员宣称这对女婴免受HIV的感染。在很多研究人员看来,这一进展违反了2017年制定的人类基因编辑指南的规定,生物医学伦理学家G. Owen Schaefer提出了反对的主要理由,因为这种操作风险很大,可能会对编辑对象的健康造成不可预估的有害影响,甚至会超越基因编辑所带来的好处。
CRISPR婴儿或许是令人不安的生殖模式的一部分,有些“流氓”科学家会违背国际准则,从事一些在伦理和科学上都可疑的生殖领域的研究。
5、规章制度不能保证研究人员工作的道德性
无论8月13日召开的会议结果如何,在遵守规则和做正确的事情之间可能会存在区别,公众不应错误地将道德监督等同于道德可接受性,从定义上来讲,遵循这些规则的研究并不一定是好的;指导方针和期望都能够帮助定义科学界可以接受的内容,但遵守常规的监督并不能保证一个项目是有道德的,这或许是一个更加复杂的问题。(生物谷Bioon.com)
参考资料:
【1】The International Commission on the Clinical Use of Human Germline Genome Editing
【2】What’s the right way for scientists to edit human genes? 5 essential reads
by Maggie Villiger, The Conversation
基因疗法获FDA再生医学先进疗法认定 治疗“泡泡男孩病”

Mustang Bio公司与圣犹达儿童研究医院(St. Jude Children’s Research Hospital)共同宣布,其合作研发的治疗X连锁严重联合免疫缺陷病(X-linked severe combined immunodeficiency,X-SCID)的MB-107慢病毒载体基因疗法被美国FDA授予再生医学先进疗法认定(RMAT)。X-SCID又被称为“泡泡男孩病“,因为他们从出生时就需要生活在无菌的“泡泡”环境中。RMAT是专门为再生性疗法设立的审评途径,与FDA的突破性疗法认定类似,将加快这一疗法的开发和审评速度。
X-SCID是由于在X染色体上的IL2RG基因出现突变而导致的罕见遗传病。患者产生的淋巴细胞非常少,导致身体无法抵抗任何感染。如果不接受治疗,这些患者在婴儿时就会因为感染而去世。这些新生儿在出生时就需要被放在无菌的保护罩内生活,他们的一生可能都要在与世隔绝的无菌环境中度过,因此被称为“泡泡男孩”。
目前,除了提供无菌环境,降低感染发生的机会以外,治疗X-SCID的标准疗法是接受组织完全匹配的兄弟姐妹的骨髓移植。成功的骨髓移植手术虽然能够完全重建患者的免疫系统,但是超过80%的X-SCID患者没有完全匹配的供体,这些患者必须接受部分匹配的供体提供的骨髓组织。这种骨髓移植完全恢复免疫功能的可能性较低,而且可能产生严重的副作用。
MB-107是一种创新的基因疗法,该疗法使用慢病毒载体,在体外将健康的IL2RG基因导入从患者体内获得的造血干细胞中。然后将这些经过基因工程改造的造血干细胞注回患者体内。在接受造血干细胞疗法之前,患者会接受一轮低剂量的白消安(buslfan),帮助经过基因工程改造的造血干细胞在骨髓中生长和繁衍。这一新疗法同以前的基因疗法相比是一个重大的进步,以前的基因疗法试验中B淋巴细胞数目得不到恢复,患者仍然需要终身接受免疫球蛋白的静脉注射,在新的疗法中免疫系统的所有细胞都得到了恢复。
该疗法的RMAT认定是基于MB-107在1/2期临床试验的积极数据。在试验中,对8名患有X-SCID的婴儿进行了基因治疗。在治疗后两年内,这些婴儿的免疫系统功能和正常生长均有显着改善。而且,这种新疗法比以前的X-SCID基因治疗策略更安全、有效,且耐受性良好。在以前的研究中,基因疗法恢复了T细胞功能,但没有完全恢复包括NK细胞和B细胞在内的其他关键免疫细胞功能。在这项研究中,患者不仅恢复了NK细胞和B细胞功能,还有4名婴儿停止了静脉注射免疫球蛋白来提高免疫力。在这4个婴儿中有3个婴儿对疫苗产生了抗体反应,这也证实了其B细胞功能性。
“我们非常高兴FDA授予MB-107再生医学先进疗法认定,”Mustang总裁兼首席执行官Manuel Litchman说:“这一重要的里程碑进一步证实了我们的试验数据,并肯定了MB-107在解决这一缺乏有效治疗方案的致命疾病方面的潜力。我们期待与FDA和圣犹达儿童研究医院继续合作,加快开发和批准这一治疗方案,为满足患者的需求共同努力。”(生物谷Bioon.com)
PNAS:构建出提高CRISPR-Cas9基因编辑精确度的新变体—SaCas9-HF
2019年10月13日讯/生物谷BIOON/—在一项新的研究中,来自中国香港城市大学的研究人员开发出基因编辑技术CRISPR-Cas9的一种新变体,它有潜力在人类基因治疗期间提高基因编辑的精确度。相比于野生型CRISPR-Cas9,这种新变体降低了DNA中出现的意外变化,这表明它可能在需要高精确度的基因疗法中发挥作用。相关研究结果近期发表在PNAS期刊上,论文标题为“Rationally engineered Staphylococcus aureus Cas9 nucleases with high genome-wide specificity”。
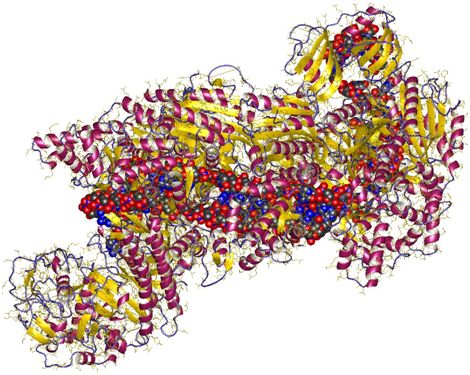
CRISPR-Cas9是一种在细菌中首次发现的酶,可以经编程后在精确的基因组位点上切割和修复DNA,因而被称为“分子剪刀”。它可用于校正存在缺陷的DNA链,而且目前正在临床试验中测试它抗击癌症、血液疾病和遗传性失明的效果。这种技术被认为具有治疗数千种人类遗传疾病的潜力。
但是,在目前的CRISPR-Cas9形式中,它面临着一些挑战。作为其中的一个版本,来自酿脓链球菌(Streptococcus pyogenes)的Cas9核酸酶(SpCas9),具有较高的靶标精确度,但对于将CRISPR-Cas9基因编辑系统递送至细胞所需的病毒载体而言,它太大了。作为另一个版本,来自金黄色葡萄球菌(Staphylococcus aureus)的Cas9核酸酶(SaCas9),它的体积小得多,因而它可以轻松被装入到递送这种基因编辑系统的腺相关病毒(AAV)载体中,但是,它缺乏与SpCas9同样高的精确度。不精确的基因编辑可能最终会在意想不到的位置编辑DNA,从而潜在地造成严重后果。
在这项新的研究中,这些研究人员鉴定出一种命名为SaCas9-HF的基因改造变体,它在实验室环境中可显著提高人细胞中24个基因组位点的基因靶向准确性。对于高度相似的基因序列,SaCas9-HF将脱靶活性降低了大约90%,然而当使用野生型SaCas9时,这往往导致意料之外的编辑。对于通常具有较少编辑失误的基因序列,SaCas9-HF具有几乎无法检测到的脱靶活性。
香港城市大学的Zongli Zheng博士说,“我们的发现为野生型Cas9工具提供了一种替代方案—在需要高度精确的基因组编辑时使用这种Cas9变体。这种新的核酸酶对在未来使用AAV在体内递送基因组编辑组分进行的基因疗法特别有用。”
还需针对更多的基因组位点和细胞类型开展研究以便确定SaCas9-HF在不同的细胞类型中具有同样高的基因编辑精确度。当然,这些研究人员对它在许多其他细胞类型中的应用持乐观态度。
根据这些研究人员的说法,就Cas9在感兴趣的基因组位点进行编辑的效果而言,与野生型Cas9相比,SaCas9-HF的平均在靶编辑效率为80%。在某些病例下,10%的CRISPR-Cas9基因编辑效率就足以修复受损的基因序列并恢复它的功能。(生物谷 Bioon.com)
参考资料:
1.Yuanyan Tan el al. Rationally engineered Staphylococcus aureus Cas9 nucleases with high genome-wide specificity. PNAS, 2019, doi:10.1073/pnas.1906843116.
2.New CRISPR-Cas9 variant may boost precision in gene editing
https://phys.org/news/2019-09-crispr-cas9-variant-boost-precision-gene.html
新生儿基因测序出炉 标价649美元
Nature:改写教科书!中国科学家阐明保护卵母细胞独特表观基因组的新型机制!
2018年12月2日 讯 /生物谷BIOON/ –在哺乳动物中,雌性机体的卵母细胞数量往往有限,卵母细胞拥有一套独特的表观基因组,其甲基化程度相当于精子的一半,而且卵母细胞也是一种分化程度最高的体细胞;截至目前为止,研究人员并不清楚这种独特的DNA甲基化的调控模式以及其相关的功能。
图片来源:CC0 Public Domain
近日,一项刊登在国际杂志Nature上的研究报告中,来自中国科学院生物物理研究所朱冰教授的研究团队通过研究就鉴别出了一种新型的DNA甲基化调节子—Stella,其在体细胞中的异位过量表达会通过干扰DNA甲基化调节子UHRF1的功能来诱发全面的DNA去甲基化作用。
文章中,研究者揭示了Stella如何通过一种活性的核输出过程将调节子UHRF1从细胞核隔绝,而Stella缺失所引发的UHRF1功能失调会导致卵子发生期间异常DNA甲基化的积累,相关研究发现揭示了首个调节性因子能够保护卵母细胞基因组特殊的甲基化状态。
由于Stella在卵母细胞中处于高度表达的状态,随后研究人员重点对卵子发生期间Stella的体内功能进行了研究,此前研究人员通过研究发现,没有Stella的卵细胞并不能够支持植入前胚胎的发育,本文研究中研究者阐明了缺失Stella的卵母细胞中转录惰性区域所发生的预先高度甲基化过程。这些母源性等位基因上超甲基化的异常启动子会严重影响合子基因组的激活以及植入前胚胎的发育。
更有意思的是,缺少DNA甲基化的母源性基因组似乎并不会影响植入前胚胎的发育,本文研究表明,保持一种独特的低甲基化状态的卵母细胞基因组至关重要。此外,研究者还发现,通常被认为能维持DNA甲基转移酶功能的特殊分子—DNMT1,仅会在体内半甲基化的DNA中处于激活状态,而且其也是引发Stella缺失的卵母细胞中异常DNA甲基化的DNA甲基转移酶,同时也能证明DNMT1在体内的去甲基化活性。
最后研究者表示,本文研究重写了教科书中对DNA甲基转移酶的分类,同时还阐明了DNMT1分子在有丝分裂后期细胞中的功能性角色,这或许能够帮助阐明DNMT1在机体老化过程中所扮演的关键角色。(生物谷Bioon.com)
原始出处:
Yingfeng Li, Zhuqiang Zhang, Jiayu Chen, et al. Stella safeguards the oocyte methylome by preventing de novo methylation mediated by DNMT1, Nature (2018). DOI: 10.1038/s41586-018-0751-5
从基因到靶向,加速精准医疗破局
Nat Med:新研究发现无用的自私基因可以预防心脏病!
2018年2月20日讯 /基因宝jiyinbao.com /——科学家们已经发现了一个基因,可能在预防心脏病中发挥重要保护作用。他们的研究发现基因MeXis在动脉栓塞组织中的关键细胞内帮助清除来自血管的过量胆固醇。
图片来源:Sallam Lab
这项研究发表在《Nature Medicine》上,由UCLA领导的研究团队在小鼠实验中发现MeXis控制着一个关键蛋白的表达,该蛋白可以将动脉血管壁上细胞内的胆固醇泵出细胞。
MeXis是自私基因的一个范例,自私基因是指一类不会产生蛋白因此被认为没有功能的基因。然而近年来的研究发现尽管这类无用的基因不会产生蛋白质,但是它们可以通过产生长非编码RNAs(lncRNAs)发挥重要的生物学功能。
“这项研究告诉我们lncRNAs对于涉及心脏病发展的细胞的内部功能很重要。”该研究通讯作者、UCLA大卫格芬医学院病理学和实验医学Frances and Albert Piansky教授Peter Tontonoz博士说道。“考虑到许多和MeXis一样的基因具有完全未知的功能,我们的研究表明进一步探索其他lncRNAs如何发挥功能将为正常生理学及疾病带来新的认识。”
在这项研究中,研究人员发现缺失MeXis的小鼠血管堵塞的概率是正常小鼠的两倍。此外,增加MeXis表达可以使细胞更有效地清除过量胆固醇。
在下一步的工作中,研究人员将进一步探索MeXis如何影响动脉血管壁上细胞的功能,并将测试不同方法改变MeXis的活性。研究人员对于进一步确定MeXis是否是治疗心血管疾病的靶标很感兴趣。
“lncRNAs直接涉及常见的小病(如动脉血管斑块的建立)为治疗和诊断心脏病提供了新思路。”该研究第一作者Tamer Sallam博士说道。他是医学系副教授及UCLA胆固醇管理中心共同主任。“这可能是解释这些基因产生RNAs而不产生已有的蛋白质的原因。我们接下来想探究的一个关键问题是它们如参与维持健康或者启动疾病。”(生物谷Bioon.com)
参考资料:
Tamer Sallam et al, Transcriptional regulation of macrophage cholesterol efflux and atherogenesis by a long noncoding RNA, Nature Medicine (2018). DOI: 10.1038/nm.4479
专访李劲松博士:人造精子孕育”女儿国” 破解出生缺陷基因
在刚刚过去的世界出生缺陷日(3月3日),世卫组织官网披露全球每年超过800万婴儿患有严重出生缺陷。剔除围产期环境因素和孕妇妊娠期用药不当等原因,绝大多数先天性缺陷都源于显性/隐性基因异常。因此明确亲代致病基因位点与遗传疾病的关联,对于孕前早期筛查的一级出生缺陷防控体系而言至关重要。
神经管异常是我国常见的重大出生缺陷之一,其中遗传因素贡献度高达70%。复旦大学王红艳课题组与中科院生化细胞所李劲松课题组合作,利用“人造精子”技术培育全雌性半克隆小鼠,仅耗时半年就成功验证神经管畸形的强致病基因位点。那么与传统二倍体基因组发育而成的模式动物相比,单倍体胚胎干细胞发育而成的小鼠有哪些特殊的研究优势?又将为重大遗传病研究和细胞重编程发展产生怎样的强大助推力?让我们到李劲松博士团队培育的特殊“女儿国”中一探究竟!
半克隆小鼠,快速锁定遗传缺陷基因
Q:人造精子技术在神经管缺陷的致病基因筛查中,如何实现其快速优势?
李劲松博士:神经管是胚胎的中枢神经系统,神经管异常之后会使胚胎产生无脑、脑部膨胀、脊柱裂、唇腭裂等症状。王红艳课题组在神经管畸形和正常对照样本中,筛选了数个潜在致病突变位点。我们团队将突变位点逐一敲入人造精子,分别培养出含有这些候选突变位点的小鼠细胞系,最后我们锁定了一系列基因位点的杂合突变会导致胚胎死亡。
传统二倍体胚胎干细胞基因打靶的周期较长,需要把胚胎干细胞注入到囊胚,发育得到种系嵌合的小鼠,再通过杂交一到两代来获得纯合动物。而以单倍体胚胎干细胞为对象进行基因研究和筛选,则会大大缩短实验周期。我们只需要将携带修饰基因的孤雄单倍体胚胎干细胞注入卵子,便能直接获得携带特定基因遗传修饰的半克隆小鼠,从而加速出生缺陷、多基因介导复杂疾病的病因分析。这正是我们得以实现快速基因筛选的关键所在。
Q:您的团队还将人造精子技术与基因剪辑技术进行了完美结合,请您谈谈相关应用。
李劲松博士:人造精子技术与最新基因剪辑技术CRISPR-Cas9结合后,可一步获得多基因同时敲入/敲除的小鼠模型,还可以培养获得携带多种基因突变的杂合小鼠模型,也能够通过小鼠个体遗传筛选从大量候选基因中快速确认重要基因。
另外我们还使用CRISPR-Cas9技术进行了有成效的受精卵基因编辑。我们将携带向导RNA的CRISPR-Cas9注入杂合子受精卵,发现1/3的新生小鼠白内障症状被治愈,且被修复的基因还可以遗传到下一代。同时我们也通过DNA测序发现,治愈小鼠中有2只存在非靶向基因位点的异常切割。
鉴于1/3的治愈率在疾病临床统计上仍然较低,以及以上实验的脱靶风险,我们又发展了精原干细胞介导的基因编辑研究。至今人类还无法在实验室条件下,直接复制天然精子和卵细胞。但利用精原干细胞,则能在体外长期稳定传代并可减数分裂出具有配子功能的精子。父系先天性白内障的病因之一,是编码晶状体蛋白的基因异常;通过体外编辑精原干细胞基因,我们发现由此培养的精子和由此发育而成的所有小鼠视觉系统都显示正常。所以精原干细胞疗法对于父系遗传疾病的治疗,是一个方向。
人造精子染色体:安能辨我是雄雌?
Q:人造精子可进行繁殖并传递基因修饰的成果列入2012年度中国科学十大进展。从孤雄单倍体胚胎干细胞到一只健康小鼠出生,有哪些关键的技术里程碑?
李劲松博士:自然界生物的繁殖方式多样,某些低等生物可由单倍体配子发育而成;有的昆虫和低等脊椎动物存在偶发或周期性孤雌无性繁殖;甚至还存在交配后卵母细胞核直接裂解的孤雄生殖。但高等哺乳动物繁衍后代必须由精子、卵细胞的细胞核融合,才能生成完整的受精卵。至今人类尚无法直接在体外复制天然精子和卵子,但上世纪80年代已有科学家构建了哺乳动物胚胎干细胞系和囊胚。在2011年,又有科学家利用流式细胞分选仪,成功解决了单倍体细胞自发二倍体化的困扰,通过反复分选和扩增稳定建立了孤雌单倍体细胞系。
我们团队的成果是在成功培养出孤雄单倍体细胞系之后,将人造精子注入卵子培养为“受精卵”。 人造精子随着体外培养传代,会逐渐失去产生半克隆小鼠的能力,其中一个原因就是印记基因的擦除和变化。我们在孤雄单倍体胚胎干细胞中敲除了H19-DMR和IG-DMR基因,即通过修改调整“人造精子”的相关印记基因表达,最终将半克隆小鼠发育成功率大大提升至20%。目前利用孤雄单倍体细胞培养的动物全部为雌性,原因是携带Y染色体的精子不能形成孤雄单倍体胚胎干细胞,这说明X染色体含有细胞发育不可或缺的重要基因。
Q:在孤雄单倍体胚胎干细胞研究成果发布之后,您的团队为何还要研发孤雌单倍体细胞?请您谈谈具体研究。
李劲松博士:建立精子来源的孤雄单倍体胚胎干细胞系需借助复杂的核移植技术,这仍然限制了单倍体细胞技术的应用。为此,我们也希望同步尝试用卵子代替精子建立单倍体细胞系。其实从上世纪80年代到2011年的重要单倍体胚胎干细胞研究,建立的都是孤雌单倍体细胞系,但即便实现稳定的细胞系扩增,仍然无法培育出胚胎。我们团队也曾通过化学物质在体外孤雌激活卵子,由此产生的孤雌单倍体胚胎干细胞直接注入卵子后可产生胚胎,但移植到小鼠子宫内,同样无法发育为个体。
所以我们转变思路,希望将天然卵细胞改造为精子使用。通过对全基因组以及所有印记基因的表达进行高通量测序,我们发现孤雌与孤雄单倍体胚胎干细胞具有非常相似的表达模式:因为孤雌单倍体胚胎干细胞的雌性印记基因,在细胞建立和传代过程中也会快速丢失,逐渐形成类似于孤雄单倍体胚胎干细胞的基因表达模式。
基于之前对孤雄单倍体胚胎干细胞的印记基因改造经验,我们也尝试对孤雌单倍体细胞进行H19-DMR和IG-DMR基因敲除,同样成功产生了类似于孤雄单倍体细胞的类精子,并且能达到15.5%的半克隆小鼠出生率,之后这些小鼠均能健康发育到成年并具有生育能力。这证明了哺乳动物孤雌发育的可能性,即胚胎中的两个基因组拷贝都来自于卵子。目前还有其他学者采取不同方式,将卵子甚至雌性动物体细胞改造为人造精子,让模式动物构成的“女儿国”在实验室内存在永续利用的可能。
“女儿国”细胞系的远大前程
Q:在人类和动物遗传病、不孕不育治疗领域,基因剪辑和细胞重编程技术有哪些应用前景和挑战?
李劲松博士:这些技术应用于人类胚胎基因编辑和克隆的伦理风险很明确,我个人也持否定意见。但是克隆技术在动物繁殖领域已有很多成熟应用,韩国等国家已广泛开展家畜和宠物克隆。但是大体型濒危动物的克隆还存在一些挑战。学生时代,我参与的课题组曾试图将大熊猫细胞系和黑熊卵子结合,来克隆我们的国宝大熊猫。我们曾成功培养出克隆胚胎,但移植到黑熊子宫内便发生流产或胎停现象。但如果我们的细胞重编程技术能够有所突破,濒危动物克隆对于生态环境的保护和研究会有很大帮助。
人类胚胎基因编辑至今仍不可接受和应用。最新人工辅助生殖技术仅限于从候选胚胎中,利用桑椹胚细胞基因测序,挑选天然基因正常的胚胎并移植进入母体子宫。另外在技术层面,胚胎或精原干细胞基因剪辑仍存在脱靶效应,我们需优化方法才能100%避免基因组非靶向位点突变。
对于细胞重编程技术在生殖领域的应用,也仍然还仅限于模式动物。克隆和半克隆技术培养的胚胎存活率水平并不高,全克隆囊胚中只有3%能发育为克隆动物,而且需要广泛采用复杂的四倍体胚胎补偿技术。将四倍体胚胎与二倍体胚胎聚合成一个胚胎,在聚合胚胎的发育过程中,四倍体的细胞绝大部分发育成胚外组织,而胎儿则是由二倍体发育而来。这些结果充分证明克隆囊胚的滋养外胚层中存在重编程异常并影响胎儿发育。而通过半克隆技术培养出的小鼠胚胎,我之前已经提到成活率在20%左右,对于实验室动物研究非常可观,运用于人类辅助生殖则不能想象。
Q:对于您的团队和整个研究领域而言,您觉得未来有哪些发展方向?
李劲松博士:不论是天然精子与卵子结合,还是通过细胞重编程实现的克隆/半克隆,配子的表观遗传模式都会在受精之后大规模改写,并结合产生具有细胞全能性的受精卵。全克隆操作过程中,在去核卵细胞的作用下,体细胞核作为终末分化细胞核的分裂次数还会被清零。由此可见生殖细胞的强大分化能力和孕育生命的神奇力量。正因为如此,天然配子的体外获得仍然是一个难题,希望未来有所突破。另外单倍体胚胎干细胞在体外培养时,如果不采用流式细胞分选仪则会100%发生自发二倍体化,隐藏在有性生殖背后的调控机制仍是未解之谜,我也非常渴望有人能够在未来破解这个谜团。
我们课题组最近参加了基因组标记(genome tagging)的大型项目。人类基因组测序计划完成之后,确认了26000多个编码蛋白质,至今有42%蛋白质功能研究还是空白,抗体开发是蛋白质组学的瓶颈之一。因为针对不同的蛋白质,抗体种类繁多且亲和度不够稳定,所以我们希望让所有蛋白质都带上同样的DNA序列标签,这段序列本身也能够编码蛋白质。由此利用一种针对标签DNA序列编码蛋白的抗体,就可以结合所有26000多种人体基因组编码蛋白质。这是一个非常庞大的项目,我们希望利用“人造精子”技术,快捷建立分别携带这些蛋白质的26000多个小鼠“人造精子”细胞系和标签小鼠库,为实现蛋白质功能网络和生命科学研究的划时代突破提供强大动力!(生物谷Bioon.com)
Nature:揭示病毒基因组如何浓缩在病毒衣壳内部
2019年6月2日讯/生物谷BIOON/—在一项新的研究中,来自芬兰赫尔辛基大学和英国牛津大学等研究机构的研究人员首次破译了病毒基因组如何在病毒衣壳内浓缩。相关研究结果于2019年5月29日在线发表在Nature期刊上,论文标题为“Multiple liquid crystalline geometries of highly compacted nucleic acid in a dsRNA virus”。
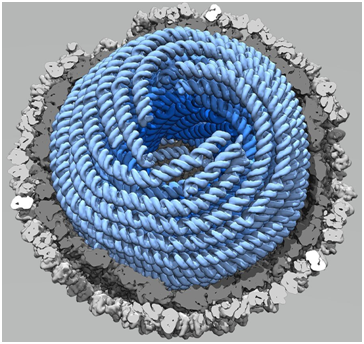
论文通讯作者、赫尔辛基大学赫尔辛基生命科学研究所副教授Juha Huiskonen说道,“这项研究的动机是增加我们对病毒复制的基本认识,但是从长远来看,这可能有助于治疗病毒性疾病。”
这一突破性结果是利用低温电镜技术实现的。近年来,低温电镜技术彻底改变了结构生物学,即一个旨在理解生命分子如何在原子水平上发挥作用的生物学领域。
通过使用强大的电子显微镜,这些研究人员拍摄了高纯度病毒的成千上万张图像。这些图像随后经结合在一起形成三维结构模型,从而允许他们不仅能够观察构成病毒衣壳的蛋白,而且还能够首次追踪这种蛋白外壳内的核酸基因组。他们观察到病毒基因组形成一种液态晶体,即一种高度浓缩和有序的液态物质状态。
Huiskonen说道,“这种浓缩程度是非常显著的。举例来说,如果这种病毒有一个健身球那么大,病毒基因组是粗马尼拉绳,那么就需要这种健身球里就会塞进近70米长的粗马尼拉绳。”Huiskonen说。
为了允许病毒基因在在病毒衣壳的范围内表达,病毒基因组的流动性可能是需要的,但是病毒基因组在这个过程中如何不会缠结在一起仍然是一个悬而未决的问题。在后续的研究中,这些研究人员旨在解决这个问题。
论文共同作者、赫尔辛基大学生物与环境科学学院大学讲师Minna Poranen解释道,“病毒颗粒是一种分子机器,可以通过给它提供正确的化合物来加以启动。”
Huiskonen补充道,“当病毒正在进行它们的工作时,能够在不同的状态下观察它们。通过这种方式,我们能够更好地了解这些迷人的纳米机器是如何发挥功能的。”(生物谷 Bioon.com)
参考资料:
Serban L. Ilca et al. Multiple liquid crystalline geometries of highly compacted nucleic acid in a dsRNA virus. Nature, 2019, doi:10.1038/s41586-019-1229-9.
 基因君官网
基因君官网

