2017年12月14日 讯 /生物谷BIOON/ –目前,基因编辑技术已经开始在临床试验中进行测试了,研究人员能利用CRISPR-Cas9和其它技术来直接对人类机体细胞的DNA进行编辑,多项临床试验都处于招募受试者或计划阶段;近日,一项刊登在国际杂志PNAS上的研究报告中,来自波士顿儿童医院及蒙特利尔大学的研究人员就通过研究发现,个体与个体之间的遗传差异或许会削弱基因编辑产生的效率,在更罕见的情况下或许会造成潜在的危险的“脱靶”效应。
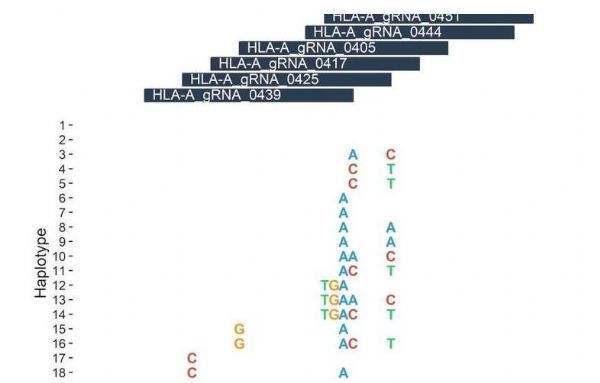
图片来源: Lessard S; et al
本文研究增加了一些新证据,即基因编辑或许需要适应每个病人的基因组,从而才能够确保被靶向作用的基因或附近DNA序列中不会出现突变。医学博士Stuart Orkin说道,人类的DNA序列并不相同,而且被认为是“正常”的DNA序列或许也并不能解释所有的差异;在设计治疗性编辑的靶向系统时我们推荐需要将常见的变异考虑在内,同时也为了能最大限度地发挥功效,减少患者潜在的安全隐患。
文章中,研究者对此前已经发布的7444个全基因组序列进行分析,基于研究人员比较感兴趣通过基因编辑来改变的30个疾病相关的DNA靶点列表,研究人员就制成了一张含有几乎3000个导向RNAs(gRNAs)的列表,当然这些只是被开发出的遗传代码的一部分,其能够直接直接指导CRISPR-Cas9酶进入到靶点附近合适的编辑位点。随后研究人员向通过研究观察是否这7444名个体机体的gRNAs中会携带DNA序列的改变。
研究者Canver解释道,如果CRISPR试剂能够用于治疗的这个位点存在一定的遗传差异,那么你可能面临治疗效率降低或疗法失败的风险;单个碱基对的差异或许会导致结合效率的降低,而这归因于导向RNA的错配,总而言之,或许就会引发患者疗法效率的下降。研究者发现,在基因组中出现这种现象并不罕见,大约有50%被分析gRNAs都会被靶点位置的突变体潜在影响;此外,在一些新的病例中研究者还发现,促进基因组中DNA序列与gRNA更好匹配的遗传突变或许会潜在地将DNA序列“拖动”到错误位置,从而就会使得基因或其它DNA区域不会被靶向作用。
研究者Canver说道,在罕见情况下或许会产生一些非常强大的“脱靶”位点,这样CRISPR试剂就能够结合并且切割一些它们不打算切割的位点;如果在肿瘤抑制基因上发生脱靶效应的话,那将是一个很大的问题。尽管本文研究阐明了CRISPR-Cas9基因编辑技术,但研究人员认为,本文研究结果还能够延伸到其它基因编辑工具中,比如锌指核酸酶(ZNF)和TAL效应核酸酶。
所有的技术都依赖于特异性地识别DNA序列,因此,影响靶向序列的突变体或许会降低导向RNA的结合,而突变也会在新的位点产生一些结合作用,从而对细胞产生损伤;随着新型基因编辑技术的不断开发,以及慢慢开始在临床中使用,确保每一种治疗都能够针对特殊的病人,对于研究者而言或许是至关重要的。(生物谷Bioon.com)
原始出处:
Samuel Lessard, Laurent Francioli, Jessica Alfoldi, et al. Human genetic variation alters CRISPR-Cas9 on- and off-targeting specificity at therapeutically implicated loci. PNAS (2017). doi:10.1073/pnas.1714640114
 基因君官网
基因君官网