
2019年5月23日 讯 /基因宝jiyinbao.com/ –最新一项研究表明,卵母细胞受精后立即会出现DNA活性和非活性区域的分化,该现象甚至在基因被激活之前就已经出现。该研究将有助于更好地了解单个受精卵母细胞发育成由许多不同细胞类型组成的完整生物体的机制。相关结果发表在《Nature》杂志上。
受精卵最终会发育成一个完整的,由数万亿个具有多种功能的细胞组成的有机体。尽管这些细胞具有不同的功能,但所有这些细胞中的DNA都是相同的。细胞的特性由基因组的特定表达谱决定。但其中的决定机制并不清楚。
DNA在细胞核中并不是随机分布的,他们在空间上具有活性和非活性区域的区分。不同的区域则由被称为Lamina Associated Domains,或LAD的结构分隔。
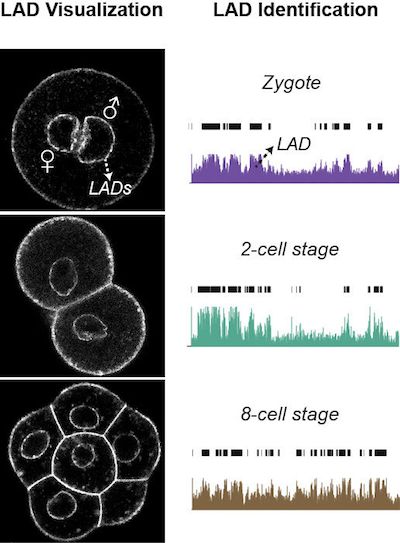
为了进一步研究清楚,研究人员开发了一种新方法,通过该方法,他们可以在胚胎发育的早期分析LAD和LAD中DNA的组织。
研究人员发现,在胚胎中的基因被激活之前,受精卵中的DNA已经出现了LAD区域和非LAD区域的划分。因此,LAD的形成在基因活动开始发挥作用之前。
此外,研究人员发现胚胎发育过程中基因的活性随着LAD结构的变化而变化。因此,似乎将DNA组织成LAD和LAD之间是一个非常早期的事件,最终导致细胞的身份。
新开发的方法及相关结果表明,该方法可用于进一步研究从单个受精卵母细胞形成整个生物体所涉及的机制。在未来,这将有助于更好地了解正常发育,但也会对胚胎发育过程中可能出现的问题提供更多见解。(生物谷Bioon.com)
资讯出处:Spatial DNA organization forms first, then the rest
2019年7月12日 讯 /生物谷BIOON/ –肿瘤微环境(TME,tumor microenvironment)是液体、免疫细胞及包裹肿瘤的血管所组成的混合体,肿瘤细胞与TME之间的相互作用能够帮助决定肿瘤的进展和命运;因此,理解TME的组成和功能对于有效抑制癌症进展至关重要,尽管多种遗传突变会增加癌症的发病率,但研究人员并不清楚TME对癌症发病的影响,近日,一项刊登在国际杂志Cancer Research上的研究报告中,来自日本金泽大学的科学家们通过研究报道了抗癌基因RB所扮演的关键角色。
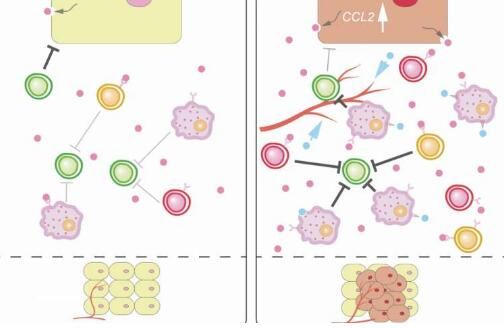
图片来源:Kanazawa University
视网膜母细胞瘤基因(RB,Retinoblastoma gene)是一种肿瘤抑制基因,其突变后会促进肿瘤生长;文章中,研究人员首先在患肉瘤的小鼠机体中失活RB,随后观察其对肿瘤生长的效应,结果表明,这些小鼠机体中的肿瘤的确增大了。当研究人员对TME进行分析后发现,新生血管的存在会滋养癌细胞,同时研究者还在TME中发现了新招募的免疫抑制性细胞,这些细胞能够克服机体的天然防御系统,同时RB基因的失活还会帮助TME促进癌症进展。
研究者还深入分析了TME中所发生的分子改变,结果发现,一种名为Ccl2分子的分泌会发生增加,Ccl2分子能够吸引免疫抑制性细胞;然而研究者并未在不携带Ccl2基因的小鼠机体中观察到TME中所发生的改变,这就表明,Ccl2分子水平的增加时RB介导的TME改变的罪魁祸首,为了阐明相关研究结果与人类癌症之间的关联,研究人员利用乳腺癌细胞系进行了相关研究。
正如预期想的那样,研究者发现,RB失活的乳腺肿瘤细胞中Ccl2的分泌会增加,此前研究中,研究者揭示了RB相关癌症中特定线粒体代谢产物的失衡状况,线粒体超氧化物(MS,Mitochondrial superoxide)就是其中一种代谢产物。研究人员分子了Ccl2分子分泌的改变是否与RB相关肿瘤中MS的失衡存在一定关联,当利用抗氧化剂(能抑制MS的积累)处理乳腺癌细胞时,Ccl2分泌的水平会明显下降,因此二者之间存在密切关联。
本文研究结果阐明了RB基因突变诱发TME改变及促进肿瘤生长的分子机制,深入理解其中的动态学变化有望帮助研究人员设计出新型肿瘤抑制策略来治疗RB突变的癌症患者,抑制线粒体失衡或直接靶向作用TME中的Ccl2分子或有望帮助研究人员开发出新型抗癌疗法。(生物谷Bioon.com)
原始出处:
Fengkai Li, Shunsuke Kitajima, Susumu Kohno, et al. Retinoblastoma inactivation induces a protumoral microenvironment via enhanced CCL2 secretion, Cancer Research (2019). DOI:10.1158/0008-5472.CAN-18-3604

基因治疗领域的创新公司一个个被收,原因可能不像看上去那样简单。
新年伊始,基因治疗领域交易频频,让人目不暇接。
新基公司(Celgene)“放血”,90亿美元收购巨诺,从此,这个血液肿瘤治疗领域的巨头也有了基因治疗新药,JCR17.
去年,先有吉利德大手笔,119亿美元收了风筝(Kite Pharma),让这个以肝炎病毒治疗为主的药企也一夜转身,成为基因治疗领域的领先者。
一个个药企纷纷跳入基因治疗领域,可以理解。因为,基因治疗代表了个性化治疗的最新趋势,潜力让人垂涎。
但是,其中的风险也不可小视。
以巨诺为例,其主打嵌合原抗体T细胞(CAR-T)新药JCAR15,在临床阶段曾经遭受一个重大打击。
2016年,两个病人在接受了巨诺的实验治疗后出现严重反应,患脑水肿后死亡。 这也是公司在重新开启了这个实验性治疗方法后再次发生的致命性副作用。
这个打击不得不迫使巨诺暂停了临床试验。
目前,巨诺的重点是针对CD19的CAR T细胞产品候选物,JCAR17,目前在进行治疗急性髓性白血病(AML)的二期临床试验。
基因疗法的副作用不可小看。除了脑水肿之外,患者还可能形成称为“细胞因子释放综合征”的病症,其中T细胞分泌大量的化学物质,导致严重的发烧,恶心,呼吸困难,低血压和器官肿胀。 癌症越恶化,细胞因子的病症越严重。
即使巨诺的这个基因疗法JCAR17,治疗复发性以及难以治疗ALL(急性淋巴白血病)的数据继续表现不错,在市场上的表现可能也不如预期。
这是因为,诺华和风筝已经有产品获批上市,而巨诺还在等待批准,即使顺利上市,届时也会面临竞争压力。
蓝鸟独自飞多久?
而另一家基因疗法开发公司蓝鸟(Bluebird Bio),则在这次收购风口中独自高飞,其中的原因何在?
表明看上去,蓝鸟公司失去了一个潜在的收购方,蓝鸟公司也在积极开发自己的CAR-T产品,BB2121。
蓝鸟的这个CAR-T也不一样,主要结合BCMA,用于复发性/难治性多发性骨髓瘤的治疗,处于临床一期。
蓝鸟目前的合作伙伴,正是多发性骨髓瘤的治疗的巨头,新基。
(蓝鸟公司收到巨诺收购的刺激,单日上升10%)
但是,相比巨诺的单一押宝基因疗法,蓝鸟的研发更加多元化。蓝鸟的第一个研发方向是基于造血干细胞的严重遗传病的疗法。
在此方面,蓝鸟的单剂量基因疗法Lenti-D治疗肾上腺脑白质营养不良(cALD)的患者, 经过两年的随访,17人中有15例患者的病情得以稳定。
看着并肩齐飞的伙伴一个个被收入怀中,而自己仍在独自飞,蓝鸟的心情一定有些异样。不管还能独自飞多久,蓝鸟的多元化可能只能会带来增值吧。(生物谷Bioon.com)
2018年2月3日 讯 /生物谷BIOON/ –构建细胞的信息储存在机体的遗传物质中(DNA),在这里我们能够找到人类机体中超过2万种不同蛋白质构筑的蓝图,每一个细胞都需要几千种不同的蛋白质来发挥功能,如果你将每一个蛋白质蓝图都卷在一起,那么它们所包含的信息仅仅占到了所有DNA不到2%的比例。
图片来源:news.feinberg.northwestern.edu
那么其它98%的基因组都能用来干什么呢?控制基因活性的开关都在这里,近日,发表在国际杂志Nature Communications上的一篇研究报告中,来自弗莱堡大学的研究人员通过研究首次绘制出了人类心肌细胞中DNA基因调节子的图谱。
研究者表示,为了能够定位所有的基因开关,我们利用现代的测序方法,在人类心机细胞发育、成熟以及疾病过程中对完整的基因组进行测序分析,其中包括DNA、表观遗传学标志物和RNA;通过对超过一万亿的测序字母进行分析,研究人员最终发现了10万多个基因开关,如今大量的数据就能够产生心肌细胞生命周期中基因调节子的完整图谱。
在心肌细胞发育和生长期间,DNA甲基化和组蛋白标记物能够有效控制基因的开启和关闭,同时研究人员所绘制的图谱也能够阐明某些心脏病发生的机制,比如,在DNA水平下,一些调节子元件常常会在心律失常患者机体中发生改变,相比而言,组蛋白就能够控制慢性的心力衰竭,未来,研究人员还希望通过更为深入的研究来在图谱中鉴别出最重要的开关来为开发治疗心脏病的新型疗法提供一定思路。(生物谷Bioon.com)
原始出处:
Ralf Gilsbach, Martin Schwaderer, Sebastian Preissl, et al. Distinct epigenetic programs regulate cardiac myocyte development and disease in the human heart in vivo. Nature Communications, 2018; 9 (1) DOI: 10.1038/s41467-017-02762-z

今日,强生(Johnson & Johnson)旗下的杨森(Janssen)公司宣布与MeiraGTx签署了一项全球合作和许可协议。两家公司将联合开发、生产和推广一系列治疗遗传性视网膜疾病(IRDs)的药物,包括针对由CNGB3或CNGA3突变引起的全色盲(achromatopsia,ACHM),以及X连锁视网膜色素变性(X-linked retinitis pigmentosa,XLRP)的候选产品。两家公司还将开展合作研发,研究其它IRDs的新靶点,以及开发腺相关病毒(AAV)的生产技术。
依据本次协议,杨森将向MeiraGTx支付1亿美元先期付款,以获得治疗IRDs的临床前试验项目的独家选择权。杨森将负责后续临床试验费用,而MeiraGTx则有资格获得高达3.4亿美元的各种里程碑付款,以及产品销售额分成。
专注于开发基因疗法的生物医药公司MeiraGTx,目前的研发重点包括眼科疾病、唾液腺疾病和神经退行性疾病三个主要领域。MeiraGTx在病毒载体的设计,优化以及基因疗法生产方面具有核心能力,并具有潜在的转化基因调控技术。MeiraGTx使用AAV作为传递基因的载体,通过对载体的定制能针对不同疾病优化基因疗法。载体衣壳蛋白的细小差异可以调节将基因递送至不同类型细胞的效率,从而允许选择不同的AAV衣壳以期最有效地靶向特定细胞类型。
此外,MeiraGTx表示其基因调控平台是一种潜在的革命性技术,它将基因表达的“开/关”开关整合到基因疗法载体中,然后可以使用小分子激活。通过这种方式,可以依据患者的需要和疗法的剂量需求打开和关闭基因疗法。
IRDs是适合使用基因疗法的理想疾病领域,因为大多数导致疾病的基因突变已经被确认,而且眼睛一定程度上是一个免疫特权区域。临床试验表明,在眼睛中使用AAV或者慢病毒(LV)载体递送基因疗法不会导致全身性副作用,而且不会引起显着的免疫反应。大部分在研疗法的目标是导入功能正常的基因,从而恢复缺陷基因编码的蛋白的正常表达,例如CNGA/CNGB(治疗全色盲),和RPGR(治疗XLRP)基因。
ACHM的特征在于从出生就表现出视敏度显着降低、极端光敏感性、眼球震颤和没有色差。ACHM具有遗传异质性,携带CNGB3或CNGA3基因突变的ACHM患者比例可高达92%。全美约有3万名ACHM患者。XLRP患者在儿童时期即可出现症状,并在20至30岁快速进展至失明。到目前为止,尚无有效和获批疗法用于治疗ACHM和XLRP,这些患者群体还存在巨大的未满足需求。
此前,MeiraGTx治疗因CNGB3基因突变导致的ACHM的A002疗法获得了FDA颁发的罕见儿科疾病药物(Rare Pediatric Disease)资格和孤儿药资格,并获得了欧洲药品管理局(EMA)颁发的优先药物(PRIME)资格和孤儿药资格。而治疗因RPGR突变导致的XLRP的AAV-RPGR疗法获得了FDA颁发的快速通道资格。
杨森研发部,全球心血管与代谢治疗负责人James List博士表示: “杨森很高兴能够增加创新疗法以扩大我们的产品组合,这些疗法有可能对目前尚无治疗方案的IRDs达到改善视力或防止疾病恶化导致失明的效果。我们期待与MeiraGTx合作开发这些资产并探索新的IRDs的潜在目标。
对这项新协议,杨森研发部全球负责人Mathai Mammen博士表示:“此次合作延续了杨森长期致力于解决全球患者未满足需求的传统。通过此次合作,我们期待深化我们在基因疗法方面的专业知识,为IRDs患者提供新的治疗方案。”(生物谷Bioon.com)

最近发表在开放获取期刊Genome Medicine 上的一项研究,报道了一种建立肝癌小鼠模型的新方法,即利用CRISPR/Cas9系统快速将癌症相关基因敲入小鼠的DNA中。
研究的通讯作者、麻省大学医学院RNA疗法研究所的王文说:“为了更好地理解肿瘤生物学、开展临床前研究以及为病人找到潜在的治疗策略,我们需要有效的肿瘤模型。现有用来敲入致癌基因以建立癌症模型的方法或效率很低,或难以控制敲入位置和敲入的拷贝数。CRISPR/Cas9使得在基因组特定位置——我们将这种位置称为目标基因座——插入大片段DNA成为可能,并且可应用于实验室的人类细胞以及小鼠中。我们研发出了一个新的系统——CRISPR-SONIC,可以在肝癌小鼠模型中灵活进行基因敲入,且准确率很高。”
为了解决癌症建模的现存问题、满足快速有效建立动物模型的需求,牟海伟、Deniz Ozata和Jordan L. Smith研发了这一新系统,利用CRISPR/Cas9基因编辑系统将致癌基因插入活小鼠的基因组。CRISPR/Cas9系统由一段向导RNA和Cas9酶组成。向导RNA是一种核苷酸短序列,它会附着到基因组中一个特定的目标DNA序列上。由于向导RNA同时也与Cas9酶相连接,它可以将Cas9导向目标DNA序列。然后Cas9会对DNA进行剪切,移除单个核苷酸/整个基因,或在DNA修复过程中插入核苷酸/整个基因。
作者在本研究中使用了具有2个向导RNA的CRISPR/Cas9,进行了一个三步骤的操作。首先,其中一个向导RNA和Cas9酶一起对目标DNA位置进行切割。第二步,另一个向导RNA和Cas9会对一个DNA环(即质粒供体)进行切割,第三步则是将已经被切割成线状的质粒环插入目标位置。
为了验证这一方法,作者利用这种方法将一个绿色荧光蛋白(GFP)基因插入了实验室培养的小鼠细胞中。这个基因在成功进入细胞DNA后,会产生一种在激光下可见的绿色荧光蛋白,从而表明基因成功插入并被表达。在实验室细胞中成功检验后,作者们在小鼠里测试了这种方法。
Deniz Ozata说:“我们观察到在使用了CRISPR-SONIC后,我们的样本中约有10%的肝脏细胞成功带上了GFP。这相对于之前那些方法大约0.5%的敲入效率来说,是一个巨大的提升。”
随后作者们对CRISPR-SONIC系统(包括向导RNA、Cas9酶以及一个致癌基因质粒)进行了测试,检验它是否可以用来为肝癌中发病率第二的肝内胆管癌进行小鼠建模。
牟海伟说:“导致这种癌症的最常见基因突变发生在抑癌基因TP53(所有病例中约占26-44%)和致癌基因KRAS(所有病例中约占16-18%)中。过往研究显示如果这两个突变一起发生,可以在小鼠模型中引发肝内胆管癌。我们用CRISPR-SONIC敲入了KRAS,同时加入另一个向导RNA敲除了抑癌基因TP53。这在癌症建模中非常重要,因为在p53存在的情况下KRAS无法导致肿瘤的形成。”
将CRISPR-SONIC注射进小鼠一个月后,作者观察到小鼠肝脏中形成了肿瘤。对照组小鼠在注射了向导RNA、Cas9和一段发光DNA片段(而非致癌基因)之后,并未罹患肿瘤。
Jordan L. Smith说:“我们用RAS致癌基因检测了我们的方法,但我们认为任何致癌基因片段都可以用这种方法定制癌症模型。我们展示了如何利用CRISPR-SONIC建立肝癌模型,但这种方法亦有应用到其他组织和器官的潜力。”
作者还展示了这种方法亦可用于建立生物发光癌症模型,这种模型可以让研究者们实时监测癌细胞的生长和癌症发展。(生物谷Bioon.com)
2019年8月20日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Alcoholism:Clinical and Experimental Research上的研究报告中,来自美国罗格斯大学的科学家们通过研究发现,孕期适量至大量饮酒或会改变胎儿机体DNA的表达。

图片来源:Syani Mukherjee/Rutgers University-New Brunswick
研究者Dipak K. Sarkar教授表示,这项研究中,我们能非常容易地检测到胎儿在产前暴露于酒精的情况,同时也有助于我们开发早期干预措施来改善其健康。此前研究人员通过研究发现,大量饮酒或会诱发成年人机体长期的遗传性改变,而本文研究中,研究人员通过研究在30名孕妇和359名儿童机体中发现了酒精诱导的DNA改变。
研究人员在适度至大量饮酒的孕妇和在胎儿期暴露于酒精的儿童机体中发现了两种基因的变化,即POMC基因和PER2基因,POMC基因能够调节机体的压力反应系统,而PER2基因则能够影响机体的生物钟;女性酗酒指的是每月在至少5次饮酒事件中每次至少喝4杯以上,而适度饮酒则定义为每次饮酒大约只喝3杯。研究者Sarkar说道,我们的研究结果或能帮助科学家们特殊的生物标志物来预测胎儿出生前暴露于酒精的风险。
据美国CDC数据显示,胎儿酒精谱系障碍包括身体或智力的残疾以及行为和学习问题等,目前并没有彻底的根治疗法,早期的干预手段往往能够改善儿童的发育,也就是说,女性在怀孕期间并没有已知的安全饮酒量。本文研究结果表明,婴儿在子宫内暴露于酒精中或会增加机体皮质醇的水平,而皮质醇是一种潜在有害的压力激素,其能够抑制机体免疫系统并诱发多种健康问题等。(生物谷Bioon.com)
原始出处:
Dipak K. Sarkar,Omkaram Gangisetty,Jeffrey R. Wozniak, et al. Persistent Changes in Stress Regulatory Genes in Pregnant Woman or a Child With Prenatal Alcohol Exposure, Alcoholism: Clinical and Experimental Research (2019). DOI:10.1111/acer.14148

2018年12月4日 讯 /生物谷BIOON/ –基因疗法在医学研究领域有着非常大的潜力,如果我们能够安全地改变自身的DNA,或许就能消除祖先遗传给我们的疾病。近日,一项刊登在国际杂志Science Advances上的研究报告中,来自特拉华大学的科学家们通过对微粒子进行工程化改造,使其能够运输基因调节物质进入造血干祖细胞(hematopoietic stem and progenitor cells),最终在基因疗法领域取得了新的研究突破。
图片来源:CC0 Public Domain
造血干祖细胞位于骨髓中,其能指挥血细胞的形成,文章中,研究人员描述了如何利用巨核细胞微粒来运输质粒DNA和小型RNAs进入到造血干细胞中,这种巨核细胞微粒能在血液中天然循环。研究人员所开发的新技术能用于治疗影响成千上万美国人的遗传性血液障碍,比如镰状细胞性贫血和地中海贫血,前者是一种影响红细胞形状的疾病,而后者则是一种干扰血红蛋白产生的疾病。
此外,研究人员所开发的技术还能帮助患者进行个体化的医学治疗,因为这些微粒能够针对不同个体开发产生并进行冷冻保存;研究者Papoutsakis说道,目前很多研究人员都尝试运输DNA或药物来靶向作用造血干细胞,造血干细胞是一种最佳的细胞,因为其能产生所有的血细胞。如果能够有效改变这些细胞,那么研究人员就有望攻克影响很多人健康的遗传缺陷性疾病。
研究者表示,此前研究人员开发了一些方法,在病毒的帮助下靶向作用这些干细胞运输特殊的遗传物质,而这些方法常常会给患者带来一些副作用,这项研究中,研究人员开发的新技术能利用在血液中循环的微粒(巨核细胞微粒)来发挥作用。研究者表示,他们能给这些微粒装载基因调节物质,同时这些微粒也能够借助其特性浸润到靶向性干细胞发挥作用。(生物谷Bioon.com)
原始出处:
Chen-Yuan Kao,Eleftherios T. Papoutsakis. Engineering human megakaryocytic microparticles for targeted delivery of nucleic acids to hematopoietic stem and progenitor cells, Science Advances (2018). DOI: 10.1126/sciadv.aau6762