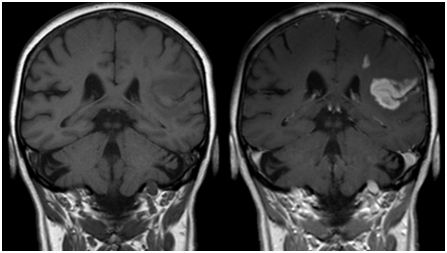
脑胶质瘤(glioblastoma,GBM)是一种常见的恶性脑瘤。传统的化疗和放疗无法清徐脑内肿瘤细胞,患者确诊后的中位存活时间为7-9个月。
如今,一种新疗法正在进入三期临床。
位于美国加州圣地亚哥的Tocagen公司,正在将其的肿瘤基因疗法进入三期临床,而且,公司已经获得200万美元的资金支持。
此前,Tocagen公司在美国,加拿大和以色列进行临床试验,并在韩国与当地的三星医学中心合作,治疗脑瘤患者。
Tocagen的基因疗法使用逆转录病毒复制载体(RRV),经过设计后将治疗基因选择性递送到癌细胞中。
Tocagen的新药Toca 5是肿瘤免疫疗法,组合了包括生物药Toca 511和小分子化疗药Toca FC。Tocagen即将进行的临床试验针对胶质瘤中最难治的一种,复发性恶化脑胶质瘤(HGG)。
Toca 511是逆转录病毒复制载体,编码前体药活化酶——胞嘧啶脱氨酶(CD)。 Toca FC是一种口服前药——5-氟胞嘧啶(5-FC),其作为抗癌药物是无活性的。5-FC可以高浓度转化为抗癌药物5-FU。
公司希望联合Toca 511和Toca FC能“直接杀死癌细胞和免疫抑制性骨髓细胞,导致针对癌症的免疫系统的激活”。
与此同时,10月29日,位于北京的北海康成在第二届医药创新与投资大会首次公布,其治疗脑胶质母细胞瘤的在研创新药CAN008的I期临床数据。
CAN008通过特异性地结合CD95配体阻断CD95信号转导通路,来抑制肿瘤细胞的生长以及迁移,同时可激活免疫细胞识别和杀伤肿瘤的功能,抑制肿瘤细胞的免疫逃逸。这项研究由CAN008联用替莫唑胺(TMZ)和放射治疗,治疗新诊断的GBM患者。
脑瘤是所有癌症中最致命的癌症之一,而且几乎没有可用的治疗选择。
还需193名患者
Tocagen公司表示,经过与美国食品药品管理局(FDA)的协商,将全力投入一项关键的后期试验,即立即加速Toca 5试验。
Toca 5已经处于第二期阶段的研究,但现在将被调整进入第三期临床试验。
但这意味着需要更多的病人:已经招募了187人,还需要193位HGG病人才能使总数达到380个,满足要求。
试验的主要终点将是总体生存率(Overall Survival, OS),之前的治疗方案已经表明在这类脑肿瘤中,这是一个难以到达的终点。
该公司表示,其主要终点假设对照组的存活时间中位数为9.8个月,而Toca 511和Toca 治疗组为14.3个月。
更多的患者意味着需要更多的钱,但是这项试验已经得到了FDA的帮助,FDA已经打算向Toca 5试验提供200万美元的孤儿药研发基金,四年内支付。这种疗法此前获得FDA的突破性疗法(Breakthrough Therapy)的资格。
Tocagen公司4月份首次公开上市,在纳斯达克上市。(生物谷Bioon.com)
 基因君官网
基因君官网