11月15日,Sangamo Therapeutics公司启动SB-913首例人体临床试验,尝试通过体内基因编辑技术彻底治愈遗传性疾病,本次受试者患有亨特氏综合征(Hunter syndrome)。若能取得成功,SB-913将会是疾病治疗史上有着里程碑意义的药物。本文将围绕本品进行简单介绍。
亨特氏综合征
鉴于首例受试者患有亨特氏综合征,那么在介绍在研药物SB-913之前,我们先来了解一下亨特氏综合征。相信对发病机制的了解将有助于理解药物设计和研发思路。
亨特氏综合征,又名II型粘多糖贮积症(mucopolysaccharidosis type II,MPS II),是一种罕见遗传病。发病者主要是男性,每10万到17万人中,就有一名患者。亨特氏综合征患者体内缺乏艾杜糖醛酸硫酸酯酶(iduronate-2-sulfatase,IDS)基因,该基因负责编码分解有毒碳水化合物的酶——艾杜糖醛酸硫酸酯酶。由于IDS基因缺失,导致细胞有毒代谢物累积聚集,继而损伤患者各脏器。大部分的患者在20岁之前因呼吸道阻塞、上呼吸道感染、或是心力衰竭过世。唯一缓解病情的手段是每周接受标准的酶替代疗法。尽管这种疗法能有效控制病情,但输入患者体内的IDS酶会很快减少,下降到无法检测的水平。而且酶替代疗法的开销在每人每年10万至40万美元。因此,患者们对创新疗法有着迫切的需求。
SB-913
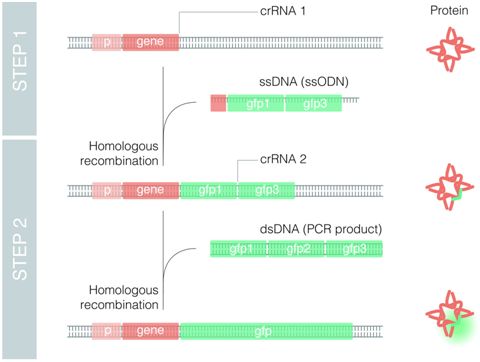
SB-913是Sangamo Therapeutics公司开发的一款用于治疗亨特氏综合征的基因药物,由腺相关病毒、锌指核酸酶(zinc finger nucleases,ZFN)和遗传性疾病缺失的IDS基因三部分组成。在治疗过程中,本品以输液的方式经静脉给药,输注时间控制在3小时。药物进入人体,腺相关病毒作为载体,携带两个锌指核酸酶和一个正常IDS基因直达人体肝细胞。到达肝部细胞内部后,锌指核酸酶特异地在肝细胞内启动,并识别、结合、切断内源性白蛋白基因位点(Endogenous albumin gene locus)。利用细胞天生的DNA修复机制,肝细胞可以把编码正常IDS的基因插入到该位点。至此,单个细胞完成修复(图1)。据介绍,仅需要1%的肝部细胞成功接收新的正常基因,那亨特氏综合征就能得到有效治疗。SB-913被设计为单次治疗策略,目的是为患者一生提供稳定、持续的IDS酶。SB-913已经获得FDA授予的孤儿药和罕见儿科病认定,也被FDA授予快速通道,用于治疗亨特氏综合征。FDA已经批准的一项名为CHAMPIONS(NCT03041324)的Ⅰ/Ⅱ期临床试验申请。按计划,该临床试验将对多达9名男性患者进行治疗,用于观察SB-913的安全性、耐受性及初步有效性。2017年11月15日,首例亨特氏综合征患者正式入组,在加州大学旧金山分校贝尼奥夫儿童医院接受SB-913药物治疗。
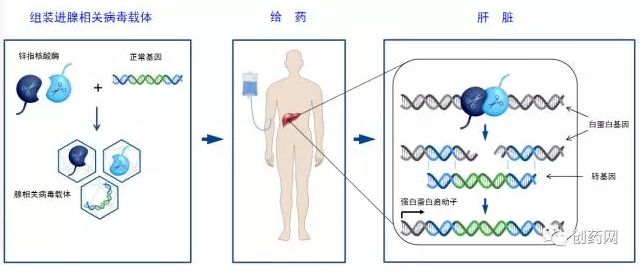
图1 SB-913工作流程示意图(Sangamo Therapeutics公司)
优势:和CAR-T等将患者细胞取出改造后回输、或是用腺相关病毒导入cDNA进行体内功能性蛋白表达的
基因治疗不同,SB-913的治疗更为彻底,将永久性改变患者基因组信息。
局限性:尽管基因编辑可以帮助患者从根源上解决病因,但疾病已造成的损伤无法逆转,因此,若能从儿童期进行干预治疗将最大程度的保证患者获益。针对这个目标,Sangamo therapeutics公司计划扩大该
临床试验的样本,在更多成人患者身上进行试验,最终实现在儿童患者身上医治的目的。此外,《科学》杂志报道指出,该基因疗法可能存在和酶替代疗法一样的困境——无法通过血脑屏障,这意味着,患者的脑损伤或许无法得到遏制。再者,在安全性上,虽然腺相关病毒被认为有较高安全性,但仍有发生无法预计副作用的可能。
根据相关报道,一个月后可以判断这次临床治疗是否有效,三个月后,该疗法的安全性和有效性将进一步得到确认。
锌指核酸酶基因编辑技术
SB-913使用了SangamoTherapeutics公司锌指核酸酶基因组编辑技术。何为锌指核酸酶?这是一类人工修饰的核酸内切酶,由DNA识别域和非特异性核酸内切酶构成,其中DNA识别域赋予特异性,在DNA特定位点结合。DNA识别域是由一系列 Cys2-His2锌指蛋白串联成的锌指蛋白组组成,可以识别一段特异的碱基序列,具有很强的特异性。与锌指蛋白组相连的非特异性核酸内切酶来自FokI羧基端96个氨基酸残基组成的DNA剪切域。FokI是来自海床黄杆菌的一种限制性内切酶,只在二聚体状态时才有酶切活性,每个FokI单体与一个锌指蛋白组相连构成一个锌指核酸酶,识别特定的位点,当两个识别位点相距恰当的距离时(6~8个碱基),两个单体锌指核酸酶相互作用产生酶切功能(图2)。从而达到 DNA 定点剪切的目的。之后通过非同源末端连接或同源重组修复断裂,将目标基因替换。
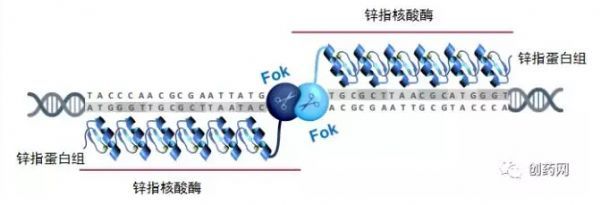
图2 锌指核酸酶二聚活化示意图(Sangamo Therapeutics公司)
锌指核酸酶是第一代基因编辑工具,与转录激活子样效应因子核酸酶(Transcription activator-like effector nulease , TALEN)和CRISPR/Cas9构成三大基因编辑技术。强两者比较常见,CRISPR/Cas9是近两年兴起。Sangamo therapeutics公司拥有锌指核酸酶的一系列关键专利,并开发了建立在锌指核酸酶基础上的基因疗法平台。Sangamo Therapeutics公司称,他们工程优化后的锌指核酸酶系统具有高的在靶(on-target)活性,约为80%,且未检测到脱靶(off-target)效应。
小 结
SB-913的临床研究结果值得期待,若成功将开创基因疗法一代先河。与原研公司Sangamo Therapeutics公司信心十足不同的是,行业内科研人员也对产品的安全性表示担忧,特别是发生脱靶,剪错位点,导致未曾预料到的基因损伤,甚至细胞癌变的严重后果。此外,科研人员不看好SB-913对脑部的治疗效果,如果是这样,那么患者的生活质量将会受到很大影响,产品的优越性打了一个折扣。SB-913究竟如何?让我们拭目以待!
参考资料:
1. http://www.sciencemag.org/news/2017/11/human-has-been-injected-gene-editing-tools-cure-his-disabling-disease-here-s-what-you
2. http://www.thepaper.cn/newsDetail_forward_1868087
3. 钟强, 赵书红. 锌指蛋白核酸酶的作用原理及其应用. 遗传. 2011年2月, 33(2): 123-130.
4. Beumer K, Bhattacharyya G, Bibikova M,et al. Efficient gene targeting in Drosophila with zinc-finger nucleases. Genetics, 2006 April,172(4):2391-2403.
5. Sandy M. Sangamo Therapeutics Corporate Presentation. August 2017.
6. Desjarlais JR, Berg JM. Use of a zinc-finger consensus sequence framework and specificity rules to design specific DNA binding proteins. PNAS, 1993, 90(6): 2256–2260.

 基因君官网
基因君官网