2018年10月6日/生物谷BIOON/—在一项新的研究中,一个由全球17个实验室组成的联盟提供的结果与一项高度引用的研究[1]—它描述了一种利用CRISPR构建条件性基因敲除小鼠的技术—相矛盾。这项新的研究表明与那项原始的研究[1]相比,这种技术的效率要低得多。相关研究结果[2]于2018年9月1日发表在预印本服务器bioRxiv上,论文标题为“Re-Evaluating One-step Generation of Mice Carrying Conditional Alleles by CRISPR-Cas9-Mediated Genome Editing Technology”。
这项新研究的结果指出了那项原始研究的局限性,后者取得的成功似乎被归因为剔除杂合小鼠品系中的特定基因。根据谷歌学者(Google Scholar)网站的统计,那项原始研究被引用了将近1000次。它的主要作者坚持认为他的方法是强有力的。
图片来自bioRxiv, doi:10.1101/393231。
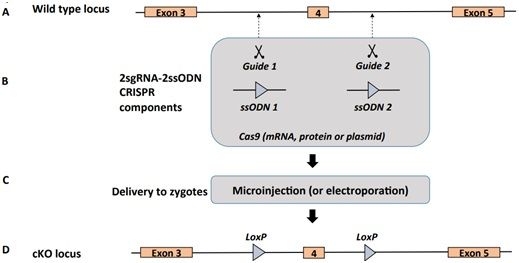
在美国怀特黑德生物医学研究所遗传学家Rudolf Jaenisch及其同事们在2013年发表那项原始研究[1]之前,胚胎干细胞被用来制备条件性基因敲除小鼠—在需要缺失一个基因的情形下,动物的基因经改造后被关闭—这个过程可能需要数年时间,成功率仅为1%。CRISPR技术提供一站式服务,它所构建出的条件性基因敲除小鼠的成功率为16%。通过将CRISPR复合物注射到受精卵中,Jaenisch团队成功地将一个待剔除的基因放置在两个LoxP位点之间,从而允许这个基因受到条件性调节。
美国康奈尔大学干细胞与转基因核心机构主任John Schimenti说(未参与这两项研究),“Jaenisch发表的那项最初研究是一个里程碑,它当然证实了你能够在特定的位点上获得非常高效的突变。”
条件性基因敲除小鼠在生物医学研究中是非常重要的,这是因为它们让科学家们在有机体的特定组织中以及在发育期间的特定时间剔除必需基因。尽管Jaenisch开发的这种方法很有前景,但是试图利用该技术构建出条件性基因敲除小鼠的研究团队并没有那么成功。
Schimenti说,“所有试图利用他们最初提出的这种方法制备出的floxed等位基因(译者注:在遗传学中,floxed是‘flanked by LoxP’的缩写,指的是将一个等位基因以三明治的形式放置在两个LoxP位点之间。在Cre重组酶的催化下,两个LoxP位点发生重组,从而剔除这两个LoxP位点之间的等位基因。)通常都会遭遇失败。”Schiment已在康奈尔大学干细胞与转基因核心机构观察到与这项新的研究提及到的“相同的问题”。
Schimenti指出,Jaenisch开发的这种方法通常会导致脱靶突变,缺失或者无法以正确的方向插入两个LoxP位点。他说,“这一点在科学界中得到普遍认可,简言之,取得与Jaenisch团队报道的成功率相相近的结果是非常困难的。”
在学术会议和其他地方,一个紧密结合的研究团体针对其他实验室利用这种技术所面临的挑战开展的讨论使得主管澳大利亚国立大学转基因机构的Gaetan Burgio和他的同事们试图确定出了什么问题。
首先,三个实验室在不同的小鼠品系中复制了这项靶向同一个基因的原始实验,但没有取得成功。接下来,包括这三个实验室在内的17个实验室在5种不同的小鼠品系中针对小鼠基因组中的总共56个基因和2个基因间区域独立地重复这项实验。来自所有这些实验室的数据集经合并后包括17887个显微注射或电穿孔的小鼠受精卵和产生的1718只活小鼠,其中仅15只小鼠具有条件性对照所需的两个插入的LoxP位点。在所有接受测试的小鼠中,观察到脱靶的缺失或突变代替LoxP位点的正确插入。
与那项原始研究在小鼠中获得条件性敲除等位基因的效率为16%相比,Burgio和其他人的成功率仅为0.87%。Burgio说,“这种方法的成功率. . .相当于使用胚胎干细胞的经典方法。”
这17个实验室旨在找出导致成功地构建出条件性基因敲除小鼠的潜在因素,结果发现同时插入两个LoxP位点对这种技术的成功是至关重要的。
Jaenisch认为这两项研究中使用的小鼠品系之间的差异是症结之所在,也是这两项研究之间存在的很大差异的根本原因。Jaenisch对这项新研究的质量提出了质疑,“我不得不认为这些数据是不可靠的”。
Schimenti对此表示赞同,认为在重复那项原始研究时应考虑遗传背景。“我认为这是这项发表在bioRxiv上的研究存在的缺陷—如果他们测试Jaenisch的研究结果,他们应该使用完全相同类型的动物。”不过,Burgio和Schimenti提出一点:相比于这项新的研究中使用的小鼠,Jaenisch使用的小鼠品系并不常见。
Schimenti还提出了Jaenisch取得的16%成功率可能代表着那项原始研究中使用的特定小鼠品系中的单个基因座。Schimenti说,“我认为很明显这是一个非常有问题的技术。还需要有一个解决方法。”(生物谷 Bioon.com)
原始出处:
Study Challenges CRISPR Method for Making Conditional Knockout Mice
参考资料:
1.Hui Yang,Haoyi Wang,Chikdu S. Shivalila et al. One-Step Generation of Mice Carrying Reporter and Conditional Alleles by CRISPR/Cas-Mediated Genome Engineering. Cell, 12 September 2013, 154(6):1370-1379, doi:10.1016/j.cell.2013.08.022
2.Channabasavaiah Gurumurthy, Rolen Quadros, John Adams Jr. et al. Re-Evaluating One-step Generation of Mice Carrying Conditional Alleles by CRISPR-Cas9-Mediated Genome Editing Technology. bioRxiv, Published Online: 1 September 2018, doi:10.1101/393231

 基因君官网
基因君官网