2018年2月27日/生物谷BIOON/—当蛋白Ataxin1在神经元中堆积时,它会导致一种被称作脊髓小脑共济失调1型(spinocerebellar ataxia type 1, SCA1)的神经系统疾病,这种疾病的特征是渐进性的平衡问题。Ataxin1因发生突变而堆积着,这种突变产生这种蛋白的一种非常长的异常版本,并且这种异常的蛋白版本在神经元内形成团块。然而,针对动物模型的研究已表明具有正常长度的Ataxin1堆积也能够导致类似于SCA1的神经变性。在这种情况下,问题在于调节Ataxin1产生的一个被称作Pumilio1的基因发生突变,从而导致正常的Ataxin1过量产生。
如今,在一项新的研究中,受到动物模型研究结果的启发,一个国际研究团队探究了类似的现象在人体发生的可能性。他们报道人PUMILIO1基因发生的突变也会导致与SCA1相类似的病症。这些发现有助更好地理解神经疾病的遗传基础,并且提示着鉴定蛋白调节物将会筛选出新的候选致病性基因。相关研究结果发表在2018年2月22日的Cell期刊上,论文标题为“A Mild PUM1 Mutation Is Associated with Adult-Onset Ataxia, whereas Haploinsufficiency Causes Developmental Delay and Seizures”。
论文第一作者、贝勒医学院Huda Zoghbi博士实验室博士后研究员Vincenzo Gennarino博士说,“在这项研究中,我们探究了我们在小鼠体内的发现—作为Ataxin1的一种调节物,Pumilio1发生的突变导致类似于SCA1的神经疾病—适用于人体的可能性。”
单一蛋白的数量能够影响疾病的临床表现
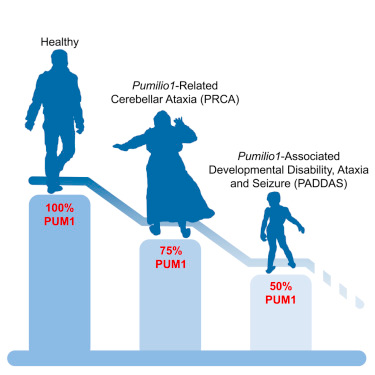
这些研究人员开始在世界各地的大型基因组数据库中寻找具有与SCA1相类似症状的患者。他们鉴定出15名PUMILIO1基因发生不同突变的患者,他们将这些患者分为两组。在一组中,PUMILIO1蛋白的数量大约是未患上这种疾病的人的一半。这组患者患上这种疾病的一种严重形式,并且这种疾病形式早在5个月至1岁之间就已开始发生。这些儿童出现癫痫发作、共济失调、运动协调性差和发育迟缓等问题。在另一组患者中,PUMILIO1的数量是未患上这种疾病的人的75%。这组患者在40或50多岁时出现较为温和的共济失调形式。
这项研究表明同一个基因发生的突变基于对它表达的蛋白产物的破坏程度能够导致显著不同的神经问题。
Gennarino说,“这些发现是非常激动人心的。我们了解到这种疾病的症状依据PUMILIO1蛋白水平的不同而存在着差异。我们过去认为某些蛋白水平的适度变化,比如降低25%,不会对个人产生不利的影响。就这项研究而言,我们发现事实并非如此。从临床角度来看,这是一个重要的发现,PUMILIO1或其他蛋白的水平下降25%的人可能仅在晚年才会出现症状。”
这些发现也对阿尔茨海默病和肌萎缩性脊髓侧索硬化症等其他的神经退行性疾病产生影响。鉴定参与这些疾病的蛋白调节物将提供一个与它们存在潜在关联性的候选基因列表,并且为开发新的治疗策略开辟新的途径。(生物谷 Bioon.com)
参考资料:
Vincenzo A. Gennarino, Elizabeth E. Palmer, Laura M. McDonell et al. A Mild PUM1 Mutation Is Associated with Adult-Onset Ataxia, whereas Haploinsufficiency Causes Developmental Delay and Seizures. Cell, 22 Feb 2018, 172(5):924–936, doi:10.1016/j.cell.2018.02.006
 基因君官网
基因君官网