
资讯出处:Scientists link pancreatic cancer survival to four genes

资讯出处:Scientists link pancreatic cancer survival to four genes

11月3日,中国科学院上海生命科学研究院(人口健康领域)计算生物学研究所徐书华课题组的研究成果,以PGG.Population: a database for understanding genomic diversity and genetic ancestry of human populations为题,在线发表在《核酸研究》上。该研究分析了涵盖全球范围107个国家的356个人类族群的基因组多样性和祖源信息,并发布了开放获取的专门数据库——PGG.Population(群体基因组学·族群)。PGG.Population是迄今唯一在基因组水平专门解析人类族群遗传关系和祖源信息的公开数据库,也是目前收集族群数量最大的群体基因组数据库,为研究人员、临床医生及学生和公众理解不同人群的遗传背景提供查询和分析平台。
人类族群多样性的形成是迁移、隔离、分化、再接触和交流的复杂演化过程。同时,长期对特定环境的适应或能影响特定的性状以及基因组局部区域的多样性变化。相对来讲,人群的基因组多样性在很大程度上决定了其表型多样性——这也是族群特异性的表型可以世代传承的原因。因此,要真正理解人类不同族群在肤色、体质以及疾病等性状上的差异,最终需要回到基因组、追溯人群的演化历程。众多大型国际计划(比如人类单倍体型图计划和千人基因组计划)以及我国此前完成的各类全基因组关联研究(GWAS)集中关注常见主体人群,而对各地少数族群(大多是土着人群)的研究较为缺乏。部分研究人员逐渐意识到,在一个人群研究中的困惑,往往在另一个人群的研究中找到答案,例如科研人员对比青藏高原人群的基因组,了解到为何平原人群无法像藏族人那样舒适地生活在高原上。专家认为,这就是多样性的魅力,也是进化留给我们的财富。
PGG.Population正是在这样的大背景下建立起来。研究人员通过测序或收集众多人类群体基因组研究数据,对每个族群的基因组重新整合与分析(包括人群的地理语言归属等基本信息、Y染色体与线粒体谱系、群体间亲缘关系、群体遗传结构、遗传混合以及自然选择印记等),并建立数据库,以开放获取的方式向公众展示每个族群的基因组多样性与祖源信息。目前,该数据库包括7122个个体的基因组数据,覆盖107个国家的356个族群,每个族群都有自己的“故事”。该数据库以理解每个人群的基因组多样性与遗传背景为主,对其他研究领域也具有重要的学术意义和应用价值,人类群体基因组数据库建设任重道远。全世界有2000多个族群,而该数据库目前只包括世界族群的1/6。课题组正在收集或产生更多的来自不同族群基因组数据,以覆盖更多的族群,以期用于全面探索亚洲人群尤其是东亚、东南亚族群的演化历史和自然选择等遗传和演化问题。同时,数据库可供遗传学、语言学、体质人类学、医学等行业参考和使用,应用于生物医学等多个领域的研究。此外,科研人员希望公众通过访问和查询该数据库,对人类基因组多样性和人群祖源等方面的知识和信息有更广泛和深入的理解。
研究工作得到了中科院战略性先导科技专项(B类)、国家自然科学基金委重大研究计划及国家杰出青年科学基金、中科院青年促进会、上海市科委等的资助,并得到国家遗传与发育协同创新中心支持。(生物谷Bioon.com)
今天,《自然医学》杂志上刊登了上海交通大学瑞金医院和华大基因共同完成的一项研究[1]!研究人员以中国的汉族年轻人为研究对象,确定了一个能抑制肥胖的肠道微生物——多形拟杆菌,还研究了其对代谢产物氨基酸水平的影响。研究的通讯作者为瑞金医院的宁光院士、王卫庆教授和华大基因的Karsten Kristiansen教授。

新的研究让大家感到非常激动,为什么呢?因为我们知道,肠道微生物的组成和变化会受到许多因素的影响,比如年龄和饮食,然而还有一个平时可能被大家所忽略的因素就是种族[2]!因此,这项以中国汉族年轻人为样本的研究,对我国肠道微生物与肥胖研究领域来说有着十分重要的意义。
肠道微生物与肥胖之间存在着千丝万缕的联系
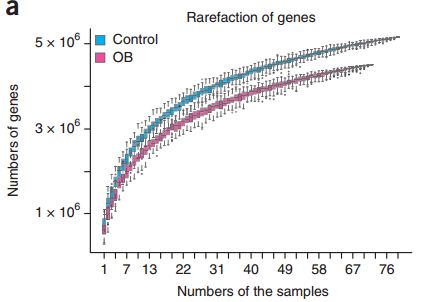
测序结果显示,与过去在欧洲人群中开展的类似研究[3,4]相同,肥胖志愿者的肠道微生物多样性和基因数量都相对较低。但是,与研究中丹麦人群和法国人群不同,我们的志愿者的细菌基因丰度只有一个最大值,呈现出绝对优势,而丹麦人群与法国人群均有两个最大值,这也说明,不同的种族人群间,肠道微生物是存在一定差异的。
通过分析,研究人员找到了350524个与肥胖相关的基因,鉴定出它们所对应的微生物。研究人员发现,肥胖人群和苗条人群的肠道微生物确实存在巨大差异。
而且研究发现,之所以肥胖志愿者的拟杆菌属细菌大量减少,是因为代谢产物芳香族氨基酸(AAA)以及支链氨基酸(BCAA)的增加。这两类氨基酸在过去的研究中已经被证明与II型糖尿病[7]的发生发展有关。
在这次研究中,研究人员共分析了148种氨基酸,发现肥胖人群中谷氨酸的含量非常高,与苗条人群的差异也最大,而且在肥胖人群中,它的含量与多形拟杆菌的数量呈反比。
于是研究人员进行了小鼠实验,希望用它们来直接证明多形拟杆菌与肥胖的关系。他们给正常饮食的小鼠移植了多形拟杆菌,发现小鼠的总脂肪量减少、肌肉量增加;类似的现象也发生在高脂饮食的小鼠中,它们体重增长的速度减慢,肥胖的倾向也不那么明显了。
而且有趣的是,与移植了灭活的多形拟杆菌和磷酸缓冲液(空白对照)的小鼠相比,活性拟杆菌组小鼠脂肪细胞体积明显减小!这与过去科学家发现的“肥胖者之所以胖,一部分是因为他们体内的脂肪细胞‘胖’(另外脂肪细胞的数量也会有一定影响)”的结论是一致的[8]。当然,这些小鼠体内参与脂肪合成、炎症因子产生的基因的表达量也都明显下降。
磷酸缓冲液(PBS)、灭活的多形拟杆菌(KBT)和保有活性的多形拟杆菌(LBT)脂肪细胞大小的对比
最后,研究还是回归到人的身上。研究人员又找到了23名接受过袖状胃切除术(sleeve gastrectomy)的志愿者,袖状胃切除术是代谢手术中的一种,通过腹腔镜把胃大弯切除,减小胃的体积,主要用于治疗肥胖和II型糖尿病。研究人员收集了他们在刚刚接受完手术、术后1个月和3个月的粪便样本,对肠道微生物以及代谢物等等的变化进行了分析。
袖状胃切除术
这个以我国汉族年轻人为样本的“本土化”研究其实也是“精准医学”的一个缩影,不同的遗传背景和环境以及饮食习惯塑造了不同的肠道菌群。所以基于这个研究,未来,科学家们会不会开发出针对中国肥胖人群的肠道微生物制剂呢?甚至可能这一思路对其他疾病的研究也会产生影响,改变许多疾病的治疗。忍不住要感叹一句,肠道微生物果然是“一座神秘的宝矿”啊!
[1] Ruixin Liu, et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention. Nature Medicine (2017) doi:10.1038/nm.4358.
[2] Mueller, S. et al. Differences in fecal microbiota in different European study populations in relation to age, gender and country: a cross-sectional study. appl. Environ. Microbiol. 72, 1027–1033 (2006).
[3] Le Chatelier, E. et al. Richness of human gut microbiome correlates with metabolic markers. Nature 500, 541–546 (2013)
[4] Cotillard, A. et al. Dietary intervention impact on gut microbial gene richness. Nature 500, 585–588 (2013)
[5] Qin, J. et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 490, 55–60 (2012).
[6] Peterson, C.T., Sharma, V., Elmén, L. & Peterson, S.N. Immune homeostasis, dysbiosis and therapeutic modulation of the gut microbiota. Clin. Exp. Immunol. 179, 363–377 (2015).
[7] Wang, T.J. et al. Metabolite profiles and the risk of developing diabetes. Nat. Med. 17, 448–453 (2011).
[8] Hirsch, J. and B. Batchelor, Adipose tissue cellularity in human obesity. Clin Endocrinol Metab, 1976. 5(2): p. 299-311.
[9] Bunyan, J., Murrell, E.A. & Shah, P.P. The induction of obesity in rodents by means of monosodium glutamate. Br. J. Nutr. 35, 25–39 (1976).
今日,业内传来一条重磅新闻——美国FDA宣布批准Spark Therapeutics的创新基因疗法Luxturna(voretigene neparvovec-rzyl)上市,治疗患有特定遗传性眼疾的儿童和成人患者。Luxturna也是首款在美国获批、靶向特定基因突变的“直接给药型”基因疗法。
今日获批的Luxturna有望治疗一类叫做遗传性视网膜营养不良(hereditary retinal dystrophies)的遗传病。在人体内,超过220条基因里的突变,都可能会导致疾病出现,并最终使患者出现进展性的视觉下降。其中,由RPE65基因等位突变引起的疾病在美国大约影响了1000到2000人。在人体内,RPE65基因编码了对正常视力起重要作用的一种酶。因此,基因突变引起的RPE65酶水平下降或缺失会让患者的视力受损,最终导致失明。

▲Luxturna是治疗遗传性视网膜疾病的领先疗法(图片来源:Spark Therapeutics官方网站)
基因疗法的横空出世让原本无药可治的遗传病患者看到了曙光。由Spark带来的Luxturna利用腺相关病毒技术,能将健康的RPE65基因直接引入到视网膜细胞中,让它们产生正常的RPE65酶,恢复患者的视力。在有41名患者参与的临床试验中,这一疗法的效果与安全性得到了有效的验证:接受治疗的患者在暗光下避开障碍的能力得到了显著提高,副作用也在可控范围内。先前,Luxturna已经获得了美国FDA颁发的优先审评资格和突破性疗法认定。今日的获批,也是对这款突破性疗法的最佳认可。
“Luxturna的批准打开了一扇通往基因疗法无限潜力的新大门,”美国FDA生物制剂评估与研究中心(CBER)的负责人Peter Marks博士说道:“RPE65基因等位突变相关的遗传性视网膜营养不良患者现在有了改善视力的新方法。之前,这样的希望相当渺茫。”
2017年可以说是基因疗法的元年。除了3款获美国FDA批准的基因疗法外,不少其他基因疗法也正在积极研发之中,并给一名又一名患者带来了生的希望。我们期待能在未来听到更多基因疗法的好消息。
2018年1月4日/基因宝jiyinbao.com/—在一项新的研究中,来自美国哥伦比亚大学医学中心(CUMC)的研究人员发现两个相邻基因的融合能够导致线粒体过度运转和增加细胞疯狂生长所需的燃料数量,从而导致癌症产生。他们也发现在人癌细胞和一种脑癌类型的小鼠模型中,靶向这个新鉴定出的癌症通路的药物能够阻止肿瘤生长。相关研究结果于2018年1月3日在线发表在Nature期刊上,论文标题为“A metabolic function of FGFR3-TACC3 gene fusions in cancer”。
胶质母细胞瘤是最为常见的和侵袭性的原发性脑癌。在2012年发表在Science期刊上的一项研究(Science, doi:10.1126/science.1220834)中,这个CUMC研究小组已发现一些胶质母细胞瘤病例是由两个基因FGFR3和TACC3融合在一起导致的。在当时,人们曾认为这种基因融合仅限于一部分脑瘤,在美国每年影响大约300名患者。
然而从那时起,其他的研究人员已观察到这种相同的基因融合存在于一部分肺癌、食管癌、乳腺癌、头颈癌、宫颈癌和膀胱癌中,总体上影响着成千上万的癌症患者。论文共同通信作者、CUMC癌症遗传学研究所神经病学教授、病理学与细胞生物学教授Antonio Iavarone博士说,“这可能是人类癌症中唯一最为常见的基因融合。我们想要确定FGFR3-TACC3融合如何诱导和维持癌症,这样我们就可能鉴定出药物治疗的新靶标。”
长期以来,人们已在癌症中观察到线粒体变化,但是仅在近期才发现线粒体活性和细胞代谢与某些癌症存在关联。然而,基因突变改变线粒体活性和促进肿瘤生长的机制是未知的。
在当前的这项研究中,这些研究人员比较了携带着FGFR3-TACC3和未携带着FGFR3-TACC3的癌细胞中的上千个基因的活性。他们发现这种融合极大地增加线粒体的数量和增加它们的活性。鉴于癌细胞需要大量的能量才能快速地分裂和生长,当线粒体的活性增加时,这些癌细胞就能够茁壮生长。
通过采用多种实验技术,这些研究人员确定这种基因融合启动了一系列增强线粒体活性的事件。首先,FGFR3-TACC3激活一种被称作PIN4的蛋白。一旦遭受激活,PIN4迁移到过氧化物酶体中。作为一种细胞器,过氧化物酶体将脂肪降解为增加线粒体活性的物质。受到激活的PIN4触发产生的过氧化物酶体数量增加了4~5倍,从而释放大量的氧化剂。最后,这些氧化剂诱导PGC1α产生。作为线粒体代谢的一种关键的调控物,PGC1α增加线粒体的活性和能量产生。
论文共同通信作者、CUMC癌症遗传学研究所细胞生物学教授Anna Lasorella博士说,“我们的研究提供了癌基因如何激活线粒体代谢的第一个线索,这是癌症研究领域长期存在的一个至关重要的问题,并且提供了过氧化物酶体参与癌症产生的第一个直接的证据。这给我们如何能够破坏癌症的燃料供应提供了新的见解。”
在另一项实验中,利用线粒体抑制剂处理含有FGFR3-TACC3的人脑癌细胞会阻断癌细胞中的能量产生,并且显著地减缓肿瘤生长。这种效果也在含有这种基因融合的人脑癌小鼠模型中观察到。
Iavarone博士猜测一种双重治疗方法可能是FGFR3-TACC3肿瘤患者所需要的。在之前的研究中,这些研究人员已发现当在胶质母细胞瘤小鼠模型中进行测试时,抑制FGFR3激酶的药物会增加存活率。FGFR3激酶协助这种融合基因产生的蛋白发挥功能。
如今,作为这篇论文的一名共同作者,法国巴黎萨伯特慈善医院(Pitié Salpêtrière Hospital)的Marc Sanson博士在一项临床试验中,正在复发性胶质母细胞瘤患者中测试这些药物。Iavarone博士说,“抑制活性激酶的药物已在一些癌症中接受过测试,并且获得了令人鼓舞的结果。但是,不可避免的是,它们对这些药物产生耐药性,而且这些肿瘤复发了。然而,直接地靶向线粒体代谢和FGFR3-TACC3就有可能阻止这种耐药性产生和肿瘤复发。”
基于这项研究的发现,这些研究人员如今正在考虑往参加这项临床试验的患者的治疗药物中添加线粒体抑制剂的可能性。
这些研究人员当前正在人癌细胞和动物模型中测试这种双重治疗方法。(生物谷 Bioon.com)
参考资料:
Véronique Frattini, Stefano M. Pagnotta, Tala, Jerry J. Fan et al. A metabolic function of FGFR3-TACC3 gene fusions in cancer. Nature, Published online:03 January 2018, doi:10.1038/nature25171






2012年,来自美国和奥地利的科学家共同改进了CRISPR-Cas9系统,并在其发表的研究论文中预示:CRISPR可作为一种高效而特异的RNA介导的基因编辑工具。2013年,张锋等人利用CRISPR进行哺乳动物细胞的基因编辑,开启了CRISPR作为可编程的基因编辑工具的新纪元。
作为CRISPR技术的领先者,美国尚未批准将其应用于人体试验,不过中国对此的监管限制却较少,也因此成为了第一个将CRISPR用于人体试验的国家。
2016年7月,四川大学华西医院肿瘤学教授卢铀团队宣布将开展“全球第一例”CRISPR–Cas9基因编辑人体临床试验,同年10月28日,首名癌症患者接受了经CRISPR技术改造的T细胞治疗5;又有报道称,早在2015年,位于安徽合肥的解放军第105医院就已经开始了CRISPR人体试验。
2017年3月,杭州市肿瘤医院院长吴式琇也开始尝试利用基因编辑技术治疗癌症患者。1月21日,美国《华尔街日报》(WallStreet Journal)发表长文,评论了中国率先开始基因编辑人体试验之举,其中对吴式琇的试验进行了报道。
据了解,吴式琇的团队抽取食管癌患者的血液标本,通过高铁将其运送到安徽柯顿生物科技有限公司实验室,运用CRISPR技术将血液里的免疫细胞中影响肿瘤杀伤作用的基因删除,再将其回输入患者体内,希望被修饰过免疫细胞能够杀死肿瘤细胞,从而达到治疗目的。
此次试验由杭州市肿瘤医院的伦理委员会(Ethics Committee)审核通过,其成员由医院任命,包括该院几名医生、一名律师和一名患者。委员会只用一下午就批准了试验,而因为我国卫计委已授权各医院伦理委员会对临床试验进行审核并评估风险,吴式琇无需再通过卫计委相关部门的审核。
相比之下,美国计划开展基因编辑人体试验的时间其实并不算晚,但审核流程却更为严格。研究人员必须首先获得美国食品药品监督管理局(FDA)批准,才能进行人体试验。
为获得所在医院人体试验评估委员会和FDA批准,美国首个基因编辑人体试验的主要负责人、宾夕法尼亚大学CRISPR研究团队首席科学家Carl June,在2016年首先尝试获得美国国立卫生研究院(NIH)顾问委员会的评估。委员会对其提出了一系列要求,例如将实验描述为“基因转移(gene transfer)”而非“基因治疗(gene therapy)”,确保患者知晓这只是一项试验而非治疗,进行各种测试观察CRISPR的脱靶现象等。虽然最终得到了NIH的批准,June的团队又花了一年时间与FDA讨论,向其提供信息并答疑解惑。
据悉,目前他们正在等待FDA的最终审批,预计最早于本月获批。然而这并不是结束,即使试验开始,宾大仍将面临比吴式琇更多更严格的标准。
在受试者知情同意方面,宾大研究人员必须使用由FDA和医院评估委员会审核通过的知情同意书,而吴式琇的同意书只简略提到了基因工程,也并未向患者详细说明其使用的只是试验性工具。柯顿生物科技的相关人员称,中国患者也会签署同意书,但基本上是听医生的。
对于试验过程中出现的死亡等严重不良事件,FDA发言人表示,无论死亡是否与试验相关,试验开展方都必须上报FDA,而我国卫计委则要求研究人员向医院伦理委员会报告不良事件。目前,吴式琇的试验已有例死亡病例,而他表示,患者死亡由其所患疾病所致,与试验本身无关,因此无需上报。
此外,新药I期临床试验的主要目的之一是初步评估药物的人体安全性。June称,宾大将先在一位患者身上测试CRISPR,等待一个月确保未发生不良反应后再在另两位患者身上测试。吴式琇则认为,挽救患者生命是最重要的,目前他已编辑了10余位癌症患者的基因,未来计划在更多患者身上进行测试。
目前,美国国家医学图书馆数据库已经记录了中国的9次试验,而实际数字可能不止如此。
中国正力争使国内产业走上国际舞台,基因编辑更是被列入2016年制定的国家五年计划中。June也表示,在将CRISPR等西方国家开创的医疗技术加以应用方面,中国可能超过美国,美国将来可能失去在生物医药领域的领先位置;“中美之间关于CRISPR的对垒,也许会触发20世纪50年代时美苏航天技术竞赛那样的生物竞赛,而这次将会是2.0版本。”
对此,《华尔街日报》评论道,虽然各国对于人体试验的政策可能存在差异,但中国敢为人先的尝试着实让西方科学家对这一全新工具的安全性感到担忧,他们并不认为美国应该放松对这方面的监管。芝加哥大学神学院(Universityof Chicago Divinity School)院长、生物伦理学家Laurie Zoloth接受采访时也说道,希望各国制定统一标准,共享试验结果和伦理准则。
在基因编辑这一尚未成熟的领域中,目前还较难在快速推进与保证安全性之间找到理想的平衡点。近日,斯坦福大学Matthew H. Porteus教授团队发现,在大部分人体内原本就存在针对Cas9蛋白的体液免疫和细胞免疫,CRISPR-Cas9技术在人体中应用有可能引发严重的免疫反应。
吴式琇同意CRISPR技术是一把双刃剑,但他同时说道,当别人更多关注潜在风险时,他们看到的是潜在疗效。生死一线的晚期癌症患者无法让他将时间过多用在各种测试上,“如果不尝试一下,就永远无法知道结果。”
在解放军105医院和此次杭州市肿瘤医院的试验中,相关人员均表示部分患者的病情有所缓解,但截止到目前为止,我国各项基因编辑人体试验尚未公布其结果。
中美均投重金,全球6家公司上市,下一个千亿市场正处爆发前夜
2018年1月,美国宣布将在未来6年出资1.9亿美元,支持体细胞基因编辑研究,以开发安全有效的基因编辑工具,治疗更多人类疾病。美国不惜重金发展基因编辑技术,显然对该技术十分看好。
近两年,中国在精准医疗领域政策发布也非常密集,对基因编辑等技术给予大量支持。比如将精准医疗上升为国家战略,计划在2030年投入600亿元。2017 年 4 月印发《“十三五”生物技术创新专项规划》,点明发展“新一代基因操作技术”。
具体要发展精确或定量化的新型基因操作技术,真核生物细胞的基因(组)编辑技术,在工业生产和环境保护等方面具重要应用价值的新型微生物基因重组技术,促进多种基因(组)编辑手段的融合,重视基因操作的效率和通量,提高易操作性,降低脱靶性,扩大应用范围。
据中商产业研究院最新报告,2016至2020年全球精准医疗市场规模将以每年15%的速率增长。预计 2020 年全球精准医疗市场规模将破千亿,达到 1050 亿美元,“基因剪刀”将是撬动千亿级大市场的一把钥匙。
全球发展如火如荼
贝壳社梳理了国外基因编辑相关企业(如下表),从表中能看出17家公司中有6家已经上市,且大多总部设在美国,可见美国在基因编辑技术领域仍走在前列。各家所采用的技术也几乎涵盖了三代编辑技术,但仍以CRISPR为主,另外腺病毒或腺相关病毒技术也较为普遍,其次CAR-T联合CRISPR技术的出现,表明联合治疗法将成为一种新趋势。最后,河北科技大学的韩春雨副教授声称发现一种不同于CRISPR的新核酸酶Argonaute,虽然引发全球关注,也吸引丹麦诺维信谋求合作,但该发现至今未被认可,甚至疑为学术造假。
中国成美国强劲对手
虽然美国基因编辑水平位于世界前列,但中国在该领域的技术同样世界领先,美媒甚至称“中国基因编辑技术发展令美国望尘莫及”。2018年1月23日媒体报道,杭州肿瘤医院院长兼肿瘤医生吴式琇从去年3月起,就尝试用CRISPR-Cas9技术治疗食道癌患者。
中国作为全球第一个将CRISPR用于人体试验的国家,迄今至少有86名中国患者接受了基因编辑治疗。而美国之所以丧失领先优势的主要原因是美国监管更严,需要通过种种风险评估与安全检查,在尽可能保证患者安全的前提下,才能实施基因编辑治疗。毫无疑问,中国将成为美国基因编辑技术的强劲对手。
不完全统计,中国涉及基因编辑的企业有21家,大多数以技术支持和服务外包为主,客户来源医疗机构、企业、科研院所与高校等,可见基因编辑技术本身在国内发展较为成熟,接受度较高。(生物谷Bioon.com)