当植物育种者想要改善农作物的性状时,他们会转而寻求世界各地基因库中储存的生物多样性。但是由于资金短缺,这些储存种子和其他植物组织的重要仓库通常状况很差。如今,德国波恩非营利组织“作物信托”旨在通过提供更稳定的资金来源,帮助农作物基因库建立更加坚实的根基。10月11日,“作物信托”宣布了它的第一个决定,即一笔持续5年、每年140万美元的可再生赠款,用于位于菲律宾洛斯巴尼奥斯的国际水稻研究所(IRRI)的基因银行。
“这些农作物的收集工作对于全世界来说太重要了,不能留下任何不确定性。”成立于2004年的“作物信托”基金会执行董事Marie Haga说,“科学家不能依赖于上下起伏的预算做研究。”
该信托基金会最为人所知的就是其在斯瓦尔巴全球种子库的工作,后者是一个在挪威的北极山脉中挖掘出的储存设施。该种子库包含了近100万份来自世界各地基因库的农作物种子样本,以防发生不可预知的灾难。但该组织也一直在悄悄地努力提高基因库保存和分配种子的能力,并帮助这些基因库达到标准,从而有资格从信托组织建立的捐赠基金中获得长期资助。
如今,经过6年的努力,IRRI——一个在培育现代高产水稻品种中发挥了核心作用的植物育种中心——已经达到了这些标准。例如,它的基因库现在可以根据需要立即提供136000个可用品种的90%的种子。新的资金将使IRRI更容易支撑有时需要劳动密集型工作以维持其收藏的流程。例如,一些农作物品种需要定期种植,以便研究人员能够收获新的种子。
“作物信托”最终希望扩大对IRRI在国际农业研究磋商组织(CGIAR)中的姊妹机构的财政援助,CGIAR是一个在整个发展中国家都有研究中心的全球性非营利农业合作伙伴。
CGIAR的中心总共运营着11个基因库,据分析人士估计,它将获得近5亿美元的捐赠,以确保其获得长期生存能力所需的年度资金(确保世界上大约25个主要基因库中储存的所有农作物的安全大约需要8.5亿美元的捐赠)。到目前为止,“作物信托”已经为其种子银行捐赠了大约3亿美元的资金,这些钱主要来自美国、挪威和德国。所以,“我们有一些方法可以用。”Haga说。
考虑到大米是世界上最重要的农作物之一,研究人员指出,支持IRRI显然是一个优先事项。但是,位于意大利罗马的联合国粮农组织粮食和农业遗传资源委员会的秘书长Irene Hoffmann说,帮助那些储存不太知名的农作物的基因库也很重要,例如对粮食安全很重要的埃塞俄比亚画眉草或藜麦。
Hoffmann说:“有许多基因库,特别是一些国家基因库,并没有得到足够重视;同时有许多农作物并没有像大米或玉米那么高的显示度。”该委员会在去年发布的一份报告中指出,许多基因库因缺乏资金而难以阻止种子的消亡。
Haga希望“作物信托”最终能够支持国家和地区的基因库以及重要的国际中心。她说,为种子的长期保护筹集资金变得更加困难,而为农业多样性筹集资金总是比为有魅力的野生动物找钱更加困难。“我们需要保护所有的自然生物多样性。”Haga说,“我们不要忘记,植物实际上正在喂养我们。”(生物谷Bioon.com)
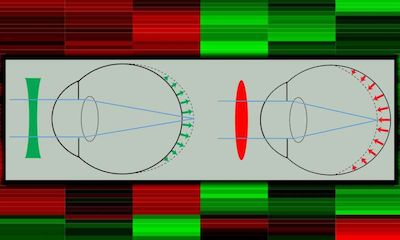
资讯出处:Gene changes driving myopia reveal new focus for drug development

10x Genomics公司宣布收购位于瑞典斯德哥尔摩的Spatial Transcriptomics公司。Spatial Transcriptomics公司是空间基因组学(spatial genomics)领域的领先公司。空间基因组学是一个新兴领域,它不但让研究人员可以获得单细胞内的基因组数据,而且可以比较在组织不同部位的细胞中基因组信息的变化。这一技术在肿瘤学、神经科学和免疫学等疾病领域中将有很广泛的应用前景,而且可用于更广范围的生物学研究。
Spatial Transcriptomics公司的宗旨是在细胞的形态学环境中理解基因表达对更深入地探索基因活性至关重要。该公司的技术平台结合显微成像技术和RNA测序技术,能够从一片完整的冰冻组织切片中,获取切片上不同位置细胞中的完整转录组(transcriptome)数据。
该平台的工作流程将冰冻组织切片覆盖在特定的玻璃矩阵芯片上。芯片上固定着能够捕获细胞中mRNA的探针。探针上携带的条形码标志出它们在矩阵芯片上的位置。通过这种探针捕捉细胞中mRNA并进行测序的方法,研究人员可以观察到哪些基因在组织的特定位置表达,并且可以定量检测出它们的表达水平。
“基因组学领域发展迅速,在很短的时间里我们已经从对人类基因组测序进步到对特定组织,甚至是单细胞进行测序,” Spatial Transcriptomics公司联合创始人Joakim Lundeberg教授说:“空间基因组学将是下一个发展前沿。我们很高兴与10x Genomics公司合作,推广这一技术的应用”。(生物谷Bioon.com)
2019年1月3日 讯 /生物谷BIOON/ –阐明大脑中控制基因活性的分子机制或能帮助理解阿尔兹海默病的发病机理,近日,一项刊登在国际杂志Nature Neuroscience上的研究报告中,来自英国埃克塞特大学的科学家们通过研究揭开了基因活性指示器和阿尔兹海默病的发病关联,相关研究或为后期科学家们开发治疗阿尔兹海默病的新型疗法提供新的思路。
图片来源:public domain
文章中,研究者调查了基因活性的改变,这些改变并非因为遗传代码突变所致,这是一种令人非常兴奋的研究方法,因为其与DNA序列并不相同,这些所谓的表观遗传学过程会被环境因素潜在地改变,从而就提供了一种可能性的方法来影响基因的活性。研究者对一类名为组蛋白乙酰化作用的表观遗传学修饰过程进行研究,组蛋白的乙酰化修饰能够标记处于活性状态的基因组区域,在细胞中,DNA能被组蛋白所包裹,而组蛋白也能被修饰来控制基因的活性,随后研究者利用已故患者机体的脑组织进行研究定量化分析了细胞基因组的组蛋白修饰过程。
研究者在脑细胞的基因组中发现了组蛋白乙酰化修饰水平的增加和降低,同时也鉴别出了参与阿尔兹海默病发生的特殊基因,此外,研究者还发现了控制淀粉样蛋白和tau蛋白表达的调节性区域的差异,这两种蛋白均参与到了阿尔兹海默病的病理学过程中。这项研究中,研究人员首次进行全基因组研究调查阿尔兹海默病发病过程中的组蛋白乙酰化修饰作用,或能为研究者提供一种框架帮助研究影响大脑的其它疾病中的组蛋白乙酰化修饰过程。
研究者Jonathan Mill表示,我们的研究为阐明阿尔兹海默病中组蛋白乙酰化修饰的广泛改变提供了令人信服的证据,尽管后期还需要进行更为深入的研究来阐明组蛋白乙酰化修饰到底是诱发疾病的原因还是结果,但目前研究人员认为,修饰组蛋白乙酰化的药物或许有望作为治疗阿尔兹海默病的新型疗法。阿尔兹海默病影响着数百万人的健康,尽管目前研究人员对该病进行了大量研究,但仍然无法阐明诱发该病的分子机制,这也是研究人员对大脑最受影响部位染色体的第二次大规模研究,旨在寻找相比未受影响患者而言阿尔兹海默病患者机体大脑基因表达所发生的改变和差异,这或许有望帮助理解疾病发生的进程和原因。
最后研究者表示,影响多个基因活性的改变或许与阿尔兹海默病潜在的病理学标志直接相关,更有意思的是,本文研究结果还表明,阿尔兹海默病或许存在遗传性和独立性两种疾病形式中存在着共同的发病机制。(生物谷Bioon.com)
原始出处:
Sarah J. Marzi, Szi Kay Leung, Teodora Ribarska, et al. A histone acetylome-wide association study of Alzheimer’s disease identifies disease-associated H3K27ac differences in the entorhinal cortex, Nature Neuroscience (2018). DOI: 10.1038/s41593-018-0253-7

资讯出处:Researchers correct genetic mutation that causes IPEX, a life-threatening autoimmune syndrome
2019年1月30日/生物谷BIOON/—2019年1月24日,在两篇发表在National Science Review期刊上的论文中,中国研究人员克隆出5只基因编辑猕猴。这两篇论文的标题分别为“BMAL1 knockout macaque monkeys display reduced sleep and psychiatric disorders”和“Cloning of a Gene-edited macaque monkey by somatic cell nuclear transfer”。

这些基因编辑猕猴通过体细胞核移植方法克隆出来。在大约一年前,这种方法被用来克隆出世界上第一只灵长类动物(也是猕猴)。但是,在这两篇新的论文中,这些研究人员首先利用CRISPR-Cas9对这些猴子的基因组进行编辑,具体而言就是敲除在昼夜节律调节中起着重要作用的基因BMAL1,让它们出现睡眠障碍的症状。
根据中国科学院神经科学研究所非人灵长类动物研究平台主任孙强(Sun Qiang)在一份新闻稿中的说法,这些研究人员随后挑选出发生“正确的基因编辑和具有最严重的疾病表型”的猴子进行克隆。
这些研究人员在这些克隆猕猴中观察到的疾病迹象包括失眠和血液激素的变化,以及焦虑、抑郁和“精神分裂症样(schizophrenia-like)”行为的增加。
这个研究项目的既定目标是为生物医学研究提供基因相同的猴子疾病模型。孙主任在这份新闻稿中说道,“我们认为这种克隆基因编辑猴子的方法可用于产生各种基因疾病—包括许多脑部疾病、免疫疾病、代谢疾病和癌症—的猴子模型。”
中国科学院神经所所长蒲慕明也在这份新闻稿中说道,“这类研究将有助于减少当前在世界各地生物医学研究中使用的猕猴数量。”他指出,鉴于这些克隆猴子不会产生混淆的遗传差异,临床前药物试验可能用更少的动物来完成。
这个研究项目涉及几个棘手的问题:克隆、动物权利和基因编辑。一些人认为他们的实验是一个道德窘境的雷区,人们想知道对科学的潜在益处是否足以超过这些猴子受到的所有伤害。(生物谷 Bioon.com)
参考资料:
Peiyuan Qiu et al. BMAL1 knockout macaque monkeys display reduced sleep and psychiatric disorders. National Science Review, 2019, doi:10.1093/nsr/nwz002.
Zhen Liu et al. Cloning of a Gene-edited macaque monkey by somatic cell nuclear transfer. National Science Review, 2019, doi:10.1093/nsr/nwz003.
2019年2月12日 讯 /生物谷BIOON/ –转录因子(TFs)是一种能调节基因表达的特殊蛋白,其能在完整的基因组中搜索并结合特殊区域来调节基因的表达;我们都知道,转录因子不仅能结合特殊的DNA序列,还能非特异性结合任何DNA链。这些非特异性的关联就能够明显增加转录因子寻找特殊靶点的能力,然而目前研究人员并不清楚在扫描大量基因组、定位以及结合特殊位点时,人类机体中超过1500种转录因子的的效率是如何发生变化的。

图片来源:David Suter/EPFL
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自瑞士洛桑联邦理工学院的科学家们通过研究发现了一种新方法,其或能帮助预测不同转录因子在活细胞中扫描基因组的效率;文章中,研究者对小鼠机体中501个转录因子进行了研究,观察了其结合有丝分裂染色体的方式,这种特性能以一种非特异性的方式将转录因子的能力与DNA相关联起来。
利用光漂白试验和单分子成像技术,科学家们发现,通过与有丝分裂染色体的结合就能预测细胞核中转录因子的运动以及其结合特殊位点的效率。将上述实验与全银族中转录因子图谱相结合,研究人员发现,不同转录因子在寻找其结合位点的能力上会表现出三个数量级的差异,具有较强非特异性DNA结合特性的转录因子常常与有丝分裂染色体相关,其在细胞核中移动速度较慢,但其却能有效地寻找需要结合的特殊序列并调节基因的表达。
研究者David Suter说道,转录因子在扫描基因组寻找其特殊结合位点的能力上有很大的差异,而且通过简单地观察期所结合的有丝分裂染色体的多少就能预测这些差异;能在基因组中发挥有效搜寻功能的转录因子常常能驱动基因表达模式发生较大范围的改变,甚至是在较低浓度下依然可以,而且这对于细胞命运的决策过程尤为重要。(生物谷Bioon.com)
原始出处:
Mahé Raccaud, Elias T. Friman, Andrea B. Alber, et al. Mitotic chromosome binding predicts transcription factor properties in interphase. Nature Communications 30 January 2019. DOI: 10.1038/s41467-019-08417-5
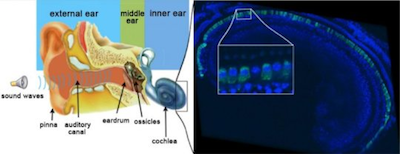
资讯出处:Gene therapy durably reverses congenital deafness in mice