2018年8月13日/生物谷BIOON/—尽管免疫疗法在治疗癌症方面表现出巨大的希望,但是大多数患者并未从这些治疗中受益,这是因为他们体内的肿瘤能够逃避免疫系统检测。不过,解决这一障碍的一种方法是利用在自身免疫疾病中招募T细胞的基因,利用这些基因吸引T细胞来杀死肿瘤。
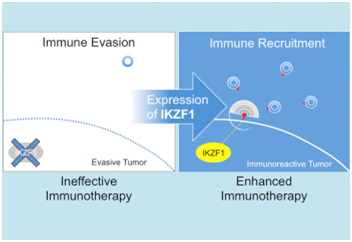
在一项新的研究中,来自美国哥伦比亚大学的研究人员在小鼠中发现一个在斑形脱发(alopecia areata)—在这种疾病中,免疫细胞攻击和破坏毛细胞—中招募T细胞的基因在多种癌症类型中被关闭,从而保护它们免受免疫系统的影响。但是如果重新开启这个基因,那么就能够让这些癌症容易受免疫反应的影响。相关研究结果发表在2018年7月25日的Cell Systems期刊上,论文标题为“IKZF1 Enhances Immune Infiltrate Recruitment in Solid Tumors and Susceptibility to Immunotherapy”。论文通信作者为哥伦比亚大学的Angela M. Christiano博士。
图片来自Cell Systems, doi:10.1016/j.cels.2018.05.020。
这项研究开始于认识到自身免疫疾病和癌症代表了免疫信号谱的两端。当免疫系统过度活跃时,患者可能有患上自身免疫疾病的风险;当它不活跃时,癌症能够逃避免疫系统。
论文第一作者、哥伦比亚大学欧文医疗中心精准医学研究员James Chen博士说,“我们应当能够鉴定出在自身免疫疾病中过度活跃的基因信号,并且在能够逃避免疫反应的肿瘤中使用这些信号。”
在之前的一项研究中,Christiano及其团队已在斑形脱发中鉴定出这样的遗传信号—一个被称为IKZF1的基因。在这种疾病下,过度活跃的IKZF1基因导致免疫细胞过量产生,从而杀死毛囊。
Christiano说,“斑形脱发中的关键免疫细胞正是很多癌症能够逃避的细胞。这些所谓的杀伤性T细胞对癌症免疫疗法获得成功是至关重要的。”
在这项新的研究中,这些研究人员研究了他们是否能够激活肿瘤细胞中的IKZF1基因,以便将T细胞吸引到肿瘤中并动员它们攻击癌症。
这些研究人员使用Chen设计出的一种算法对癌症基因组图谱(Cancer Genome Atlas)中的数千名癌症患者的基因组数据和生物信息学数据进行筛选,旨在寻找癌症调节网络中含有IKZF1的肿瘤类型。这种算法预测了几种癌症类型,包括对靶向免疫疗法敏感的黑色素瘤和两种对靶向免疫疗法不敏感的癌症。他们首先对黑色素瘤小鼠模型的预测结果进行了测试,其中小鼠所患的黑色素瘤经基因修饰后表达IKZF1。他们发现相比于携带着常规黑色素瘤的对照小鼠,在这些小鼠的肿瘤中,浸润性免疫细胞的水平增加了,这表明这种经过基因修饰的肿瘤至少失去了某种逃避免疫反应的能力。
论文共同作者、哥伦比亚大学瓦格洛斯内外科学院泌尿生殖肿瘤学主任Charles G. Drake博士说,“令我们特别震惊的是,表达IKZF1的肿瘤对抗PD-1治疗和抗CTLA-4治疗作出明显更好的反应。肿瘤生长几乎完全受到抑制。”
这些研究人员随后分析了来自之前的一项针对存在IKZF1功能缺陷的黑色素瘤患者的研究的数据。与其他的黑素瘤患者相比,存在IKZF1功能缺陷的黑色素瘤患者具有更高的复发率和更差的存活率。
这些研究人员当前正在寻找其他的能够类似地用于增加黑色素瘤免疫治疗反应的候选基因。
这种算法还预测前列腺癌可能对免疫治疗作出更大的反应。在实验室实验中,这些研究人员发现恢复前列腺肿瘤细胞中的IKZF1活性让它们对免疫治疗敏感。Drake说,“在临床上,这是一个特别令人兴奋的发现,这是因为前列腺癌通常很少被免疫细胞浸润。将这些’冷’肿瘤变成’热’肿瘤可能是治疗成功的关键。”
此外,这种算法正确地预测,如果IKZF1的表达水平增加的话,那么结直肠瘤和肾肿瘤将不会对免疫疗法作出反应,这是因为已发现这个基因在这些肿瘤中是没有活性的。
基于这些发现开发出来的疗法将需要数年的时间,这在很大程度上是因为需要不同的方法来激活在人体中的IKZF1。然而,该方法可能很快用于预测患者是否可能对免疫治疗作出反应并评估这些患者的预后。(生物谷 Bioon.com)
参考资料:
James C. Chen, Rolando Perez-Lorenzo, Yvonne M. Saenger et al.IKZF1 Enhances Immune Infiltrate Recruitment in Solid Tumors and Susceptibility to Immunotherapy. Cell Systems, 25 July 2018, 7(1):92-103, doi:10.1016/j.cels.2018.05.020.

 基因君官网
基因君官网