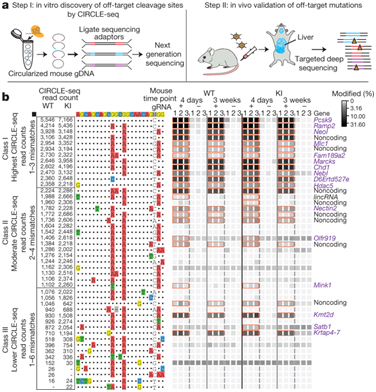
2018年8月26日/生物谷BIOON/—在细胞中进行基因组编辑的一个主要障碍是细胞本身。美国加州大学圣塔芭芭拉分校化学与生物化学系教授Norbert Reich解释道,“人细胞不喜欢摄入东西。”人细胞已形成一种“垃圾处理”机制来分离和降解外来的蛋白、其他的不想要的生物分子和病原体,甚至是受损的细胞结构。因此,对生物技术、生物制药和基因组研究和治疗等领域的人—比如那些利用CRISPR-Cas9基因编辑技术开展研究的人—来说,结果的好坏取决于他们能否高效地绕过这种防御机制和准确地将蛋白导入到动物细胞中。
在一项新的研究中,Reich和他的团队开发出这样的一种方法。据估计,他们的方法在效率上要比现有方法高出100到1000倍,这就为用户运送基因组编辑蛋白提供了完整的时空控制,从而实际上允许他们确切地决定何时何地释放这种蛋白。相关研究结果近期发表在Small期刊上,论文标题为“Light‐Triggered Genome Editing: Cre Recombinase Mediated Gene Editing with Near‐Infrared Light”。
Reich说,“我们实际上能够靶向单个细胞。我们甚至能够靶向一个细胞的一部分,这样我们就能够将这种蛋白释放到这个细胞的一部分中。不过重点是我们控制这种将要切割DNA的蛋白何时何地释放。”
最近在生物技术领域取得的一项突破性进展是利用基因编辑蛋白—诸如CRISP/Cas之类的“分子剪刀”和这项研究中的Cre重组酶—发现、剪切和粘贴靶DNA序列中的特定部分。起初是细菌和古生菌用于识别来自入侵病毒的DNA并对它进行标记以便随后遭受破坏的一种防御机制,从那之后科学家们已利用多种蛋白开发出识别、切割和结合不同长度的碱基序列的方法。这项研究中开发出的这项技术具有巨大的潜力,可应用于确定基因功能的基础研究和能够修复细胞水平缺陷的疗法。
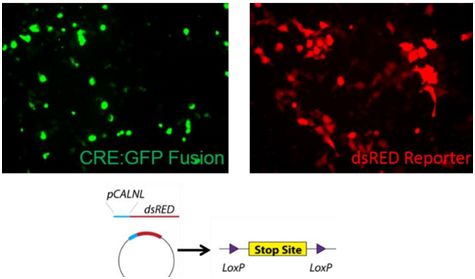
Reich团队开发出的这种光触发的基因组编辑的关键是空心的金纳米球,在这些金纳米球上包被着DNA报告链(发出红色荧光)和由Cre重组酶与细胞穿透肽组成的融合蛋白。它是由近红外光触发的。
Reich说,“因此如今我们有一种归巢设备和一种运送剂”,并解释道Cre重组酶与细胞穿透肽的融合物起着一种靶向系统的作用:当靶细胞进行垃圾处理时,它就发挥作用。
一旦被摄入到细胞中,这些金纳米球被包埋在内体(endosome)—一种膜状口袋—中。Reich说,“但是这些金纳米球没有做任何事情,这是因为它们被包埋着”。超快脉冲近红外激光 —对细胞无害且高效地穿过组织—随后照射这些被包埋的金纳米球和它们的蛋白涂层。
Reich说,“近红外波长照射引起了一件非常有趣的事情发生。它导致这些金纳米球受到激发,从而导致我们所附着的任何东西脱落下来。”与此同时,纳米气泡形成,从而导致内体出现开口并允许它的蛋白内含物逃出。这些蛋白如今自由地前往存储着遗传物质的细胞核中,并让细胞穿透肽进入。Cre能够寻找、剪切细胞中的双螺旋DNA,并且将DNA报告链粘贴到双螺旋DNA中。
这些研究人员的体外实验取得成功:经过一段时间的孵育后,细胞被蛋白包被的金纳米球穿过,随后经照射后,发出红光。
论文第一作者、如今是洛斯阿拉莫斯国家实验室博士后研究员的Demosthenes P. Morales说,“作为一种基础研究工具,通过时空控制,每个细胞都能够用于实验。想象一下,你想要研究某个基因的功能以及它如何改变这个细胞的行为或这个细胞与其相邻细胞的行为。利用等离子体纳米颗粒,我们能够打开或关闭感兴趣的基因,并实时观察它的活性变化所带来的影响。”
Morales说:“在某些情况下,如体细胞突变,不是身体中的每个细胞都需要编辑。控制在何时和何处使用基因编辑蛋白的能力让它短暂地发挥作用。这一点的重要性在于,当前的基因编辑方法通常会导致基因编辑蛋白以活性状态一直停留在靶细胞中,这会带来未知的长期后果。我们的方法以短暂的方式提供基因编辑蛋白,从而避免了这个问题。”(生物谷 Bioon.com)
参考资料:
Demosthenes P. Morales Erin N. Morgan Meghan McAdams et al. Light‐Triggered Genome Editing: Cre Recombinase Mediated Gene Editing with Near‐Infrared Light. Small, Published Online: 02 July 2018, doi:10.1002/smll.201800543.
 基因君官网
基因君官网