2019年4月21日讯/生物谷BIOON/—人体不能自然地保护自己免受HIV病毒感染—至少通常不能做到这一点。但是,在极少数情况下,受感染的个体会产生对抗这种病毒的广泛中和抗体(bNAb)。如今,在一项新的研究中,来自美国洛克菲勒大学的研究人员设计出一种方法,将这种对抗HIV的能力赋予给普通的免疫细胞。相关研究结果于2019年4月11日在线发表在Journal of Experimental Medicine期刊上,论文标题为“HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells”。论文通讯作者为洛克菲勒大学的Michel C. Nussenzweig博士。
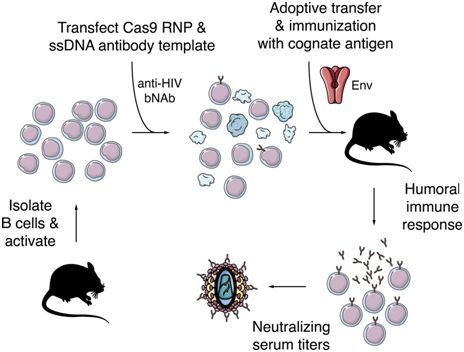
Nussenzweig在bNAb上的研究已产生了新的在早期临床试验中显示出前景的HIV治疗方法。如今,他着眼于第二个目标:针对这种病毒的免疫接种。
在这项新的研究中,Nussenzweig和他的同事们使用CRISPR-Cas9基因编辑技术来修饰B细胞,即一种分泌抗体的白细胞。具体而言,他们对小鼠B细胞进行基因改造,使得它们自己产生人bNAb。他们发现,以这种方式发生改变的B细胞产生的抗体水平足以保护小鼠免受HIV感染,这表明这种技术最终可能用作一种免疫工具。
虽然这项研究仍处于早期阶段,但是它证实了通过基因编辑增强免疫应答的可行性。重要的是,这种技术不会影响生殖细胞,因而避免了有时由CRISPR干预引起的伦理问题。如果能够实现,这种新的免疫方法不仅可以用于治疗HIV感染,而且还可以用于治疗任何对特定抗体敏感的疾病。(生物谷 Bioon.com)
参考资料:
Harald Hartweger et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells, The Journal of Experimental Medicine (2019). DOI: 10.1084/jem.20190287.
 基因君官网
基因君官网


 、
、