2018年7月7日/生物谷BIOON/—CRISPR/Cas基因编辑工具的开发标志着靶向改变遗传信息取得的一次革命性进展。它为基础研究和基因修复提供了大量机会。然而,改变DNA也有风险—它所引起的任何错误将永久性地储存在基因组中,因此可能在较晚的时候给接受DNA改变的个体和他/她的后代带来问题。
德国蒂宾根大学跨学科生物化学研究所的Thorsten Stafforst教授及其团队7年来一直试图开发出一种低风险的替代方法:在RNA水平上进行靶向改变。这种新方法利用一种正常的细胞过程:编码在DNA中的遗传信息经转录后产生RNA,当RNA不再需要时,它便被降解掉。如果改变RNA,那么初始的遗传信息将仍然保留在DNA中。如今,在一项新的研究中,Stafforst团队能够利用这种替代方法精准地和高效地在细胞中编辑这些RNA转录本。相关研究结果发表在2018年7月的Nature Methods期刊上,论文标题为“Efficient and precise editing of endogenous transcripts with SNAP-tagged ADARs”。
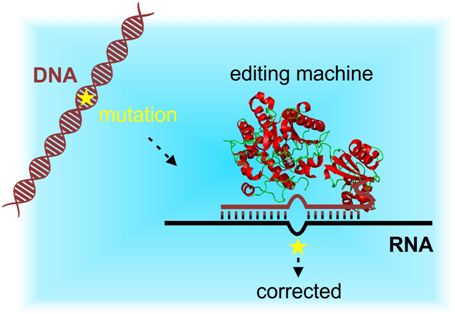
细胞将它的DNA中携带的遗传信息转录为RNA分子。这种遗传信息成为用来产生无数种具有不同组成的蛋白的一组指令。这些蛋白接着作为细胞中的构成单元(building block)发挥作用和控制它的代谢。Stafforst解释道,“我们的RNA编辑方法基于一种蛋白构造体。在一种向导RNA(gRNA)的帮助下,这种蛋白构造体到达到靶RNA分子上,并转化某些碱基。这就使得重写用来产生蛋白的指令成为可能。”RNA操纵能够受到精细调节并且是可逆的,这就使得这种方法在治疗由突变引起的疾病方面特别有吸引力。
具体而言,这种蛋白构造体是通过将作用于RNA上的腺苷酸脱胺酶(adenosine deaminases acting on RNA, ADAR)与SNAP-tag融合在一起而产生的。这种蛋白构造体在gRNA的引导下能够将靶RNA转录本中的腺苷酸(A)转化为肌苷酸(I)。Stafforst团队利用这种蛋白蛋白构造体同时对两种疾病相关的编码信号蛋白的RNA转录本KRAS和STAT1进行高效地编辑。
限时操纵RNA
Stafforst指出这种工具可能能够编辑多种引起疾病的突变。他补充说,RNA中引入的瞬时变化使得干预信号通路(比如与炎症有关的信号通路)成为可能,这是因为永久性操纵RNA有可能会产生严重后果。Stafforst说,“我们已证实这种方法能够同时编辑多种编码信号蛋白的RNA转录本。”Stafforst团队证实他们的方法的编辑效率是近期公布的基于一种CRISPR/Cas变体的定点RNA编辑方法(即Cas13b–ADAR)的2倍。
通过与美国斯坦福大学的Jin Billy Li教授及其团队合作,Stafforst团队证实这种方法仅会产生少量错误,而且他们能够将这些错误降到最低。Stafforst补充道,这种方法是高效的,而且比其他的编辑方法具有更高的特异性。
将定点RNA编辑用于基础研究和医学的研究工作才刚刚开始。Stafforst说,“未来,我们想要放弃经过基因改造的蛋白,转而使用天然存在的酶来进行定点RNA编辑。”Stafforst团队已就他们开发出的这种方法申请了专利。(生物谷 Bioon.com)
参考资料:
Paul Vogel, Matin Moschref, Qin Li et al. Efficient and precise editing of endogenous transcripts with SNAP-tagged ADARs. Nature Methods, July 2018, 15(7):535–538, doi:10.1038/s41592-018-0017-z
近几年来,科学家们开始在临床试验中使用基因编辑技术来改善患者多种疾病的诊断和治疗,并取得了很多研究成果,那么近期又有哪些亮点研究值得一读呢?本文中小编对相关研究进行了整理,分享给大家!
【1】Nature:重大突破!无需病毒载体,利用电穿孔成功对人T细胞进行CRISPR基因编辑
doi: 10.1038/s41586-018-0326-5
在一项新的研究中,来自美国加州大学旧金山分校的研究人员在不使用病毒插入DNA的情形下对人T细胞(一种免疫细胞)进行重编程。这一成就对研究、医学和产业产生重大的影响。他们期待他们的方法—一种快速的通用的经济的采用CRISPR基因编辑技术的方法—将会在新兴的细胞治疗领域中得到广泛使用,加速开发出新的更加安全的治疗癌症、自身免疫疾病和其他疾病(包括罕见的遗传性疾病)的疗法。
这种新方法提供了一种强大的分子“剪切和粘贴”系统,用于重写人T细胞中的基因组序列。它依赖于电穿孔,即一种将电场施加到细胞上使得它们的细胞膜暂时地更具有渗透性。在一年内试验了数千个变量之后,这些研究人员发现,当某些数量的T细胞、DNA和CRISPR“剪刀”混合在一起然后暴露在一种适当的电场中时,这些T细胞将摄入DNA和CRISPR剪刀,并且精确地将特定的基因序列整合到CRISPR在基因组中的靶切割位点上。
论文通信作者、加州大学旧金山分校微生物学与免疫学副教授Alex Marson博士说,“这是一种快速而又灵活的方法,可用于改变、强化和重编程T细胞,这样我们就能够给它们提供我们想要的特异性来清除癌症、识别感染或者抑制自身免疫性疾病中观察到的过度免疫反应。”
【2】Nat Biotechnol:科学家成功利用基因编辑技术降低猕猴体内有害胆固醇的水平 有望进入人类临床试验
doi:10.1038/nbt.4182
日前,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自宾夕法尼亚大学Perelman医学院的研究人员通过对猕猴进行研究发现,利用基因编辑使其机体中名为PCSK9的蛋白失活或许能够有效降低猕猴机体的胆固醇水平,这项研究中研究人员首次利用基因编辑技术对大型动物模型进行研究发现了与临床疾病相关的基因表达水平的降低,基于本文研究结果,后期研究人员或许有望开发出新型疗法治疗对PCSK9抑制剂并不会耐受的心脏病患者,同时这种药物/疗法也能用来抵御机体的高胆固醇水平。
正常情况下,PCSK9蛋白能够抑制受体对肝脏中过量的有害胆固醇进行移除,在临床中,抑制PCSK9的水平就能够降低人类机体中有害胆固醇的水平。然而,某些高胆固醇血症患者却不耐受这些药物,这就提示,基因编辑或许能作为一种治疗高胆固醇血症患者的手段。研究者Lili Wang博士说道,大部分患者都会反复注射PCSK9抗体来治疗疾病,这项研究中我们发现,利用基因编辑技术就能够让那些对抑制药物不耐受的患者不再需要这种疗法进行治疗了。

doi:10.1038/s41598-018-26190-1
CRISPR/Cas9系统为编辑HIV-1病毒基因组提供了一种新的有潜力的工具,近日来自日本神户大学医学院感染疾病中心及健康科学研究生院国际卫生系的研究人员设计了一种RNA引导的CRISPR/Cas9以靶向HIV-1调节基因tat和rev,其中的引导RNAs(gRNA)都基于CRISPR的特异性设计,其靶向的序列在6种主要的HIV-1亚型中都保守存在。
在共转染前每个gRNA都被克隆进CRISPRv2慢病毒中,从而创造了慢病毒载体并将之转导进入细胞。和没有转染以及转染空载体的细胞相比,CRISPR/Cas9转染稳定表达Tat和Rev的293?T和HeLa细胞后,细胞中的这两个基因表达都被成功的抑制。
Tat功能试验显示转染tat-CRISPR显著抑制了HIV-1启动子驱动的荧光素酶的表达,而Rev功能试验则显示转染rev-CRISPR后gp120的表达被完全抑制。Cas9剪切位点的靶基因出现高频的各种程度的突变。值得注意的是,研究人员没有检测到任何非靶标靶位点出现突变,同时Cas9的表达对细胞的活性没有影响。
【4】Nat Cell Biol:利用干细胞技术与基因编辑技术建立人类基因组功能蓝图
doi:10.1038/s41556-018-0088-1
最近,来自耶路撒冷的Hebrew大学的研究者们利用基因编辑技术以及人源胚胎干细胞技术绘制出了人类基因组的蓝图,揭示了基因对人体健康以及疾病发生的作用。相关结果发表在最近一期的《Nature Cell Biology》杂志上。
胚胎干细胞是一类能够转化为任意类型成体干细胞的资源,这一特性使得其成为了再生医学、疾病模拟以及药物发现等领域的核心。除了人源胚胎干细胞的发现,生物学领域的另外一项里程碑式的突破是人类基因组测序工作的完成。这一发现使得我们能够进一步理解基因与功能之间的关系。如今,这项最新的研究则利用人源胚胎干细胞对所有基因的功能进行了系统地绘制。
【5】PLoS Pathog:基因编辑的干细胞有望消除HIV!
doi:10.1371/journal.ppat.1006956
使用基因编辑的骨髓干细胞可以显著降低感染猴/人免疫缺陷病毒(SHIV)的猪尾猕猴休眠的“病毒水库”的大小,来自福瑞德哈金森肿瘤研究中心的Christopher Peterson及其同事在《PLOS Pathogens》上发表了这项最新研究。
2007年,HIV阳性的Timothy Brown接受了骨髓干细胞移植以治疗白血病。而这个过程却意外地清除了他体内的HIV,可能是由于供体细胞的CCR5基因发生突变,使他对HIV产生了抗性。但是要找到携带CCR5突变的供体是很困难的,同时这种移植对于健康的HIV阳性患者而言是非常危险的,因为供体细胞有可能攻击自身细胞。
为了解决这个问题,Peterson及其同事现在正在探索使用基因编辑技术给病人自身的干细胞引入CCR5突变。在过去的工作中,他们证明了他们可以安全的从健康猕猴身上取出骨髓干细胞、编辑CCR5基因并进行回输,而CCR5突变细胞成功地增殖了。
【6】Nat Genet:科学家改进基因编辑技术CRISPR 有望加速细胞基因组的编辑
doi:10.1038/s41588-018-0087-y
CRISPR作为一种强大的基因编辑工具,其能够帮助科学家们以惊人的精确度对DNA进行修剪,但追踪这些改变对基因功能的影响常常比较耗时,研究人员当前仅能一次对一种编辑进行分析,而这个过程需要花费数周时间。
近日,一项刊登在国际杂志Nature Genetics上的研究报告中,来自加州大学洛杉矶分校的科学家们通过对CRISPR技术进行改进,实现了一次对数以万计的基因编辑的结果进行监测的目的,同时相关研究还能改善科学家们鉴别遗传性改变的能力,这些遗传学改变常会对细胞产生损伤并且诱发疾病。
研究者Leonid Kruglyak表示,很多年来科学家们一直使用CRISPR对多个基因进行切割,目前他们仍然缺少CRISPR方法来同时对多个基因进行编辑,我们实验室就首次开发出了一种大规模技术,能够在结构类似于人类细胞的细胞中实现这一目的。此前研究人员在细菌细胞中进行了平行编辑,CRISPR能够与剪刀样蛋白Cas9相结合,Cas9作为引导分子能将CRISPR引入精确的位点,一旦到达目的地,Cas9就开始修建DNA使得靶基因失活,随后研究人员就会插入新的DNA片段并对基因序列进行编辑,同时还会修补Cas9造成的缺口。

【7】Nat Genet:科学家将CRISPR基因编辑技术同DNA条形码技术结合 有效追踪癌症进展
doi:10.1038/s41588-018-0083-2
最近,一项刊登在国际杂志Nature Genetics上的研究报告中,来自斯坦福大学的科学家们通过研究发现了一种新方法能够修饰小鼠肺部中的一对癌症相关基因,随后还能精确追踪肿瘤中的每一个细胞,这种组合性技术或能明显加速癌症领域的研究以及药物的开发;相关研究最终能够帮助科学家们模仿并且在实验室外部研究肿瘤中细胞的遗传多样性。
人类的癌症并不仅仅只有一种肿瘤抑制突变,其存在多种突变组合,但问题是,不同的突变基因是如何相互作用呢?就在几年前,诸如图谱绘制的研究耗费了研究人员数年的努力,研究人员培育出了多种不同谱系的遗传修饰化小鼠,其中每一种都携带不同的失活肿瘤抑制基因,为了探索所有的可能性组合,研究人员就需要成百上千只小鼠。
相比之下,研究者Winslow及其同事就在几个月里对不到24只小鼠进行研究,他们分析了肺癌领域的基因型研究情况,这要比过去以往15年所进行的研究要多。这项研究中,研究人员将基因编辑技术CRISPR-Cas9和DNA条形码技术相结合开发出了组合性的技术,以此来追踪癌症的生长发展情况,这两项技术的完美结合就能帮助科学家们在实验室中复制出癌症患者机体中所观察到的遗传多样性,同时也克服了研究人员对癌症复杂性研究的恐惧心理。
【8】Nat Commun:新型基因编辑技术或能制造出完美的“双胞胎”多能干细胞
doi:10.1038/s41467-018-03044-y
日前,一项刊登在国际杂志Nature Communications上的研究报告中,来自日本京都大学等处的研究人员通过研究开发了一种新型的基因编辑方法,其能够以较高的准确度修饰人类基因组中单个DNA碱基,这种新方法的特殊之处在于其能够指导细胞自身的修复机制,从而就能为研究疾病相关的突变提供一对基因匹配的细胞。
DNA的单突变俗称为单核苷酸多态性(SNPs),其是人类基因组中最常见的突变,如今研究人员已经知道有超过1000万个SNPs,很多SNPs都与多种人类疾病直接相关,比如阿尔兹海默病、心脏病和糖尿病等,为了理解SNPs在遗传性疾病中的关键角色,本文中,研究人员从捐赠者机体中开发出了诱导多能干细胞(ips)。

美国《科学》杂志在线版17日报道了一项人类医疗史上的里程碑:科学家首次尝试在人体内直接进行基因编辑。他们向一名44岁的患者血液内注入了基因编辑工具,以永久性改变基因的方法来治愈严重遗传疾病。
这项临床试验在美国加州大学旧金山分校完成,受试者是44岁的亨特氏综合征患者布莱恩·马德。亨特氏综合征是一种罕见的、威胁生命的遗传性疾病,由基因突变导致,患者细胞代谢废物无法分解,累积在组织器官中,最终产生机能障碍。
马德所接受的基因编辑工具是锌手指核酸酶,而并非一直以来广受关注的CRISPR。与后者相比,锌手指核酸酶的“资历”更早,它被认为是第一代基因编辑工具,进行定位的序列更长,操作相对复杂,基因编辑的精准度也更高。
【10】Science:CRISPR基因编辑结合离体器官构建技术帮助检测遗传性癌症特异性DNA缺陷
doi:10.1126/science.aao3130
最近,来自英国与荷兰的研究者们开发出了两种新型的家检测一类遗传性癌症的方法——“器官发育”与“CRISPR-CAS9”.根据最近发表在《Science》杂志上的一篇文章,作者们描述了这种方法如何能够更好地理解特定类型的遗传性癌症。
为了更好地理解遗传性癌症发生过程中的各类影响因素的作用,研究者们利用成人小肠上皮细胞分化培养出了离体器官,这种人造器官能够用于研究人体相关的生物学性状。而在这一研究中,作者们利用离体器官进行肿瘤生长的遗传学研究。利用CRISPR/CAS9技术,作者敲出了离体器官中的一种叫做NTHL1的基因。这一基因天然存在于人类肠道中,敲除该基因的目的是用于研究这种做法能否模拟真实肠癌患者的性状。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
2018年7月25日讯 /基因宝jiyinbao.com /——通过遗传学研究,研究人员揭示了人和动物疾病可以跨种族传播的一个主要原因。这些发现为新的致病菌株金黄色酿脓葡萄球菌(Staphylococcus aureus ,S. aureus)的起源提供了新观点。专家表示这项研究可以帮助改善抗生素的使用及设计更好的策略阻止这种细菌的传播。
图片来源:CC0 Public Domain
S.aureus通常生存在我们的鼻子中,对我们无害,但是如果细菌进入我们的体内,那么就会引起感染,甚至会致命。耐抗生素的菌株(如MRSA)是需要住院的感染事件的主要原因之一。这些细菌也是农业工业中一个主要的负担,因为它导致了牛的乳腺炎和肉鸡的骨骼感染等疾病。
一个由爱丁堡大学罗斯林研究所领导的研究团队分析了从人和动物体内分离出来的800余株S.aureus的遗传物质。研究人员试图找到这些细菌的进化史以及允许它们跨种族传播的关键事件。
他们发现人很可能是这些细菌最初的宿主,而最先能够感染畜牧的细菌起源于最初被驯化用于农业的动物。研究人员发现,奶牛是一些现在引起全球人类感染的细菌的来源之一。研究人员认为这表明为了阻止主要的流行病,监控人和动物身上疾病很重要。
这个分析还显示细菌每跨一次物种,都需要能够维持其在新宿主体内生存的新基因。在某些情况下,这些基因也可以引起细菌对常用抗生素产生耐药性。这项研究还发现与抗生素耐药性相关的基因在可以感染人和感染动物的细菌中的分布并不均匀。研究人员认为这与医学和农业中抗生素的使用有关。
研究人员表示,研究细菌如何受到其跨越种族后的基因突变的影响将有助于开发出新的抗菌疗法。这还有助于帮助控制感染以降低传播至人类的风险并延缓抗生素耐药性的产生。这项研究于近日发表在《Nature Ecology & Evolution》上,涉及来自爱丁堡大学、剑桥大学和威康桑格研究所的研究人员。(生物谷Bioon.com)
参考资料:
Emily J. Richardson et al, Gene exchange drives the ecological success of a multi-host bacterial pathogen, Nature Ecology & Evolution (2018). DOI: 10.1038/s41559-018-0617-0

1、FH基金会宣布关于家族性高胆固醇血症(FH)基因检测的共识声明
家族性高胆固醇血症(FH)基金会宣布,关于诊断家族性高胆固醇血症(FH)的重要共识声明,该声明建议进行基因检测,以诊断患有FH的人及其亲属。对有风险的个体进行基因检测有望加速确诊,以确保早期治疗。全世界有超过3000万人患有FH,其中90%目前未被确诊。
共识声明建议为有高胆固醇或早期心脏病发作的阳性家族史的患者提供FH相关基因检测,这些个体具有明确或可能的FH。大多数FH病例存在三种变异,它们可增加患冠状动脉疾病(CAD)的风险。这些变异的位点在低密度脂蛋白受体(LDLR),载脂蛋白B( APOB)或Proprotein Convertase枯草杆菌蛋白酶/Kexin 9型(PCSK9)。
2、打造新型测序技术,Omniome获中国投资者领投的6000万美元
近日,一家专注新型DNA测序技术的圣地亚哥公司筹集了6000万美元资金,多家中国投资者参与投资。该公司名为Omniome ,由Illumina前员工于2013年首创,该公司的技术可以低成本提供高度准确和快速的测序结果。此次新的B轮融资由新投资者Decheng Capital(上海)和Hillhouse Capital(北京)领投,Lam Research Capital(美国)和Nan Fung Life Sciences(香港)跟投。该公司的技术被称为“结合测序”(SBB),可以通过利用聚合酶的自然匹配能力“提高核苷酸和DNA匹配的精确度。”这减少了运行时间并增加了每次运行的样品数量。
3、Chronix在AACC上展示肾移植液体活检研究结果,近期将在美国推出产品
Chronix Biomedical是一家新型血液分子诊断开发公司,近日在美国临床化学协会(AACC)年会上口头汇报了其Therasure移植监测仪在监测器官移植排斥早期症状的前瞻性临床研究结果。Therasure移植监测仪通过测量血液中移植物来源的无细胞DNA(GcfDNA),作为急性排斥和器官健康早期征兆的生物标志物,可以避免患者进行不必要的活检。研究数据显示,在检测所有主要实体器官移植物的早期移植排斥方面,Therasure比其他相关测试具有更广泛的适用性。该公司目前正在欧洲国家推出其Therasure产品系列,并将在未来12个月内进入美国市场。
4、QIAGEN与日本最大的临床实验室公司SRL合作,加速推出伴随诊断
QIAGEN宣布与日本最大的临床检测实验室公司SRL公司合作,为新药批准的伴随诊断做准备。此次临床实验室研究服务的非独家主协作协议将使得QIAGEN的配套诊断工作流程在日本药品和医疗器械局(PMDA)批准药物和测试后能够快速实施。QIAGEN与医药合作伙伴共同开发的几项测试预计将在未来几年进入日本注册。QIAGEN与SRL的Day-One实验室协议将涵盖一系列QIAGEN伴随诊断,包括用于个体化医疗保健的实时聚合酶链反应(PCR)和下一代测序(NGS)解决方案。最初的项目涉及QIAGEN伴随诊断,配合正在日本开发的用于治疗实体瘤和白血病的新药。
5、Personalis获得纽约州卫生部批准,在癌症免疫治疗临床试验中使用其ACE ImmunoID?平台
领先的免疫基因组测序和分析提供商Personalis宣布,它已获得纽约卫生部批准使用ACE ImmunoID——个体化癌症疫苗和IO生物标志物发现的下一代测序平台——用于癌症免疫治疗临床试验。Personalis临床实验室许可证已被授予肿瘤学——分子和细胞肿瘤标记物类别。
ACE ImmunoID基于Personalis专有的ACE(精确度和内容增强)技术,结合了整个外显子组和转录组测序,覆盖了大约20,000个基因,并增加了超过8,000个基因的扩增覆盖率。因此,ACE ImmunoID提供比其他商业上可用的外显子组更均匀的测序覆盖度,用于全面的变异体捕获(SNV,插入缺失和融合),以及用于个体化癌症疫苗开发的新抗原检测。
6、投资3亿美元,GSK与23andMe合作研发新药
知名医药企业葛兰素史克(GSK)与消费者基因检测先驱公司23andMe宣布达成4年独家合作,将利用人类遗传学信息研发创新疗法。GSK同时将对23andMe进行3亿美元的股权投资。据了解,两家公司的新药研发合作将立即启动,而GSK的一款LRRK2抑制剂项目将是最早开启的计划之一。目前,这款新药正位于临床前的开发中,有治疗帕金森病的潜力。而23andMe对LRRK2变异位点的检测,有望加速这一临床项目的开发。
23andMe自成立至今,已经拥有了超过500万名用户,建立起了世界上规模最大的遗传学/表型数据库之一。本次合作将结合23andMe大规模的遗传学资源和先进的数据科学技术,以及GSK在科学和医学上的专精,强强联手,寻找关于创新药物靶点的洞见,带来创新疗法,满足广大未竟的医疗需求。本次合作主要涵盖三个方面:1)改善新药靶点的选择,带来更安全、更精准的新药;2)助力对患者亚组的鉴定与选择;3)更有效地招募临床试验患者。通过寻找到带有特定遗传学特征的患者亚组,加速他们进入临床试验的进程,缩短临床开发周期。(生物谷Bioon.com)

Mustang Bio公司与圣犹达儿童研究医院(St. Jude Children’s Research Hospital)共同宣布达成独家全球许可协议。双方将共同研发治疗X连锁严重联合免疫缺陷病(X-linked severe combined immunodeficiency, X-SCID)的first-in-class基因疗法。X-SCID又被称为“泡泡男孩病”,它是最常见的严重联合免疫缺陷病,在全球范围内影响到5~10万新生儿。
X-SCID是由于在X染色体上的IL2RG基因出现突变而导致的罕见遗传病。患者产生的淋巴细胞非常少,导致身体无法抵抗任何感染。如果不接受治疗,这些患者在婴儿时就会因为感染而去世。这些新生儿在出生时就需要被放在无菌的保护罩内生活,他们的一生可能都要在与世隔绝的无菌环境中度过,因而被称为“泡泡男孩”。
目前,除了提供无菌环境,降低感染发生的机会以外,治疗X-SCID的标准疗法是接受组织完全匹配的兄弟姐妹的骨髓移植。成功的骨髓移植手术虽然能够完全重建患者的免疫系统,但是超过80%的X-SCID患者没有完全匹配的供体,这些患者必须接受部分匹配的供体提供的骨髓组织。这种骨髓移植完全恢复免疫功能的可能性较低,而且可能产生严重的副作用。
圣犹达儿童研究医院Brian Sorrentino博士率领的研究团队开发出一种创新基因疗法,他们使用慢病毒载体,在体外将健康的IL2RG基因导入从患者体内获得的造血干细胞中。然后研究人员将这些经过基因工程改造的造血干细胞注回患者体内。在接受造血干细胞疗法之前,患者会接受一轮低剂量的白消安(buslfan),帮助经过基因工程改造的造血干细胞在骨髓中生长和繁衍。
目前这一疗法正在临床1/2期试验中用于治疗2岁以下的X-SCID患者。根据在2018年5月发布的中期结果,迄今为止,总计8名患者已经接受了治疗。这一疗法显示出良好的耐受性。而且,6名患者在接受治疗3-4个月后免疫系统得到重建,另外2名患者处于早期恢复过程中并且表现良好。在6名患者中,有两名已经停止每月接受静脉输入的免疫球蛋白。有3名患者在接受治疗前体内存在已经扩散的感染,但是在接受治疗后,所有感染已经被完全治愈。
“我们的疗法目前表现出良好的耐受性,没有婴儿在接受低剂量白消安后需要任何输血支持,”这项临床试验的负责人,圣犹达儿童研究医院的Ewelina Mamcarz博士说:“最重要的是,我们观察到免疫系统中的所有细胞都得到了恢复,这与以前的基因疗法相比是个重大进步。以前的基因疗法试验中B淋巴细胞数目得不到恢复,患者仍然需要终身接受免疫球蛋白的静脉注射。”
Mustang 公司的总裁兼首席执行官Manuel Litchman博士说:“我们期待与圣犹达的研究人员合作,推动这一项目,完成临床1/2期试验。我们的目标是为那些无法找到完全匹配骨髓移植供体的婴儿和那些接受治疗后仍然存在显着免疫能力缺陷的患者提供一种创新的长效疗法。”(生物谷Bioon.com)
临床上同病同治不同疗效的现象比比皆是,面对一些格外棘手的患者,以往医生只能无奈地解释为个体化差异。如今,以药物基因组学理论和基因检测为基础的“个体化药物治疗”可以实现量体裁衣式的个体化给药,它可以帮助医生解决患者的用药问题。
1.介绍
基因芯片,是把大量已知序列探针集成在同一个基片(如玻片、膜)上,经过标记的若干靶核苷酸序列与芯片特定位点上的探针杂交,通过检测杂交信号,对生物细胞或组织中大量的基因信息进行分析。
目前,基因芯片主要应用于医疗领域的基因表达分析、疾病诊断与治疗、药物研究等。其中,基因表达分析的具体应用包括分析基因表达时空特征、基因差异表达检测、发现新基因、大规模DNA测序等;疾病诊断与治疗的具体应用包括遗传病相关基因的定位、肿瘤诊断、感染性疾病诊断、耐药菌株和药物检测等;药物研究方面的具体应用包括新药开发、对药物的毒性评价,以及调查药物处理细胞后基因的表达情况等。
2.产业链与市场容量
基因芯片产业链分为上游原材料行业、中游制造行业、下游应用市场,上游原材料包括芯片基片、点样样品、探针制备等,目前原位芯片、打印芯片芯片的技术均掌握在国外公司手中(Thermo Fisher、Centrillion、Agilent);中游制造行业主要产品是基因芯片诊断试剂盒和基因芯片相关仪器,市场占比分别是86%和14%,目前国内的企业大多集中在中游;下游应用市场主要为医疗机构、家庭、第三方诊断外包机构。
市场规模方面,2010年全球基因芯片市场规模7.6亿美元;到2016年,全球基因芯片市场规模已达到61.8亿美元;预计2020年将达到184亿美元,2015-2020年均复合增长率为31.5%。
3.重点应用领域
3.1. 心血管疾病个性化用药领域
心血管系统疾病主要包括高血压、动脉粥样硬化、冠心病、脑卒中等,是严重威胁人类健康和导致死亡的重要原因。目前,国内心血管患病率处于持续上升阶段,现患人数2.9亿,且由于心血管病导致的死亡率一直高居不下。目前临床上常规使用的抗凝药、抗血小板药、降脂药、血管扩张药等普遍存在个体差异。随着药物基因组学研究的深入,开展与药物疗效相关的基因多态性检测,可以为临床选择合适的药物种类及药物剂量提供遗传证据,能极大地提高心血管药物使用的安全有效性。
治疗心血管疾病,有几种重要的药物,分别是:阿司匹林、氯吡格雷、华法林、硝酸甘油和他汀类降脂药等。尽管这些药物总体上对心血管疾病有着不错的治疗效果,但是,针对于不同的人,具体的情况不尽相同。
波立维(硫酸氢氯吡格雷片)是赛诺菲-安万特和百时美施贵宝两家公司研制的抗血小板凝集药物,具有显着的血小板抑制作用,可以减少心血管疾病患者心脏病发作、卒中以及死亡的风险。尤其是植入冠状动脉内血管支架的病人,必须服用波利维长达一年左右的时间,否则可能会因为支架内血栓形成,危及生命。由于患者服用波立维后,此药必须通过肝脏内的一种叫做CYP2C19的肝药酶的代谢,才能转化为具有药效的活性状态,进行发挥抗血小板聚集的作用,因此CYP2C19酶活性对于药效发挥至关重要。
从检测技术路径来说,应用于用药领域的基因检测来说,方式主要有三种,分别为基因芯片、PCR以及基因测序,基因芯片相比于其他方式,其特色优势比较突出,相对于测序而言,基因芯片优势在于检测效率高和检测成本相对较低;相对于PCR方法,在操作便捷性、自动化程度以及灵敏性等方面亮点突出,因此未来更具发展潜力。
目前,针对心血管基因个体化用药的检测试剂盒共有19中,其中基于PCR技术的有13种,基于基因芯片技术的有5种,基于测序技术的有1中。总体来讲,主流的个体化用药检测技术依然是PCR技术。但是随着基因芯片技术的不断发展,和精准用药渗透率的逐步提升,使用基因芯片进行个性化用药检测的市场需求必将快速释放。除心血管疾病需进行个性化用药检测外,还有叶酸补充,哮喘用药和各种肿瘤疾病等多种疾病均需要个性化用药检测。(生物谷Bioon.com)

全球乳腺癌发病率自20世纪70年代末开始一直呈上升趋势。美国8名妇女一生中就会有1人患乳腺癌。中国不是乳腺癌的高发国家,但不宜乐观,近年我国乳腺癌发病率的增长速度却高出高发国家1~2个百分点。
《自然》近日在线发表的一篇论文对数千种BRCA1的基因变异按功能进行了更精确的分类。这些功能评分对乳腺癌和卵巢癌罹患风险的基因检测解读或具有临床意义。
BRCA1是一种人体肿瘤抑制基因,BRCA1失去功能的突变与易患早发型乳腺癌和卵巢癌有关。虽然已发现的BRCA1基因变异有数千种,但许多都被列为“意义未明的变异”,给患癌风险评估带来了巨大挑战。
要弄清这些意义未明的变异,其中一个方法是检测变异基因的表达是否具有恢复DNA修复的功能,这也是肿瘤抑制过程的一部分。美国华盛顿大学的Jay Shendure及同事运用基因组编辑技术,对BRCA1基因功能至关重要的13个外显子上的近4000种单核苷酸变异(SNV)的功能进行了评估,并在2000万个人类单倍体(HAP1)细胞中进行了后续细胞存活率测定。
最后,研究人员识别出了约300种会干扰表达的SNV以及400多种错义突变的SNV(会导致蛋白质的氨基酸序列改变),发现这些变异并无实际功能(不破坏基因的原有功能)。这些功能评分与已知的致病性变异或良性变异的临床评估密切相关。
该团队指出,与其他细胞系相比,HAP1细胞系可能不是生理学上的最优模型,但与临床评估的高度相关性验证了数据。研究者肯定了功能评分对变异分类的重要价值,并认为研究结果可直接应用于BRCA1基因筛查的解读。(生物谷Bioon.com)