2018年1月19日/生物谷BIOON/—当通过降低眼内压力来测试治疗青光眼的基因时,来自美国威斯康星大学麦迪逊分校的研究人员偶然发现了一个问题:他们无法有效地将基因运送到控制眼内液体压力的细胞中。基因仅在进入细胞之中才能够发挥作用。
青光眼是最为常见的致盲性疾病之一,是由于眼内压力过高造成的,其中眼内压力过高通常是眼睛中的液体排出管(fluid drain)堵塞引起的。威斯康星大学麦迪逊分校眼科与视觉科学教授Paul Kaufman说,“大多数青光眼病例能够通过每日药物处理来加以治疗。在理论上,替代性基因可能恢复持续多年的正常液体流动,而无需每天自行给予眼药水,毕竟后者是不便利的,而且可能具有局部的甚至全身的副作用。
如今,在一项新的研究中,Kaufman和威斯康星大学麦迪逊分校眼科与视觉科学教授级研究员Curtis Brandt展示了一种改进的将新的基因运送到这种被称作小梁网(trabecular meshwork)的液体排出管中的策略。相关研究结果发表在2018年1月的Investigative Ophthalmology and Visual Science期刊上,论文标题为“Proteasome Inhibition Increases the Efficiency of Lentiviral Vector-Mediated Transduction of Trabecular Meshwork”。
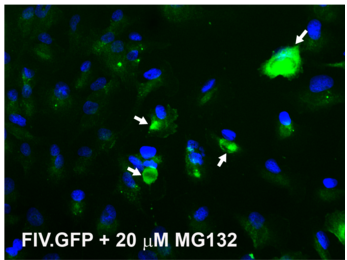
这些研究人员一直在测试一种基于猫免疫缺陷病毒(FIV)的载体来运送基因。与相关的人类免疫缺陷病毒(HIV)一样,FIV能够将基因插入到宿主的DNA中。然而,眼睛对FIV产生的先天性免疫防御干扰这种基因运送。
病毒颗粒含有包裹在被脂质膜包被的蛋白外壳中的基因。Brandt说,在病毒进入细胞并脱落它的脂质膜之后,来自宿主的防御分子能够“将这种病毒颗粒拖到细胞的被称作蛋白酶体的垃圾处理厂中,在那里它被降解。我们想知道暂时地阻断蛋白酶体是否能够阻止这种基因运送载体遭受破坏从而增强基因运送。”
在当前的这项研究中,这些研究人员在存在或不存在一种阻断蛋白酶体的化学物的情形下,将携带一种标记蛋白的FIV病毒放置在小梁网的细胞上。
Brandt说,在超过剂量阈值时,这种处理方法将基因转移到靶细胞中的效率增加一倍。这些新的基因也在整个小梁网组织中更加均匀地扩散。运送更多的基因拷贝应该提供更大的治疗效果,打开小梁网中的液体排出管,从而降低眼内压力。
Brandt说,当前的这项研究关注的是用于基因转移的工具,而不是基因本身。但是,他说,即使在当前的这项研究之前,他和考夫曼“已经鉴定出至少两个可能疏通这种液体排出管的基因”。
Brandt说,在进行基因替换和治愈疾病的长期斗争中,“眼睛是最成功的故事之一”。一种被称作利伯氏先天性黑内障(Leber’s congenital amaurosis)的致盲性眼病会破坏让感光细胞保持健康的细胞的功能;替换发生突变的基因已保存甚至改善了年轻患者的视力。如今,这种基因疗法正在等待美国食品药物管理局(FDA)的批准。
为了阻止病毒注射带来的危险,Brandt说,“我们几乎移除了这种病毒中的所有基因,因此它没有机会从最初注射的地方进行复制和扩散。”
虽然这种技术确实干扰了眼睛的抗病毒免疫防御,但这种影响是暂时的。Brandt说:“眼睛一旦遇到这种药物,那么它就会被代谢掉,这样先天性免疫抑制就会消失。”
Brandt说,“我们证实这种策略确实在眼部器官培养物中发挥作用。一旦我们进一步开展效率研究并鉴定出要运送哪种基因,那么我们很可能准备好迈向临床试验阶段。”(生物谷 Bioon.com)
参考资料:
Zeynep Aktas, Hongyu Rao, Sarah R. Slauson et al. Proteasome Inhibition Increases the Efficiency of Lentiviral Vector-Mediated Transduction of Trabecular Meshwork. Investigative Ophthalmology and Visual Science, January 2018, 59(1):298-310, doi:10.1167/iovs.17-22074
 基因君官网
基因君官网