Dicerna是一家位于马萨诸塞州剑桥市致力于研究使用RNAi治疗疾病的公司。该公司于10月31日宣布与罗氏公司达成研究合作和许可协议,共同开发治疗慢性乙型肝炎的新疗法(使用Dicerna专有的GalXC™RNAi平台技术进行HBV)感染。此次合作将专注于Dicerna在1期临床开发中的治疗性疗法DCR-HBVS的全球开发和商业化。双方的合作还包括利用两家公司的技术平台发现和开发针对多种其他与慢性乙型肝炎感染相关的人类和病毒基因的疗法。

Dicerna是一家位于马萨诸塞州剑桥市致力于研究使用RNAi治疗疾病的公司。该公司于10月31日宣布与罗氏公司达成研究合作和许可协议,共同开发治疗慢性乙型肝炎的新疗法(使用Dicerna专有的GalXC™RNAi平台技术进行HBV)感染。此次合作将专注于Dicerna在1期临床开发中的治疗性疗法DCR-HBVS的全球开发和商业化。双方的合作还包括利用两家公司的技术平台发现和开发针对多种其他与慢性乙型肝炎感染相关的人类和病毒基因的疗法。

日前,罗氏(Roche)旗下基因泰克(Genentech)公司宣布了Gazyva(obinutuzumab)治疗增生性狼疮肾炎(proliferative lupus nephritis)的最新临床结果。试验达到了主要终点,在接受治疗52周到76周之间,接受Gazyva与标准护理手段联用治疗的患者组中达到完全肾脏缓解的患者比例显着优于对照组。Gazayva还达到了关键性次要疗效终点。这些数据在美国风湿病学院年会上公布。
狼疮性肾炎是系统性红斑狼疮(SLE)的一种严重并且危及生命的表现。它因为肾脏炎症反应而产生,而增生性狼疮肾炎则是最为严重的狼疮性肾炎形式,患者转变为终末期肾病和死亡的风险很高。据估计,每10万人中有24人患有SLE。高达60%的SLE患者伴随狼疮性肾炎,其中25%的患者会发展为终末期肾脏病。在SLE患者中,大约90%是女性,其中来自非洲,亚洲和拉美地区的女性患者数量大约是白人女性患者数量的2到3倍。目前狼疮性肾炎没有获批的疗法,具有高度未被满足的需求。
Gazyva是一款对抗体Fc片段进行糖基化改造(glycoengineered)的抗CD20抗体,它具有更好的清除组织中B细胞的能力。近年来的科学研究显示,组织中存在的B细胞在狼疮性肾炎中起到重要作用,它们需要被完全清除。Gazyva曾获得FDA批准治疗慢性淋巴细胞白血病,美国FDA已经授予Gazyva突破性疗法认定,用于治疗狼疮性肾炎成人患者。
在名为NOBILITY的随机双盲,含安慰剂对照的2期多中心临床试验中,126名患者接受了Gazyva与标准疗法联用,或安慰剂与标准疗法联用的治疗。试验结果表明,在接受治疗52周到76周之间,Gazyva组中40%的患者达到完全肾脏缓解,对照组的这一数值为18%(p=0.007)。同时Gazyva与安慰剂相比,提高了患者的总肾脏缓解率。在安全性方面,Gazyva没有提高严重不良反应(24%,对照组为29%)和严重感染(6%,对照组为18%)的发生率。
“NOBILITY的结果给予我们很大鼓舞,这意味着Gazyva能够为增生性狼疮肾炎患者提供具有临床意义的益处。”罗氏首席医学官兼全球产品开发负责人Levi Garraway博士说。基因泰克将在2020年启动3期临床试验的患者注册。(生物谷Bioon.com)

日前,基因疗法公司FerGene宣布,基因疗法nadofaragene firadenovec (rAd-IFN/Syn3),在治疗对卡介苗(BCG)响应不佳的晚期高级非肌层浸润性膀胱癌(high grade NMIBC)患者的3期临床试验中,达到主要临床终点。FerGene公司是由Ferring Pharmaceuticals和黑石生命科学(Blackstone Life Sciences)共同创建的基因疗法公司。Nadofaragene firadenovec最初由芬兰基因疗法公司FKD Therapies Oy开发,Ferring Pharmaceuticals在2018年与FKD Therapies Oy达成合作共同开发这一基因疗法,并且将这一资产转给了FerGene公司。
膀胱癌是一种很常见的癌症类型。在全球范围内,每年大概有43万人被诊断出患有该疾病,使其成为全球第九大常见癌症。NMIBC患者的癌细胞位于膀胱内或已长入膀胱内腔,但尚未扩散至肌肉或其他组织中。BCG是治疗这类患者的标准疗法,虽然有效,但是60%接受BCG治疗的患者最终会有复发的情况出现。
Nadofaragene firadenovec是一种基于腺病毒载体的基因疗法,需要每3个月通过导管灌注的方式,将含有干扰素α-2b转基因的腺病毒载体递送至膀胱。当进入膀胱壁细胞后,通过转染膀胱内皮细胞,导致膀胱产生大量的干扰素α-2b蛋白,进而增强其抗肿瘤活性。这种全新的基因疗法机制可以将患者自身膀胱壁细胞转化为制造多种干扰素的微型工厂,增强机体抵抗癌症的天然防御能力。此前,美国FDA曾授予其快速通道资格,突破性疗法认定和优先审评资格。
在包含157名患者的3期临床试验中,53%的原位癌(CIS)患者(带有或不带有高级Ta或T1乳头状癌),在接受治疗3个月后达到完全缓解(CR),在接受治疗12个月之后仍然有24%的患者达到完全缓解。此外,在高级Ta/T1乳头状癌患者中,73%的患者在接受治疗3个月后达到无高级复发生存(high-grade recurrence-free, HGRF),在接受治疗12个月后,这些患者的HGRF生存比例为44%。
“我们对这些3期临床结果非常满意。Nadofaragene firadenovec表现出良好的完全缓解率和安全性,”FKD Therapeis Oy公司的Nigel R. Parker博士说:“这些数据是我们向FDA递交的申请数据中的一部分。我们期待与FDA继续合作,将这款创新疗法带给对BCG响应不足的膀胱患者。”(生物谷Bioon.com)
2017年10月11日 讯 /生物谷BIOON/ –每100个新生儿中大约有1名新生儿会患上先天性心脏病(CHD),如今CHD依然是导致新生儿因出生缺陷死亡的主要原因,尽管手术和护理技术的提高能够有效提高CHD患儿的存活率,但CHD患者在后期生活中依然面临着较高风险的心脏并发症、其它先天性畸形以及神经发育缺陷等。
图片摘自:Thomas Splettstoesser/Wikipedia/CC BY-SA 4.0
近日,一项刊登在国际杂志Nature Genetics上的研究报告中,来自布莱根妇女医院等机构的研究人员通过研究发现了引发先天性心脏病的新发基因,医学博士Christine Seidman说道,作为一名临床医生,没有什么比父母询问其孩子未来患先天性心脏病风险更严重的了,因此我们必须告诉父母相关的知识。这项研究不仅告诉了我们关于心脏如何产生的基础生物学知识,对于后期临床研究也具有重要的意义,检测引发先天性疾病的遗传突变还能够帮助我们提醒患者和父母有效应对未来可能面临的疾病风险。
这项研究在美国7个研究中心进行,其覆盖了来自2800名CHD患者及父母相关的临床和遗传数据信息,相关研究数据能够帮助研究人员确定哪些遗传突变会从父母遗传给后代,同时还能够帮助研究人员发现儿童基因组中出现的新生突变。研究者发现,某些遗传突变能够从父母传递给后代,同时他们还首次在患儿的基因组中鉴别出了一些新生突变,这些突变主要发生在患其它先天性缺陷疾病或神经发育疾病的CHD儿童中,值得注意的是,研究者还发现相同的基因此前或和自闭症发生直接相关,在某些CHD患儿中自闭症可能是引发这些患儿神经认知问题高风险的主要原因。
本文研究结果或能帮助扩展当前研究人员对CHD新型遗传检测试剂盒的开发,这或能明显改善父母在孕育下一个孩子时的疾病再现风险;研究者Seidman指出,未来我们还将继续深入进行研究,相关研究表明,大约有400个基因会诱发CHD发生,基于此,对于婴儿机体全基因组进行测序或许要比特殊突变的筛选更加有效。
最后研究者表示,全基因组测序或许是一种最有效的方法来帮助检测引发新生儿缺陷的遗传突变,这还有可能影响儿童的短期和长期治疗及护理。(生物谷Bioon.com)
原始出处:
Sheng Chih Jin,Jason Homsy,Samir Zaidi, et al. Contribution of rare inherited and de novo variants in 2,871 congenital heart disease probands. Nature Genetics (2017) doi:10.1038/ng.3970





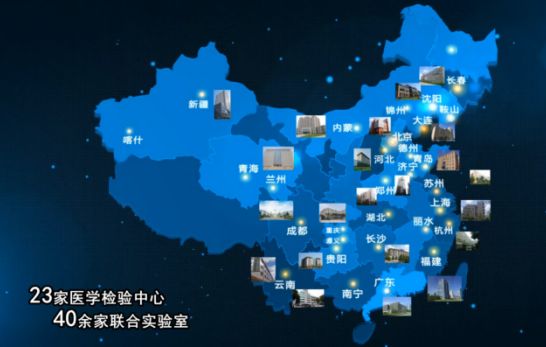
10月27日下午,众多医疗界专家学者、产业基金、行业大咖以及重量媒体齐聚北京318艺术园区紫云轩,共同见证了誉衡基因万人肿瘤免疫方舟计划发布会的隆重举行。
随着誉衡基因CEO金鸽女士、北京军区总医院北京军区儿科研究所所长封志纯教授、誉衡基因新药专家顾问千人计划专家吕强博士、济南军区总医院副院长王宝成教授及北大国际医院副院长梁军教授共同点亮启动仪式的灯光,誉衡基因的万人肿瘤免疫方舟正式起航。
发布会现场誉衡基因特邀临床专家王宝成教授、誉衡基因首席数据科学家美国匹兹堡大学鲁兴华教授分别进行了各自领域的主题分享,誉衡基因CTO赵国栋博士对万人肿瘤免疫方舟计划进行全方位解读。
同时,誉衡基因还与誉衡生物签署肿瘤免疫药物PD-1抗体(GLS-010注射液)临床试验及伴随诊断产品开发战略合作协议、与零氪科技签署肿瘤免疫大数据平台共建战略合作协议,基因、生物药,大数据珠联璧合,打造肿瘤免疫的最强品牌。
业内首创!方舟计划实现技术创新
肿瘤,尤其是恶性肿瘤,具有隐蔽性高及死亡率高等特点。不仅是寻常老百姓会谈癌色变,对于医学界来说癌症治疗也是一道难题。随着大众生活水平的提升和对医疗健康日益重视,基因检测市场迎来了发展机遇。但如何实现精准医疗,通俗点说也就是如何精准地找到各类肿瘤患者能够获益的靶向药物或免疫药物,是当前肿瘤治疗市场的痛点。
誉衡基因敏锐地捕捉到了这一痛点,深耕肿瘤精准免疫治疗检测方向。誉衡基因的基因检测(或者辅之以其他检测)能够对肿瘤特征和免疫状态特征进行精准分类,从而对人群精确分组,精确定位潜在的获益人群和有可能出现快速进展、耐药的人群等等,使患者能够从治疗层面和经济层面获益,也为精准治疗迈向免疫治疗领域做出贡献。另一方面,誉衡基因不局限于基因检测数据的积累,首次提出通过与临床表型数据及药物疗效随访数据相结合,探索肿瘤免疫治疗的评价标准及评价体系,最终实现临床转化,协助临床医生和患者制定合适的治疗方案。
基因+大数据,誉衡基因专注临床转化
在肿瘤领域,临床表型数据以及数据平台不可或缺。在大数据平台合作上,誉衡基因与中国最大的肿瘤大数据公司零氪科技(Linkdoc)达成战略合作,基于 “链接数据,连接医生”的理念,帮助医生和专家建立真实世界的肿瘤数据库,从而在医疗领域实现数据的真正价值。在肿瘤免疫和基因大数据层面,LinkDoc下承国内领先的临床数据融合系统和国内知名的组学数据技术服务商聚道科技(GeneDock)合作,上接誉衡基因的肿瘤医生和医院渠道。三方从大数据平台、临床表型数据和基因数据的多维数据聚合,帮助医生将患者的表型和基因型集合,借助具有可视化、弹性计算和可控共享的云计算平台,将数据转化为临床科研价值和患者诊疗方案。是不可多见的数据资源池的合作落地模式。
情怀践行,誉衡基因携使命前行
万人肿瘤免疫方舟计划是一项需要人力物力财力各方面巨大支撑的项目,无论是科学角度还是投资角度,这项工程都极具价值。誉衡基因立足于造福肿瘤患者的出发点,依托于誉衡基因特有的基因检测技术和多维度检测平台,建立中国人特有的肿瘤分层和免疫分层模型,从而更好地帮助患者精准用药以及预后判断。除此之外,誉衡基因的产品体系还提供一整套肿瘤精准诊疗检测方案,从化疗药物敏感性及毒副作用检测,靶向药物的伴随检测到精准免疫治疗的伴随检测,誉衡基因始终围绕精准医学为出发点,使得患者最大可能地选择合适的用药方案,避免严重的不良反应,使治疗效果最大化。
万人肿瘤免疫方舟计划对于誉衡基因而言是一个全新的起点,专业、专心、专注地做好每一件事,让患者感受最暖心的体验。誉衡基因将身负不忘初心的使命砥砺前行,做最好的产品,做最有责任心的企业。 (生物谷 bioon.com)

罗氏(Roche)旗下基因泰克(Genentech)公司宣布,美国FDA批准了Alecensa(alectinib)的补充新药申请(sNDA),用于一线治疗具有间变性淋巴瘤激酶(ALK)阳性的转移性非小细胞肺癌(NSCLC)患者。
据美国癌症协会估计,2017年美国有超过22万人将被诊断为肺癌,其中NSCLC占所有肺癌的85%。 据估计,美国约有60%的肺癌病例在诊断的时候已经进入晚期。在美国,约有5%的NSCLC患者为ALK阳性,这一类型的肺癌常见于有轻微吸烟史或不吸烟的年轻人。这些患者急需一款有针对性的治疗来缓解疾病。
Alecensa就是这样一款颇具潜力的肺癌药物。作为ALK抑制剂,Alecensa通过抑制ALK的磷酸化来抑制它的信号激活通路。Alecensa曾被批准用于治疗ALK阳性且使用克唑替尼(crizotinib)无效或不耐受的转移性NSCLC患者。已有研究表明Alecensa能够抑制多种突变ALK,其中有些突变导致肿瘤细胞对已有的标准疗法克唑替尼产生抗性。此外,Alecensa能够穿过血脑屏障进入大脑组织中并存留,对转移到大脑组织中的癌细胞也有显着的杀伤作用。基于临床试验的优秀结果,FDA为其用于一线治疗的申请颁发了突破性疗法认定和优先审评资格。
此次Alecensa作为一线疗法的获批是基于一项3期临床试验ALEX的结果。这是一项开放标签、随机、主动控制的多中心研究,评估了Alecensa与克唑替尼相比,治疗ALK阳性NSCLC患者的疗效和安全性,他们先前没有接受过针对转移性疾病的系统治疗。这些患者按1:1的比例被随机分配接受Alecensa或克唑替尼治疗,主要疗效终点为由研究者评估确定的无进展生存期(PFS)。其它疗效终点还包括由独立审查委员会(IRC)评估确定的PFS、中枢神经系统(CNS)进展时间、客观缓解率(ORR)、缓解持续时间(DOR)和总生存期(OS)。
结果显示,Alecensa显着降低了疾病恶化或死亡风险达47%(HR=0.53, 95%CI: 0.38, 0.73, p<0.0001);接受Alecensa治疗的患者中位PFS为25.7个月(95%CI: 19.9,不可估计),而对照组为10.4个月(95%CI: 7.7, 14.6)。该研究还显示,Alecensa显着降低了癌症在大脑或CNS中的扩散风险达84%(HR=0.16, 95%CI: 0.10, 0.28, p<0.0001)。 此外,Alecensa的安全性与之前的研究一致。
“我们的目标是开发能显着改善治疗标准的药物,”基因泰克首席医学官兼全球产品开发负责人Sandra Horning博士表示:“在我们的关键研究中,与克唑替尼相比,Alecensa显着延长了人们没有疾病恶化的时间,并显示出癌症扩散到大脑的风险显着降低。”
“ALK阳性肺癌常见于年轻人,他们在诊断时往往有更晚期的疾病,带来一系列独特的挑战,”肺癌幸存者、Bonnie J. Addario肺癌基金会(ALCF)创始人Bonnie J. Addario女士说:“我们为Alecensa获批这样的进展喝彩,这为此类肺癌患者提供了一个新的初始治疗选择。”
我们祝贺基因泰克取得的成绩,也期待这一新药能为更多肺癌患者带去治疗希望。(生物谷Bioon.com)
在得知怀上的第二个孩子也患有先天性耳聋后,杜绍辉和妻子无奈决定流产。 国论文网 http://www.xzbu.com/3/view-7292032.htm
夫妇二人的第一个孩子就患有先天性耳聋,为了给孩子治病,住在山东的两个人要经常跑到北京来。杜绍辉夫妇两人的听力并没有什么问题,但他们都是耳聋基因的携带者,这意味着,他们的孩子,有25%的概率患有先天性耳聋。
他们渴望要一个听力正常的孩子―这可以理解,而且,他们想在怀孕前就知道孩子是否健康。
为了能生育一个健康的孩子,杜绍辉夫妇来到解放军总医院生殖中心,医生告诉他们,利用最新的试管婴儿技术可以阻断家族遗传性耳聋。它的核心名为“多次退火环状循环扩增技术”(MALBAC技术),是目前最先进的全基因组扩增技术,可以将健康的胚胎辨别出来,然后再将该胚胎植入母体。
杜绍辉夫妇接受了医生的建议。经过漫长的孕期,2015年12月10日,他们得到了一对健康的双胞胎。这是中国首例综合运用MALBAC技术、胚胎种植前基因诊断(PGD)和胚胎植入前遗传学筛查(PGS)的案例。
在受孕之前就检测出一个胚胎究竟能否发育成健康的胎儿,本质上是一场关于时间的争夺战。
做试管婴儿首先要将受精卵做体外培养,受精卵分裂分化以后,形成的细胞群被称作胚胎。这些以后会变成胎儿的胚胎并不能离开母体很久,在其发育一段时间后,会植入母体。
基因检测公司拿到多份胚胎以后,需要对胚胎做基因测序,并快速判断哪些胚胎能够发育成健康的胎儿,而哪些是要被舍弃的―为杜绍辉夫妇做基因测序的亿康基因最初拿到了17份胚胎,它必须马上辨别出哪些胚胎不带有耳聋基因,然后将没有缺陷基因的胚胎及时移植到母体子宫中。
一个受精卵会在36小时后分裂为2个细胞,72小时后分裂成16个细胞,等到了第5天的时候就会变成100多个细胞。通常情况下,基因检测公司会在这些培养了3至5天的胚胎上取用1至3个细胞―这个数量听上去少得可怜,但早期胚胎有着强大的分裂分化能力,并不会因为几个细胞的缺失导致胎儿有缺陷。
细胞取出后将被裂解,检测者会分离出其中的DNA。虽然每个细胞里有23对染色体,每条染色体上有一个DNA分子,但是这个数量对于基因检测来说,实在是太少了。因此,单细胞的基因测序或者少量细胞的基因测序面临的一个比较重要的问题就是如何快速、准确地复制DNA。
按照细胞的分裂速度,要获得满足基因检测需求量的DNA,恐怕要等上15至20天,但是检测者现在要让时间缩短至几个小时。因此,基因检测公司让复制DNA的环节脱离细胞这个载体,让DNA像病毒一样快速拷贝。
病毒不会裹上笨重的蛋白质做自我复制,而是直接快速复制,这个方式更快。同样的,当基因公司在胚胎上取出细胞以后,也会分离出其中的DNA,单独复制,即全基因组扩增。通过这样的办法,基因检测公司3至4小时后就可以获得足量的DNA。
实际上,在MALBAC技术的概念2013年首次出现在《科学》杂志上之前,很多技术已经实现了较快速度的全基因组扩增。但是在复制的过程中,DNA上不同片段的扩增速度并不相同,速度快的部分会抑制旁边基因片段的扩增。这会导致致病基因可能被淹没在“背景噪音”中,检测结果也会因此受到影响。
“如果用百米赛跑来类比基因扩增,那年轻人就是复制快的片段,复制得慢的就是老太太。如果对扩增的进程没有控制,那最后在终点的地方就看不见老太太在哪儿了。形象一点说,MALBAC技术就是让年轻人拉着老太太一起跑。”这一扩增技术的开发者之一陆思嘉对《第一财经周刊》说。
实现基因扩增的一致性是MALBAC技术的核心,它可以让先扩增的片段形成一种环状结构,一旦形成了这样的结构,先扩增的片段就“知道”自己在后面的扩增中应该慢一些,使整个基因组同步扩增。
环状结构还能防止扩增过程中发生错误。一旦在复制过程中出现了微小的错误,在接下来的指数复制过程中,错误副本的信息也会被快速复制,错误将会不断放大。但环状结构能将副本锁定,让副本没有办法复制自己,因此所有副本只能来源于母本,从而实现更精确的复制。
不过,尽管可以让母亲在妊娠前就能确定是否可以怀上没有基因缺陷的胎儿,但由于这种检测方法对胚胎多少有损伤,目前它在国内外还鲜少应用。基因公司目前尝试的解决办法是,在胚胎的培养液中收集凋亡的细胞,然后将细胞中的DNA提取出来做基因检测。这些细微的信号很可能有助于肿瘤的早期诊断,甚至可以帮助监控后期用药的有效性。
“基因检测目前已经从末端的疾病治疗,逐步走向前端的基因检测和预防了。”华大基因执行总裁尹烨对《第一财经周刊》说。
居住在深圳的林文丽做产前诊断时,因为怕疼以及担心感染,并没有选择传统的羊水穿刺等方法,而是以999元的促销价做了无创产前基因检测。类似的母婴医疗服务是基因检测技术走向前端的代表。华大基因的无创产前基因检测在全球已有100万用户,它也是最先将高通量基因技术应用到临床检测的中国机构。
这种方法只需采集5毫升的孕妇外周血,从中提取游离DNA,就可以通过高通量测序技术―它让基因检测的成本大大下降―结合生物信息分析,计算出胎儿是否患唐氏综合征等遗传性疾病的风险。
一周后,林文丽拿到了医院的检测报告。她的宝宝很健康。现在,孩子已经4个月大了。
2015年1月,美国总统奥巴马在国情咨文中提出了“精准医学计划”,所谓“精准医学”,是一种将个人基因、环境与生活习惯差异考虑在内的疾病预防与处置的新兴方法。“基因组数据与临床数据的结合,已经能形成完整的实时、全景的医疗体系了,可能最快未来2至3年内,就能实现个体化的精准医学和健康管理。”尹烨说。在出生缺陷、肿瘤防治等方面,华大基因也已开展精准医学计划。
由于每个人的情况不同,他们患病后理应也采取不同的治疗方法。然而目前的情况是,治疗每一种疾病的药物几乎都默认是适合大多数患者的。
哥本哈根大学教授Torben Hansen在代谢疾病方面已经和华大基因合作3年多了,他同时也是诺和诺德基础代谢研究中心代谢基因组学的负责人。
其中,就有单基因糖尿病。它是一种特殊的糖尿病类型,不属于通常所说的一型或二型糖尿病,但往往会被误诊为后者。而如果采用针对后者的注入胰岛素的治疗方法,不但起不到效果,有时甚至会加重病情或引起其他器官损伤。这种情况下,就需要提前做基因检测。Hansen和华大目前已经开发出应用基因芯片筛查诊断单基因糖尿病的方法,价格只有300美元。
这种方法也正尝试应用在母婴检测上。“我们发现许多孕妇在怀孕期间患上糖尿病,但有的生完孩子会好转,有的则依然患有糖尿病。”Hansen对《第一财经周刊》说。他跟踪了380名妊娠糖尿病患者,发现后一种情况的比例大约为11%。
结合单基因糖尿病的芯片检测,Hansen在大多数依然患有糖尿病的妇女的基因中,发现了总计18种基因突变,正是这些突变增加了妊娠糖尿病患者后期患上糖尿病的概率。“如果孕妇事先对自己的基因状况有了解,就可以采取适当的风险控制和干预措施。”
15年前,美国遗传学家Francis Collins曾预测,到2020年,科学家将可以使用“定制药物”来治疗乳腺癌、心脏病等疾病。而到2030年,基因药物会将发达国家居民的平均寿命延长到90岁。
在美国等发达国家,已经出现一种名为遗传咨询师的新职业,人们获得了全基因组的检测结果以后,可以通过遗传咨询师的一些建议和指导,再有针对性地定期检测。
未来,或许90%以上的疾病将不再通过医院来解决,因为早在我们出生前―甚至刚刚形成胚胎时,就能通过基因检测“知道”自己今后最有可能患什么病,以及应该怎么预防。而即使患上这种疾病,也能获得更适合自己身体情况的治疗方法―所有的一切都是个人化、精准化的。
当然,这一切都要建立在大量的基因数据以及对这些数据强大的解读能力上―如果真能实现,说不定以后“摇一摇”就能找到和你基因匹配的人呢。
转载请注明来源。原文地址:http://www.xzbu.com/3/view-7292032.htm
导读:基因治疗(Gene Therapy)是指将外源基因导入靶细胞,以纠正或补偿因基因缺陷或基因表达异常引起的疾病(图1)。基因治疗技术创新和临床试验在近几年如雨后春笋般涌现,多项基因治疗项目相继在美国、欧盟、中国等国家获得批准上市。基因治疗的对象也已经由单基因遗传病逐步拓展到恶性肿瘤、感染性疾病、心血管疾病、自身免疫性疾病、代谢性疾病等重大疾病。本文简要回顾近年基因治疗的国内外研究进展,与读者分享。
美国对基因治疗领域的资助持续增加。2014年6月,美国国家卫生研究院(NIH)资助2500万美元,用于传染性疾病(疟疾和流感)的基因治疗研究。2015年底,美国白宫发布《美国创新新战略》,明确把包括基因治疗在内的精准医疗作为未来发展战略,未来10年将投入48亿美元重点资助。
欧洲对基因治疗领域的资助也持续增加。欧盟研究框架建立了专门基因治疗资助计划——CliniGene(2006-2011)计划,出资6580万欧元推动欧洲临床基因治疗的发展。“地平线2020”是欧盟最大的科研创新框架计划,其中基因治疗获得4910万欧元资助。2016年6月,法国政府宣布投资6.7亿欧元启动基因组和个体化医疗项目,项目为期10年,将重点开展基因组学、个体化医学、基因治疗等研究。
此外,跨国的制药巨头对基因治疗领域投入了大量资金。2014年12月辉瑞(Pfizer)与美国罕见病基因治疗公司Spark Therapeutics签署合作协议,共同开发B型血友病的基因治疗产品。2015年4月,百时美施贵宝(BMS)与基因治疗领域的领导者——荷兰的生物技术公司uniQure签署了一份高达10亿美元合作协议,共同开发重组腺相关病毒(AAV)表达载体的心血管基因治疗药物。2016年,百健公司宣布投资20亿美元与宾夕法尼亚大学以及REGENEXBIO公司合作开发基于AAV载体的基因治疗药物。
2.基因治疗研究开发和产业化已取得重要进展
截止到2017年4月,全球在Clinical Trial网站上登记了2463项基因治疗临床试验方案(图2),其中进入Ⅱ/Ⅲ期的基因治疗临床试验方案近500项,共有7个基因治疗产品已经在美国、欧盟、中国等国家上市。2012年7月,欧洲药品管理局(EMA)在欧盟范围内批准由uniQure公司研发的以AAV为载体的基因治疗药物Glybera上市,用于经严格限制高脂肪饮食却仍然发生严重或反复胰腺炎发作的脂蛋白脂酶缺乏症(LPLD)患者的治疗。此外,2014-2015年,Calledon、Spark Therapeutics和Bluebird Bio公司的产品MYDICAR、SPK-RPE65和LentiGlobin获得FDA批准上市。2016年5月,EMA批准了葛兰素史克(GSK)的药物Strimvelis用于治疗罕见病腺苷脱氨酶缺陷所致重症联合免疫缺陷症(ADA-SCID),这是首个上市的体外基因修饰的造血干细胞基因治疗产品。
▲ 图2-全球主要国家的基因治疗临床试验方案分布统计
2017年8至11月,基因治疗领域迎来了4个里程碑事件。8月,FDA在全球率先批准诺华公司的CAR-T细胞治疗产品Kymriah上市,用于治疗复发或难治性急性淋巴细胞白血病。10月,FDA的专家小组全票支持批准Spark公司研发的AAV为载体的基因治疗药物AAV-RPE65(Luxturna),用于治疗RPE65基因缺陷引起的视网膜疾病,该药可以阻止患者向完全失明发展,有效地改善了患者的光感和视觉;同月,FDA批准了Kite Pharma公司的CAR-T基因治疗产品Yescarta上市,用于治疗成人复发/难治性大B细胞淋巴瘤;11月,美国Sangamo Therapeutics公司利用锌指核酸酶(ZFN)技术实现人类历史上首次患者体内基因组的编辑。
3.基因治疗研发的主要发展趋势
(1)重组腺相关病毒(AAV)载体基因治疗。重组AAV源于非致病的野生型腺相关病毒,具有安全性好、宿主细胞范围广、免疫源性低、在体内能长时间表达外源基因等特点,是最有前途的基因治疗载体之一。2017年11月,《新英格兰医学杂志》发表了一项临床试验结果:重组AAV基因治疗成功延长了15名身患严重遗传性疾病-1型脊髓性肌萎缩症(SMA1)患儿的生命,让他们有机会重获健康。此外,还有多种以AAV为载体的基因治疗药物正在开展II期或III期临床试验,其治疗对象几乎都是单基因遗传的罕见病,包括血友病A型和B型、地中海贫血、脊髓性肌萎缩症(SMA)等。
(2)慢病毒载体(LV)基因治疗。LV主要用于体外转基因研究。LV具有可感染非分裂细胞、转移基因片段容量较大、目的基因表达时间长、不易诱发宿主免疫反应等优点,是应用前景比较良好的病毒载体。Strimvelis、Kymriah和Yescarta等基因治疗药物所用的载体都是LV。
(3)基因修饰的溶瘤病毒基因治疗。携带治疗基因的溶瘤疱疹病毒、溶瘤腺病毒、新城疫病毒等治疗恶性肿瘤发展前景良好。近年来,跨国药企纷纷布局溶瘤病毒项目。安进、辉瑞、阿斯利康等跨国药企都参与了溶瘤病毒项目。如2011年,安进公司以10亿美元收购了专业的基因治疗公司BioVex公司(主打产品为GM-CSF修饰的疱疹病毒OncoVEXGMCSF);2015年10月,FDA批准该产品上市,用于治疗黑色素瘤。
(4)CRISPR/Cas9等基因编辑技术用于基因治疗。近年来,基因编辑技术迅猛发展,正在革命性地改变整个生物技术领域。与传统基因治疗方法相比,基因编辑技术能在基因组水平上对DNA序列进行改造,从而修复遗传缺陷或者改变细胞功能,使得彻底治愈白血病、艾滋病和血友病等恶性疾病成为可能。基于锌指核酸酶(ZFN)基因编辑技术的两种抗艾滋病和一种B型血友病产品已经进入临床阶段。CRISPR/Cas9基因编辑技术对特定基因组DNA的定位更加精准,成本更加低廉,正在成为基础研究和临床应用的主流技术(图3)。最近,美国、英国、日本政府都放开了对基因修饰人胚胎的限制,开展了一系列基因编辑技术修饰胚胎,从而对先天性遗传病进行基因治疗的研究。
▲ 图3-使用基因剪刀(CRISPR)修改基因组DNA
4.国内科技发展现状
我国政府对基因治疗等相关的基础研究、目标产品及关键技术的研发非常重视,“十一五”和“十二五”期间,863计划对重大疾病的基因治疗专门立项,参加单位包括二十多家国内从事生物治疗研究的优势单位,10余家国家重点实验室和多家专业的公司,储备了一批具有自主知识产权的生物治疗相关技术和项目。同时,973计划也资助了基因治疗的基础研究和应用基础研究项目,取得了多项重要的研究成果,论文发表在Nature、Science及Cell等国际顶级期刊上。
我国基因治疗研究及临床试验与世界发达国家几乎同期起步,主要以肿瘤、心血管病等重大疾病为主攻方向。我国已经有2个基因治疗产品上市,主要用于头颈部的恶性肿瘤治疗。此外,我国还有近20个针对恶性肿瘤、心血管疾病、遗传性疾病的基因治疗产品进入了临床试验,其中在Clinical Trial网站上登记的基因治疗临床试验方案有70个,占亚洲基因治疗临床试验方案总数的46.7%(图4)。如华中科技大学等研发的肿瘤基因治疗产品ADV-TK对肝癌和难治复发性头颈癌都具有显著疗效,正在开展多中心的Ⅲ期临床试验。中山大学等研发的重组人内皮抑素腺病毒注射液(E-10A)治疗晚期头颈鳞癌效果较好,目前该产品在中国和北美地区开展Ⅲ期临床试验研究,发展前景好。军事医学科学院研发的治疗心肌梗塞的基因治疗产品Ad-HGF注射液进入II期临床试验,与人福医药公司合作研发的治疗肢端缺血的基因治疗产品重组质粒-肝细胞生长因子注射液获得了Ⅲ期临床批文。成都康弘生物研发的治疗头颈部肿瘤的工程化溶瘤腺病毒基因治疗制剂KH901已完成II期临床试验。四川大学等研发的具有抗肿瘤血管生成的基因治疗产品EDS01正在开展Ⅱ期临床试验研究。
▲ 图4-亚洲主要国家的基因治疗临床试验方案分布统计
此外,我国还有40多项重大疾病的基因治疗制剂处于临床前研究阶段,上百个项目处于实验室研究阶段。
我国在基因编辑治疗领域也处在世界前列。2015年4月,中山大学的黄军就团队首次在人类胚胎细胞中进行了基于CRISPR技术的基因编辑操作,并于2017年9月再次报道利用单碱基编辑系统在人类胚胎基因组精确修复特定类型的单碱基突变(地中海贫血症HBB-28)。2016年,四川大学华西医院在国际上率先开展了CRISPR/Cas9基因编辑技术治疗肺癌的临床研究。
虽然基因治疗的研究已经取得了较显著进展,但仍然存在一些安全性及伦理问题,值得进一步研究。临床试验应严格按照获得批准的技术规程与标准操作,重视基因治疗技术的安全性,充分保障病人知情权,保护病人隐私。尽管基因治疗研究还存在很多待解决的技术难题以及一些法律或伦理等方面的问题,但这并不妨碍人们对其治愈重大疾病寄予厚望。