2019年5月18日讯/生物谷BIOON/—要听妈妈的话:西兰花是有好处的。长期以来与降低癌症风险有关的西兰花和其他十字花科蔬菜—-包括花椰菜、卷心菜、羽衣甘蓝、球芽甘蓝和无头甘蓝—含有一种让一个已知在多种常见人类癌症中发挥作用的基因失活的分子。
在一项新的研究中,来自美国哈佛医学院、波士顿儿童医院、西奈山伊坎医学院、南卡罗来纳大学、中国台湾中央研究院、国立台湾大学、浙江大学医学院、意大利都灵大学、澳大利亚莫纳什大学和印度海德拉巴语调研究实验室的研究人员证实利用在西兰花中发现的这种成分靶向这个称为WWP1的基因抑制易患癌症的实验室动物中的肿瘤生长。相关研究结果发表在2019年5月17日的Science期刊上,论文标题为“Reactivation of PTEN tumor suppressor for cancer treatment through inhibition of a MYC-WWP1 inhibitory pathway”。论文通讯作者为哈佛医学院的Pier Paolo Pandolfi博士。
Pandolfi说,“我们找到了一个新的重要参与者,它推动了一种对癌症产生至关重要的途径。这种参与者是一种酶,可以用在西兰花和其他十字花科蔬菜中发现的一种天然化合物来加以抑制。这条途径不仅作为肿瘤生长控制的调节剂,而且作为一种我们能够利用治疗方案加以靶向的致命弱点。”
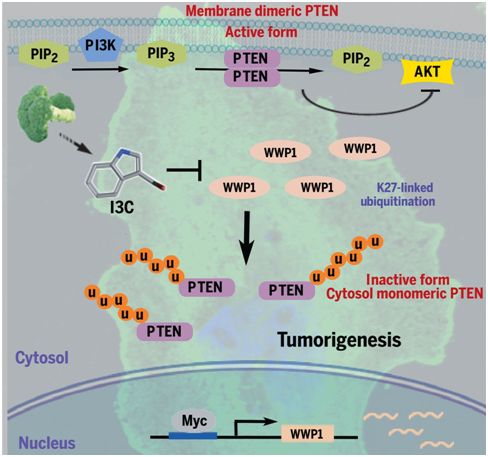
作为一个众所周知的强效的肿瘤抑制基因,PTEN是人类癌症中最常发生突变、缺失、下调或沉默的肿瘤抑制基因之一。某些遗传性PTEN突变可导致以癌症易感性和发育缺陷为特征的综合征。不过鉴于这个基因的完全丧失会触发一种不可逆转的强效的安全机制来阻止癌细胞增殖,这个基因的两个拷贝(人类的每个基因有两个拷贝,一个拷贝来自父本,另一个拷贝来自母本)很少同时受到影响。相反,肿瘤细胞表现出较低水平的PTEN,这就提出了一个问题,即将癌症环境中的PTEN活性恢复到正常水平是否能够激活这个基因的肿瘤抑制活性。
为了找到答案,Pandolfi及其同事们鉴定出调节PTEN功能和激活的分子和化合物。Pandolfi团队在易患癌症的小鼠和人类细胞中进行了一系列实验后,发现一种称为WWP1的基因—也已知它在癌症产生中发挥作用—产生一种酶来抑制PTEN的肿瘤抑制活性。如何让抑制PTEN的这个酶失活?通过分析这种酶的物理形状,他们认识到一种小分子—正式命名为吲哚-3-甲醇(indole-3-carbinol, I3C),即一种在西兰花和其他十字花科蔬菜中发现的成分,可能是抑制WWP1致癌作用的关键。
当Pandolfi及其同事们通过给易患癌症的实验室动物提供I3C来测试这一想法时,他们发现这个在西兰花中天然存在的成分让WWP1失活,从而解除WWP1对PTEN的肿瘤抑制活性的抑制。
但是,先别去农贸市场;论文第一作者、Pandolfi实验室成员Yu-Ru Lee博士指出,你必须每天吃将近6磅的球芽甘蓝—并且在那里吃未经烹煮的球芽甘蓝—才能获得潜在的抗癌益处。这就是Pandolfi团队正在寻求其他方式来利用这些新知识的原因。他们计划进一步研究WWP1的功能,最终目标是开发更有效的WWP1抑制剂。
Pandolfi说,“使用CRISPR技术或I3C对WWP1进行遗传或药物灭活可能能够恢复PTEN的功能并进一步释放它的肿瘤抑制活性。这些研究结果为长期寻求用于癌症治疗的肿瘤抑制基因再激活方法铺平了道路。”(生物谷 Bioon.com)
参考资料:
Yu-Ru Lee et al. Reactivation of PTEN tumor suppressor for cancer treatment through inhibition of a MYC-WWP1 inhibitory pathway. Science, 2019, doi:10.1126/science.aau0159.
Ramon Parsons. Restoring tumor suppression. Science, 2019, doi:10.1126/science.aax5526.
 基因君官网
基因君官网