
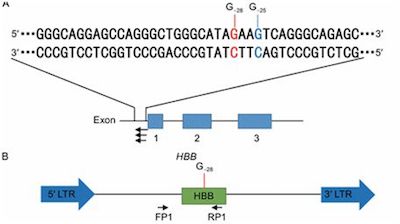
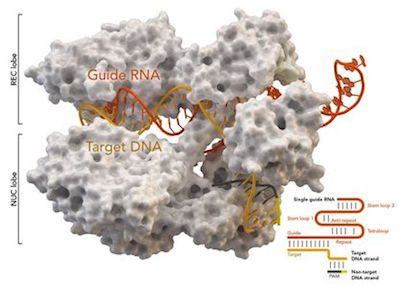


相关新闻阅读:
2017年7月份4篇Nature、1篇Science、1篇Blood、2篇Cell及其子刊关注CRISPR/Cas重大突破





相关新闻阅读:
2017年7月份4篇Nature、1篇Science、1篇Blood、2篇Cell及其子刊关注CRISPR/Cas重大突破

衰老是人类无法逃避的命运,寻找不老药也成了千百年来人们追逐的梦想。我们相信,青春的秘诀或许就写在我们的DNA里。这样一来,我们就能够解释,为什么有些人总是要老得慢一点。
自DNA的双螺旋结构得到解析以来,分子生物学取得了堪称飞跃的发展。如今,各种用来分析基因的工具终于让我们得以一窥生命密码的奥秘,从中寻找长生的线索。中科院蔡时青教授就是投身这一领域的专家,今日,他的团队发表了一项重量级的研究,找到了两条能够调控衰老速率的基因。这项研究发表在了顶尖学术刊物《自然》上。
在研究中,科学家们指出在过去的30多年里,我们对于长寿的调控机理有了广泛的了解。我们知道衰老无法避免,绝大部分人在衰老的过程中,身体机能总是逐渐衰退。然而,有一些人却会“一夜白头”,在短期内出现身体机能的断崖式滑坡;另一些人却能极好地将身体机能维持在一个健康水平,直至去世。这当然与生活、饮食习惯有关。但这种现象是否也受基因的调控呢?
先前的研究证实了这一假设,而且结果令人震惊——“长生”与“不老”这两件事,之间竟然没有关联!一些全基因组水平上做的分析表明,那些让人长寿的遗传变异,和让老人维持健康的遗传变异,两者之间的联系很少。这或许能解释为何有些老人身体就像年轻时那样,依旧非常健康。
蔡时青教授的团队想要弄清背后的生物学机理。在研究中,他们选择线虫作为模式生物,这有着几重原因。首先,线虫是抗衰老领域的经典模型,我们对它的寿命调控机制有着很深的理解;其次,线虫也存在人群内观察到的现象——部分个体的机能(如性能力、摄食能力、以及运动能力)衰退速率极为缓慢。研究人员们相信,如果能阐明线虫“不老”的秘密,或许就能为人类的抗衰老带来启迪。
研究发现,两条基因上的DNA多态性会影响线虫的生理机能,其中一条叫做rgba-1,编码一种多肽;另一条叫做npr-28,编码一个G蛋白偶联受体。它们都会影响到雄性的性能力衰退,暗示这两条基因在衰老过程中扮演的关键角色。
有趣的是,RGBA-1多肽还能与NPR-28受体相结合,激活下游通路。这条通路也因此对抗衰老有重要意义。那么,这条通路的具体作用机理是什么样的呢?通过进一步分析,蔡时青教授团队发现,源于神经胶质的RGBA-1 所激活的NPR-28能作用于5-羟色胺能神经元神经元和多巴胺能神经元,起到加速老化的作用。这一通路也涉及到基于SIR-2.1激活的线粒体未折叠蛋白反应,从而调控衰老。
总结来说,蔡时青教授团队发现在胶质神经元中,神经肽介导的信号通路能调控线虫的衰老速度。至于类似的通路是否也同样影响了人类寿命,则还需要更多的研究来确定。
如果我们能根据这项研究开发出“不老药”,延缓人们的衰老,那将是一件极有意义的事。目前,全球人口正在快速老龄化,随之而来的是猛涨的社会医疗支出。在人类活得更久的同时,还能让人类活得更健康,这就是蔡时青教授团队这项研究的潜在意义。(生物谷Bioon.com)
2017年11月23日 讯 /生物谷BIOON/ –最近,一项刊登在国际杂志Cancer Cell上的研究报告中,来自英国利兹大学的研究人员通过研究发现了常见类型膀胱癌的“基因特性”,或为后期开发新型膀胱癌靶向性疗法提供新的思路。文章中,研究者主要对非侵袭性的膀胱癌肿瘤进行了研究,这类肿瘤常常位于膀胱内壁组织,其并不会扩散到膀胱肌肉中。
图片来源:www.medscape.com
据英国国家医疗服务体系数据显示,每年在英国就有1万名新发膀胱癌患者,其中超过一半都是非侵袭性膀胱癌患者。研究人员发现,这些非侵袭性的膀胱肿瘤中或许存在两种遗传突变体/亚型。所有的非侵袭性膀胱癌患者都能利用相类似的方法进行治疗,但科学家们认为,通过理解每一种亚型癌症的基因突变特征,未来或许能开发出更多靶向性的治疗手段。
研究者Margaret Knowles教授表示,如今我们在膀胱癌的一种遗传亚型肿瘤中鉴别出了一种新型的易感性,我们的目的就是观察是否能够开发出实验性的化合物来利用这种肿瘤易感性有效杀灭癌细胞。尽管这些肿瘤通常情况下并不具有致命性,但其会频繁复发,而且患者也需要长期的癌症侵袭性监测及频繁手术过程。
文章中,研究人员鉴别出了单一肿瘤的特殊分子特性,这或为后期开发新型个体化疗法来有效治疗膀胱癌提供了新的思路;研究者发现,肿瘤中存在的很多遗传突变都会感染肿瘤抑制基因发挥作用,而在正常情况下肿瘤抑制基因会抑制癌症的发生。诱发肿瘤产生的遗传缺陷并不会遗传,但却会在机体一生中积累,而且主要是通过大量暴露于一些环境因子所产生,包括吸烟等。
Kathryn Scott博士指出,这项研究或能帮助我们改变常规治疗膀胱癌的思路,个体化癌症疗法或许就是未来膀胱癌的一种治疗选择;如果我们能清楚理解肿瘤中具体的遗传组成,那么就能开发出特殊的疗法来成功治愈膀胱癌患者;通过根据患者需求来制定特殊的疗法,我们就能够完全避免对患者进行不必要的治疗,这样就大大降低了对患者生活质量的影响。
研究者发现,女性群体或许更容易在特殊的肿瘤抑制基因上发生缺陷,来自男性群体的样本中出现缺陷的概率为42%(23/55),而来自女性的样本中出现基因缺陷的概率则为大约75%(20/27)。Knowles教授表示,后期他们还需要进行更为深入的研究来观察为何女性机体容易发生这种遗传缺陷,从而来阐明是否女性群体更容易暴露于一些特殊的致癌因子中,或揭示男性和女性膀胱组织生物学特性的差异。
这项研究中研究人员首次研究了早期膀胱癌发生的遗传特性,尽管目前很多研究都重点对恶性膀胱癌进行了深度研究,但很多泌尿外科手术都涉及到对非侵袭性膀胱癌患者的治疗和监测,因此对早期膀胱癌发生机制的研究对于有效改善患者的治疗效果和预后也至关重要。(生物谷Bioon.com)
原始出处:
Carolyn D. Hurst, Olivia Alder, Fiona M. Platt, et al. Genomic Subtypes of Non-invasive Bladder Cancer with Distinct Metabolic Profile and Female Gender Bias in KDM6A Mutation Frequency. Cancer Cell (2017). DOI: 10.1016/j.ccell.2017.08.005

资讯出处:Researchers validate five new genes responsible for Amyotrophic Lateral Sclerosis
2018年1月8日/生物谷BIOON/—大多数动物物种的繁殖需要一个雌性动物和一个雄性动物之间的交配。但是一些线虫已发进化出了自体受精(selfing, 即自交)的能力。在这些物种中,单个个体能够自体受精并繁殖后代。在一项新的研究中,来自美国马里兰大学、康奈尔大学、加州大学和加拿大多伦多大学的研究人员发现获得自体受精的能力可能导致一种线虫丢失它的四分之一的基因组,包括让雄性精子在交配时具有竞争优势的基因。相关研究结果发表在2018年1月5日的Science期刊上,论文标题为“Rapid genome shrinkage in a self-fertile nematode reveals sperm competition proteins”。
一百万年前,一种被称作Caenorhabditis briggsae的小型线虫进化出通过自体受精进行繁殖的能力。因此,大多数C. briggsae是雌雄同体,同时具有雄性器官和雌性器官。马里兰大学生物学教授Eric Haag及其研究团队专门研究性别进化,长期以来一直在研究C. briggsae,因为它们具有不寻常的繁殖行为。
为了研究自体受精如何影响C. briggsae进化,康奈尔大学分子生物学与遗传学助理教授Erich Schwarz对与C. briggsae亲缘关系最为接近的Caenorhabditis nigoni进行基因组测序。通过比较这两个线虫物种的基因组,这些研究人员发现自体受精的C. briggsae要比C. nigoni少7000个基因。随着时间的推移,C. briggsae失去了它的大约四分之一的基因组。
鉴于这两种线虫主要在繁殖方式上存在差异,这些研究人员猜测从异型杂交(outcrossing,即异交)到自体受精的转换导致了基因丧失。为了证实这一点,他们比较了雄性C. nigoni和雌性C. nigoni中的基因活性,并发现C. briggsae丢失的将近四分之三的基因在雄性C. nigoni中的活性要比雌性C. nigoni中的强。
为了寻找这些丢失的基因中可能存在的与性相关的功能,这些研究人员着重关注一个被称作mss(male secreted short)的基因家族,该基因家族存在于C. nigoni中,但不存在于C. briggsae中。事实上,没有已知的自体受精的隐杆线虫属(Caenorhabditis)物种具有mss基因。根据Haag、Schwarz、前马里兰大学研究生Cristel Thomas和前马里兰大学本科生Rebecca Felde之前开展的研究,mss基因仅在异型杂交的雄性线虫物种中有活性。
这些研究人员利用一种被称作CRISPR的基因编辑工具移除异型杂交线虫物种Caenorhabditis remanei中的4个mss基因。结果,来自缺乏这些mss基因的雄性C. remanei的精子竞争不过来自具有这些mss基因的野生型雄性C. remanei的精子。相反地,当他们将mss基因插入到雄性C. briggsae中时,它们的精子在与来自野生型雄性C. briggsae和野生型C. briggsae雌雄同体的精子的竞争中胜出。
这些研究人员还发现,这些mss基因编码包被着精子细胞表面的短蛋白。总之,这些结果表明,这些mss基因让雄性线虫的精子在交配期间具有竞争优势。
Haag说,“所有的自交物种都失去了mss基因的事实提示着这些对异型杂交的线虫非常有用的基因对不再进行异型杂交的线虫是有害的。我们所看到的是一种物种在进化过程中如何微调它的繁殖行为。”
根据Haag的说法,这种自体受精的线虫物种可能已经失去了这些mss基因,这是因为有竞争力的雄性精子是有害的。在这项研究期间,这些研究人员发现,拥有更强竞争性的雄性精子会使得这种线虫物种的性别比例偏向于产生更多的雄性线虫。这种变化可能使这些线虫的生存处于危险之中,这是因为太多的雄性线虫会减缓线虫群体的增长,而且在野外,这些线虫为了生存必须尽快地繁殖。
根据论文第一作者、Haag团队的生物科学研究生Da Yin的说法,证实具有竞争优势的雄性精子可能对C. briggsae有害的实验正在进行当中。
Yin说,“我们已开始比较具有mss基因和不具有mss基因的C. briggsae群体的增长,这允许我们能够通过筛选来测试mss基因是否可能已从C. briggsae的基因组中清除。我们的猜测是,具有mss基因的C. briggsae群体会因为具有更多的雄性而增长得较慢。”
展望未来,Haag和他的合作者也计划研究mss基因如何让精子产生竞争优势。他们也想筛选剩余的7000个丢失的基因,以便发现它们在C. briggsae中的作用。(生物谷 Bioon.com)
参考资料:
Da Yin, Erich M. Schwarz, Cristel G. Thomas et al. Rapid genome shrinkage in a self-fertile nematode reveals sperm competition proteins. Science, 05 Jan 2018, 359(6371): 55-61, doi:10.1126/science.aao0827
四会合一:2018先进体外诊断行业峰会
如今,癌症的精准医疗已经不是什么神秘又高冷的名词了,在消费级基因检测的推广和各种科普下,不知道点什么“液体活检”“基因测序”“循环肿瘤DNA(ctDNA)”之类的名词可真是有点落伍了。
在科研领域飞速发展的同时,临床医生们也与时俱进,抽血做个基于ctDNA的液体活检,一方面可以又快又准确地帮助医生进行早期诊断,另一方面,对于已经确诊了的患者,还可以制定个性化的治疗方案,隔一段时间检测一次又可以动态地监测肿瘤的发展情况,及时对治疗方案做出调整。相比于传统的组织活检,通过外周血液的液体活检可以避过肿瘤异质性、穿刺导致癌细胞转移等诸多问题。
可是,在当下液体活检风头正盛的时候,约翰霍普金斯大学医学院的两位研究人员却在《JAMA Oncology》杂志上发表研究指出,不同机构进行的检测得到的结果差异非常大,两家权威机构同时检测的40名患者样本中,除去6例检测结果被认为无效的外,其余34例中测序结果完全一致的只有12例[1]!
来自约翰霍普金斯大学医学院的两位研究人员,Gonzalo Torga(左)和Kenneth J. Pienta(右)
需要注意的是,两家机构检测的基因和位点都有一些差异,因此研究人员只比较了两家公司的检测中共有的、重合的位点。基于这一结果,他们认为这一结果值得科学家们深思,究竟该怎样改善现有的方法才能更好地帮助到患者。
在这次的研究中,“接受考验”的两家机构分别是Guardant Health和Personal Genome Diagnostics,两家的检测产品会分别对患者血液样本中的73个基因和64个基因的部分编码序列进行测序。
绿:两家检测都发现的重合的突变位点,灰:没有检测到突变的位点,红:两家重合的检测位点中只被其中一家检测到的,蓝:其中一家特有的检测位点被检测到突变的;P代表Personal Genome Diagnostics,G代表Guardant Health
Personal Genome Diagnostics的创始人是约翰霍普金斯大学Kimmel癌症中心的肿瘤学教授Luis Diaz,在癌症领域有超过25年的研究经验[2],在2010年成立了Personal Genome Diagnostics。而Guardant Health可能更加为业内人士所熟悉,在成立的4年中,他们共获得了5.5亿美元的投资,还在2014年被达沃斯评为了“24家正在改变未来的公司”之一[3]。
研究人员招募了40名患转移性前列腺癌的患者,抽取了血样后,分成两份分别送到两家的实验室进行测序。在这40例样本中有6例因为某些原因检测结果被认定无效,剩下的34例中,有12例(35%)检测报告给出的结果相同,其中有3例突变谱完全一致,其余9例均没有检测到突变。剩下的22名患者就没这么“好的运气”了,他们中有6例检测到的突变有重合,但是又不完全相同,还有16例检测到的突变完全不重合。
40名患者的检测结果,16例(红)为两家检测到的突变完全不重合,6例(橙)为部分重合但不完全相同,3例(绿)为突变谱完全重合,9例(灰)为经两家检测均没有发现突变,6例(蓝)为检测结果无效
这个结果让研究人员非常惊讶,两家公司都是业内顶尖的,他们的实验室也都获得了临床检验改进修正计划(Clinical Laboratory Improvement Amendments,CLIA)的认证,CLIA认证意味着实验室中临床试验结果的准确性、可靠性和时效性都得到了FDA和CDC等的认可,并且他们也都拥有美国病理学会的CAP(College of American Pathologists)认证,“两证俱全”。
研究人员的本意也是希望为患者提供最好的选择,所以才找了两家公司提交样本,进行比较,但是这个结果让他们也很意外[4]。这也和今年早些时候同样发表在《JAMA Oncology》上的另一篇文章[5]“不谋而合”。
这项研究由华盛顿大学医学院的研究人员领导,他们招募了9名癌症患者(5名为乳腺癌,其余4名分别为胰腺癌、胸腺癌、肺癌和唾液腺癌),同样选择了两家液体活检公司对患者的血液样本进行了检测。其中一家是和这次一样的Guardant Health,另一家是Foundation Medicine,同样也是大名鼎鼎,曾为乔布斯老爷子进行过测序,创始人是人类基因组计划的领导者之一,他们的检测会包括315个癌症相关基因的外显子以及28个重排基因的内含子。
然而,2份测序结果也有不小的差异。其中胸腺癌患者在两家都没有检测到突变,剩下的8名患者中共检测到了45个突变,其中只有10个(22%)是重合的,而且8名患者中有2名检测到的突变完全不同。
这是不是说明这些检测“不靠谱”呢?但是和新研究同期刊发的另一篇文章似乎又给予了否定的回答。在研究中,研究人员使用FDA批准的伴随诊断(FDA-CD)和实验室自主开发的检测(LDT)分别对6897例样本的BRAF、EGFR和KRAS基因的突变情况进行了检测[6]。前面我们提到的几家公司的测试就属于LDT的范畴。与需要FDA进行认证,可以商用的FDA-CD相比,LDT是由各实验室自己进行研发和验证的,技术和检测只能在自己的实验室内使用,不需要FDA认证。
不过在这个研究中,研究人员发现,FDA-CD和LDT的检测结果重合度是非常高的,按照美国病理学会的实验室能力比对验证(Proficiency Testing,PT)给出的结果,两种检测都有超过97%的准确率。基于这个结果,研究人员认为FDA所希望的,加强对LDT的检测和监管可能是不必要的。LDT与FDA-CD的检测结果几乎完全相同,那么似乎说明,LDT在检测样本上的能力已经很合格了,但是前面两个研究中,两家LDT的结果偏差如此之大,与这个研究得到的结果一定程度上是相悖的。
在同期杂志中,密歇根大学综合癌症中心的Daniel F. Hayes博士还为此撰写了一篇评论文章[7],他认为后者的研究只涉及到了3个在癌症患者中极其常见的突变基因,这个结论不能推及到更多的基因和检测上。
Daniel F. Hayes博士
回顾了两个结论相悖的新研究后,Hayes博士提出了问题:究竟哪个是“事实”?没有人知道答案。他认为约翰霍普金斯大学医学院两位研究人员的研究成果应该得到特别重视,因为“一次糟糕的肿瘤标志物检测带来的后果和糟糕的药物一样”,而现在患者所用的检测多是LDT,如果检测结果的准确性不能得到保证的话,那对于患者来说是非常可怕的一件事情。
Hayes博士表示,开发LDT的公司和实验室不能抱有“一经售出,概不负责”的态度,他将联合其他研究人员,呼吁技术的研发者去验证、改善这些被广泛用于患者的检测方法。(生物谷Bioon.com)
2018年1月31日/生物谷BIOON/—在一项新的研究中,来自美国斯坦福大学、格拉斯通研究所和中国清华大学的研究人员报道,一种能够激活而不是切割DNA的CRISPR形式能够将胚胎小鼠细胞转化为诱导性多能干细胞(induced pluripotent stem cell, ipsC)。相关研究结果于2018年1月18日在线发表在Cell Stem Cell期刊上,论文标题为“CRISPR-Based Chromatin Remodeling of the Endogenous Oct4 or Sox2 Locus Enables Reprogramming to Pluripotency”。
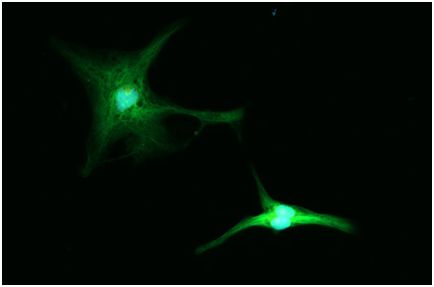
美国纽约基因组研究所生物工程师Neville Sanjana(未参与这项研究)写道,“这篇论文证明了CRISPR效应分子不仅能够激活单个基因,而且完全重塑细胞的转录状态。”
为了产生iPSC,科学家们过表达4种转录因子:Oct4、Sox2、Klf4和c-Myc。但是,在这项新的研究中,这些研究人员利用一种表观遗传CRISPR技术激活仅一种转录因子—Sox2或者Oct4—的一个内源性基因拷贝,就将小鼠胚胎成纤维细胞转换为ipsC。
加州大学旧金山分校干细胞生物学家Sheng Ding和同事们使用了一种之前已发布的人工转录因子系统,该系统由一种经过修饰的没有核酸酶活性的Cas9(dCas9)和蛋白结合结构域组成。当与向导RNA(gRNA)结合在一起时,dCas9靶向一个特定的基因组位点,并且招募一种经过修饰结合到这些特定结构域(即蛋白结合结构域)上的转录激活蛋白(transcriptional activator protein),因此也必需将这种转录激活蛋白导入到这些细胞中。这些研究人员通过转染这种人工转录因子系统和18种gRNA(靶向与这4种传统的转录因子和另外3种其他的多能性转录因子相关的一系列增强子和启动子位点)到小鼠胚胎成纤维细胞中,成功地产生了ipsC。
Ding说,“我们最初的想法是内源性地同时激活这些基因。随后,我们问道,这种方法存在的限制是什么。如果我们仅激活一个基因或者说单个位点,那么这就足够了吗?”
为了解答这个问题,Ding团队每次逐个地移除gRNA。他们发现仅靶向Sox2的启动子或Oct4的增强子和启动子足以将小鼠胚胎成纤维细胞转化为iPSC。他们还证实利用招募一种经过修饰的组蛋白乙酰转移酶的dCas9激活Oct4也能够导致小鼠胚胎成纤维细胞转化为iPSC。这两个发现表明操纵小鼠胚胎成纤维细胞的表观基因组就能够导致ipsC产生。
起初,Ding认为在一个位点激活单个基因来重编程细胞是不可能的,但是如今,他的团队已针对它的工作方式提出了一个假设。他解释道,“基因组并不是以线性的方式进行组装。在三维结构下,许多[基因组]位点实际上是连接在一起的。因此,如果考虑这种三维结构,就能够想象激活单个位点可能会让它附近的很多位置也受到影响。”
这些研究人员计划研究基因组相互作用可能在细胞重编程中发挥的作用。而且他们希望改进这种技术,以便利用它在体内重编程细胞,和产生不同的细胞类型用于细胞疗法中。
美国乔治亚理工学院生物工程师James Dahlman(未参与这项研究)说,“在实际情形下,[细胞]受到自然微环境中的所有这些其他的信号通路的影响。如果你要开始使用相同的细胞类型,并让它产生多能性,然后让它再分化,从而获得某种其他的你想要的细胞类型,那么这种方法是否有用呢?我猜测答案是肯定的,但是存在的所有这些变化都是你必须理解和考虑的。”
加州大学伯克利分校细胞生物学家Dirk Hockemeyer(没有参与这项研究)同意这一点,并解释道,仍不清楚这个方法是否能够应用于其他的应用上,比如将成纤维细胞转化为心脏细胞。他说,“我们开发的工具越多越好。也许只有少数工具最终会在临床中使用,但要知道这些工具是哪些是非常困难的,因此我们需要给予每种方法一个公平的机会。这是一个非常非常有前景的方法。”(生物谷 Bioon.com)
参考资料:
Peng Liu, Meng Chen, Yanxia Liu et al. CRISPR-Based Chromatin Remodeling of the Endogenous Oct4 or Sox2 Locus Enables Reprogramming to Pluripotency. Cell Stem Cell, Available online 18 January 2018, doi:10.1016/j.stem.2017.12.001