


2019年10月14日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Nature上的研究报告中,来自加拿大安大略省癌症研究所的科学家们通过研究在人类癌症基因组中的大量非编码区域(也被称之为人类癌症DNA的“暗物质”)中发现了一种新型的致癌突变;这种突变或能作为一种新型潜在的治疗靶点,帮助科学家们开发治疗多种类型癌症的新型疗法,包括脑癌、肝癌和血液癌症等。

图片来源:CC0 Public Domain
研究者Lincoln Stein表示,非编码DNA在基因组中占到了98%的比例,其对于科学家们而言非常难以研究,而且其因为不编码蛋白质经常会被忽略。通过仔细分析这些区域,研究人员在DNA代码的一个碱基中发现了改变,其或能驱动多种类型癌症的发生,研究人员或能利用这种新型癌症机制来开发治疗包括癌症在内多种疾病的新型疗法。
这种名为U1-snRNA突变的特殊突变会干扰正常RNA的剪接过程,从而改变致癌基因的转录,这些分子机制或能提供新型通路帮助治疗携带特殊突变的癌症类型,其中一种潜在的治疗手段包括重新定向当前的药物,通过绕过早期药物的开发阶段加速临床应用等。这项研究中,研究人员意外发现了一种全新的方法来治疗多种难以治疗、且死亡率较高的癌症类型,研究者表示,只要DNA编码出现一个“错误”,其就会产生数百种突变蛋白,研究者能够利用当前现有的免疫疗法来锁定这些突变蛋白。
研究者在特定脑癌亚型患者中发现了U1-snRNA突变,这些亚型患者的样本包括几乎所有来自成年sonic hedgehog髓母细胞瘤患者的样本;此外,这种突变还存在于慢性淋巴细胞白血病患者和肝细胞癌患者机体中。最后研究者Laszlo Radvanyi说道,基于本文研究结果,后期我们还会继续深入研究,利用这种新型致癌突变作为新型靶点开发治疗多种癌症类型的新型疗法。(生物谷Bioon.com)
原始出处:
Shimin Shuai, Hiromichi Suzuki, Ander Diaz-Navarro, et al. The U1 spliceosomal RNA is recurrently mutated in multiple cancers, Nature (2019) doi:10.1038/s41586-019-1651-z
Hiromichi Suzuki, Sachin A. Kumar, Shimin Shuai, et al. Recurrent non-coding U1-snRNA mutations drive cryptic splicing in Shh medulloblastoma, Nature (2019) doi:10.1038/s41586-019-1650-0
今日,顶尖学术期刊《自然》在线发表了一篇关于基因编辑的重要论文。来自Broad研究所的CRISPR大牛刘如谦(David Liu)教授团队开发了一种新型的基因编辑技术,有望修复大约89%的已知人类致病变异。这项研究在发表之前,就已经在一些学术会议上得到了很多科学家的关注。正式上线后,更是引起了业内的点赞和热议,被认为是“极为重要”的成果。
那么,这项技术究竟牛在哪里?要讲清楚这一点,我们还要先看看传统的基因编辑是怎么做的。
目前,应用最为广泛的基因编辑技术之一,便是CRISPR-Cas9系统。在这套系统里,Cas9蛋白会在目标DNA序列上切出口子,造成双链DNA断裂。随后,再利用同源重组等方法,在DNA修复的过程中对基因组进行编辑。
这一方法虽然有效,但很粗暴。打个比方,这就好像一页书上有错别字,为了修正书上的错误,要把这整页书给撕下来,再重新粘上一页那样。可以想象,这样的工作谈不上优雅,也容易产生潜在的问题。
过去,包括刘如谦教授课题组在内,一些科学家们开发出了“单碱基编辑系统”。与传统的CRISPR-Cas9系统不同,它将经过修饰的Cas9蛋白与另一种酶直接融合在一起。在目标DNA位点,它不会切开DNA链,而是对单个碱基进行修改,如将A变成G,或是把C变成T。这一方法能够对点突变进行“微调”,不过并不适合大段大段的修改。此外,它只能进行四种修改(比如不能把T变成A),还存在潜在的脱靶问题。
而在今日的这项研究中,我们见证了一种新型基因编辑技术的诞生。这种技术被称为“先导编辑”(prime editing),核心之一是一种由Cas9蛋白与逆转录酶(reverse transcriptase)融合而成的特殊蛋白。该技术的另一个关键是一种特殊的gRNA,它被研究人员们称为“pegRNA”,其中pe是“先导编辑”英文单词的两个首字母。
与普通的gRNA不同,这种pegRNA不但能够结合想要进行编辑的特定DNA区域,还自带“修改模板”。Cas9-逆转录酶融合蛋白会在pegRNA的引导下,精准地切开一条DNA链,然后根据“修改模板”,合成含有正确序列的DNA。细胞内的DNA修复机制会自动把这段新合成的序列整合进基因组。
随后,研究人员们故技重施,在另一条DNA链上进行同样的操作。这样一来,两条DNA都能得到正确的编辑。
“结果就是(给基因组带来)永久的改变,这些改变来源于pegRNA所编码的信息。”刘如谦教授说道。
正是由于这套系统的灵活性,原本不可能实现的单碱基编辑(如将T转变为A),也成为了可能。与单碱基编辑只能进行4种转换相比,这套先导编辑系统能进行12种单碱基的转化。也就是说,他们可以把任何碱基转化为任何其他碱基,包含了所有的12种可能性。
在多种人类细胞中,研究人员们证实了这一系统的编辑能力。此外,它的编辑潜力在小鼠神经元里也得到了证实。除了对单个碱基进行修改之外,这一系统还能够插入或删除特定的DNA序列。根据论文,研究人员们最多可以插入44个碱基,或是删除80个碱基。
“通过先导编辑技术,我们能直接修正镰状细胞贫血症的突变(学术经纬注:A突变成了T),让序列回归正常。我们也能移除戴萨克斯症(Tay Sachs disease)多出的4个碱基。这都不需要完全切开DNA,或添加DNA模板,”刘如谦教授在Broad研究所的新闻稿里说道:“这一系统的美丽之处在于几乎对编辑的序列没有限制。由于添加上的碱基仅由pegRNA来决定,我们能加上与原本序列仅差1个碱基的序列,也可以加上多了几个,或少了几个碱基的序列。我们还可以对这些变化进行排列组合。”
可喜的是,研究人员们还发现,与需要断开双链DNA的传统方式相比,先导编辑系统的脱靶编辑风险更低。
目前,这一系统已向学术界和非营利组织免费公开。
当然,由于这一系统依旧是一类全新的基因组编辑方法,因此还需要进一步的检验和改良,才能用于人类。不过,这一系统展示的潜力,已经让我们看到了一个能够有效治疗罕见遗传病的未来。我们期待这一天的早日到来。(生物谷Bioon.com)

2019年11月14日 讯 /基因宝jiyinbao.com/ –数据可重复性一直以来都是实验生物学的一个主要问题,随着基因组技术的发展以及相关数据复杂性的不断提高,这一问题的严重性又得到了很大程度地提升。
11月12日,特拉维夫大学的Shir Mandelbaum,Zohar Manber,Orna Elroy-Stein和Ran Elkon在《PLOS Biology》上发表文章,指出RNA-seq技术产生的数据经常出现技术偏差,进而导致错误的结论。
通过分析数十个可公开获得的,针对细胞对多种不同压力的反应的RNA-seq数据集合, Mandelbaum及其同事注意到,长度过短或过长的基因集合反复显示出表达水平的变化。

作者对此感到困惑,然后试图搞清楚这一现象背后究竟是真实的生物学反应,还是实验过程引入的人为误差。为了解决这个问题,他们比较了相同生物学条件下的重复批次的样本。重复样品之间基因表达的差异可以反映与生物学因素无关的技术性影响。结果表明,在不同的重复中,长度过短或过长的基因都显示出“表达差异”,因此这一现象似乎是基因长度差异引起的“技术性误差”。
RNA-seq实验的主要目的是表征受特定因素影响而被激活或抑制的生物学过程。Mandelbaum及其同事证明,在许多RNA-seq数据集中,基因长度偏差以及统计分析中的一些缺陷会导致对特定生物学功能出现错误识别。通过消除这种偏见,能够滤过滤虚假信息,同时保留了生物学上真实信息。(生物谷Bioon.com)
资讯出处:Widespread misinterpretation of gene expression data
原始出处:Shir Mandelboum, Zohar Manber, Orna Elroy-Stein, Ran Elkon. Recurrent functional misinterpretation of RNA-seq data caused by sample-specific gene length bias. PLOS Biology, 2019; 17 (11): e3000481 DOI: 10.1371/journal.pbio.3000481
2019年11月24日讯/生物谷BIOON/—为了将大约两米长的人DNA携带的遗传信息包装到细胞核中,人细胞所要完成的工作相当于将80公里长的线放入一个足球大小的球体中。早在1882年,德国生物学家Walther Flemming便通过显微镜进行了观察,发现了有关这种包装是如何实现的线索。他当时观察到位于卵细胞细胞核内的DNA环,这让他想起了那个时代用于清洁煤气灯的刷子,于是他就将这些结构命名灯刷染色体(lampbrush chromosome),却不知道它们是什么,也不知道它们有什么用途。
人们花了几十年的时间才将灯刷染色体识别为DNA链整齐地折叠而形成的DNA环(loop),而且花了更长的时间才意识到DNA在所有细胞中始终被折叠成这样的结构;直到2019年,人们才发现这种折叠是如何实现的。
在一项新的研究中,奥地利维也纳生物中心分子病理学研究所(IMP)主任Jan-Michael Peters及其团队首次证实一种分子机器通过“环挤压(loop extrusion)”主动地和有目的地折叠DNA,从而在间期细胞中实现了多种重要功能。这种针对DNA成环(DNA looping,即形成DNA环)过程提出的新见解改变了关于基因组如何在细胞内组装的旧观点。这一发现阐明了生命的基本机制,并解决了长达十年的科学争端。相关研究结果于2019年11月21日在线发表在Science期刊上,论文标题为“DNA loop extrusion by human cohesin”。
从进化论的古老性来看,DNA环形成的过程既不是随机的也不是任意的。从细菌到人类,所有生物的细胞都具有这种功能。这种折叠机制的原始功能尚不清楚,我们可能永远也找不出来,但是近年来发现了一些重要的任务。通过形成DNA环,大分子上相隔较远的区域变得非常接近并能够相互作用。这种物理接触在基因调控中起着重要作用,在基因调控中,称为增强子的DNA片段影响哪些基因是活跃的。DNA环形成对于免疫细胞产生各种抗体的能力也是必不可少的。
关于这些DNA环如何被保持在适当位置上的想法起源自IMP Peters实验室前博士后研究员Kerstin Wendt的研究工作。2008年,她的研究结果已提出蛋白复合物黏连蛋白(cohesin)完成了DNA环形成。10年前,IMP科学家Kim Nasmyth的实验室鉴定出这种大分子是一种分子胶(molecular glue),可在有丝分裂早期将姐妹染色单体保持在一起,Nasmyth最近也因这一发现获得2020年科学突破奖(Breakthrough Prize)。黏连蛋白通常呈环状结构(ring-shaped),被认为像钩环(carabiner)一样夹在DNA上。
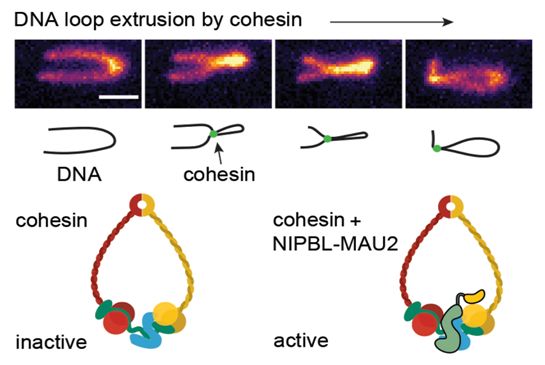
长期以来,这种DNA折叠状态一直被认为是一种静态构型,黏连蛋白分子的作用非常类似于窗帘杆上的环,可滑动到DNA上而不与它结合。关于如何形成DNA环的想法来自包括麻省理工学院物理学家Leonid Mirny在内的几位科学家。Mirny提出黏连蛋白最初会形成微小的DNA环,然后会逐渐变大,直到在这种“挤压”过程中,黏连蛋白被确定这些环锚定位置的DNA所处边界的阻止。然而,这种环挤压假说与当时也已建立的DNA是静态的和黏连蛋白在它的周期形成被动DNA环的观点完全不同,因此许多生物学家对此表示怀疑。正是由于论文第一作者、Peters实验室资深博士后研究员Iain Davidson和他的同事们的聪明才智和费时费力的实验,这一争议如今才得以解决。
Peters团队(包括Davidson)能够在体外的一种简化系统中重建黏连蛋白的功能。因此,Davidson能够观察到单个黏连蛋白分子如何将DNA的单个片段快速地挤压成DNA环,就像Mirny和其他人所假定的那样。他的发现影响深远,并以多种方式改变了对基因组的整体认识:
(1)基因组不是静态的,而是高度动态的结构。
(2)基因组DNA的折叠是一种受到主动调节的过程,它涉及通过挤压让DNA分子成环,并且许多DNA环在不断运动。
(3)这种DNA成环是由黏连蛋白介导的,因此黏连蛋白必须是一种分子马达,类似于诸如肌球蛋白之类的其他马达蛋白。
(4)黏连蛋白分子在DNA周围形成钩环状的环状结构,而且还必须通过多个结合位点动态链接到DNA上,这样才能够折叠DNA。正如去年所发现的那样,凝缩蛋白(condensin)也必须如此。
Peters说,“这是一次真正的范式转变。早期的观察结果给了我们一些提示,但是Davidson领导的这项新的研究如今就证实这一点。在我的科学生涯中,很少有其他的发现像这个发现一样意义深远。”
与有关基因组的其他基本发现—比如DNA半保留复制和DNA通过同源重组进行重排—一样,这些发现有望很快成为教科书知识。对于IMP研究人员而言,下一个要解决的重要问题是黏连蛋白如何与DNA精确结合,然后它如何移动DNA以使得它折叠成DNA环,以及这个过程如何受到控制。他们已发现一种称为NIPBL-MAU2的蛋白复合物,对于黏连蛋白的运动功能至关重要,而不仅仅是像以前认为的那样,将黏连蛋白加载到DNA上。
Davidson,说:“我们如今可以使用我们的设备进一步放大这种复杂的DNA成环分子过程。阐明这一机制也可能有助于我们理解为什么某些人类疾病是由黏连蛋白发生的突变引起的。”(生物谷 Bioon.com)
参考资料:
1.Iain F. Davidson et al. DNA loop extrusion by human cohesin. Science, 2019, doi:10.1126/science.aaz3418.
2.Cohesin – a molecular motor that folds our genome
https://www.imp.ac.at/news/detail/article/cohesin-a-molecular-motor-that-folds-our-genome/
3.Mahipal Ganji et al. Real-time imaging of DNA loop extrusion by condensin. Science, 2018, doi:10.1126/science.aar7831.
4.Science:重磅!首次实时观察到凝缩蛋白挤压DNA形成环状结构
http://news.bioon.com/article/6718020.html
5.Tsuyoshi Terakawa et a. The condensin complex is a mechanochemical motor that translocates along DNA. Science, 2017, doi:10.1126/science.aan6516.
6.Science:重磅!首次证实凝缩蛋白具有马达功能
http://news.bioon.com/article/6709719.html
7.Johan H. Gibcus et al. A pathway for mitotic chromosome formation. Science, 2018, doi:10.1126/science.aao6135.
8.Science:136年来,终于破解有丝分裂期间染色体折叠之谜
http://news.bioon.com/article/6716386.html
9.Kerstin S. Wendt et al. Cohesin mediates transcriptional insulation by CCCTC-binding factor. Nature, 2008, doi:10.1038/nature06634.
10.Yu Zhang et al. The fundamental role of chromatin loop extrusion in physiological V(D)J recombination. Nature, 2019, doi:10.1038/s41586-019-1547-y.
11.Xuefei Zhang et al. Fundamental roles of chromatin loop extrusion in antibody class switching. Nature, 2019, doi:10.1038/s41586-019-1723-0.
12.Winners of the 2020 breakthrough prize in life sciences, fundamental physics and mathematics announced
https://breakthroughprize.org/News/54
图片来自:yourgenome.org
2017年9月28日/基因宝jiyinbao.com/— 弗吉尼亚大学医学院( UVA )已经开始为青少年急性淋巴细胞白血病,实施基于基因工程改造的T细胞免疫治疗。 I / II期的青少年急性淋巴细胞白血病试验,正在评估该方法对儿科患者的安全性和有效性。该项临床试验将考察总体缓解率、12个月后缓解期和整体生存期等因素。参与者必须介于2岁和21岁之间,并且要求患者已经复发或对其他形式的治疗没有反应。
被称为嵌合抗原受体(CAR)T细胞疗法的方法是利用人体自己的免疫T细胞,通过基因修饰它们,使它们更有效地杀伤癌细胞。在这种情况下,UVA儿童医院的癌症中心和卡特免疫中心儿科肿瘤学家 Daniel Lee博士,从一名年仅14岁的急性淋巴细胞白血病患者身上抽取T细胞,然后,该患者的免疫细胞由 Kite Pharma 细胞治疗公司进行基因改造。
实验方法类似于美国联邦食品和药物管理局8月底批准用于儿科淋巴细胞白血病的基因疗法,这是美国曾经批准的第一个基因治疗方法, Daniel Lee博士希望该方法将给病人带来希望。“我们从患者的静脉收集T细胞,细胞运送到基因编辑公司,基因改造大约在七天内完成,并将改造后的T细胞返回给我们,”Lee博士说。“所以我们只需要有16到18天的等待时间,这是非常快的。”
在美国国立卫生研究院的时候,Lee博士在50多名试验参与者中使用类似产品来测试该方法。他说,这些参与者对该方法有反应的比例为70%,复发率低于10%。可能在不到两年的时间内,将会陆续有20个临床试验完成。
因为Lee博士在CAR T细胞疗法方向的开创性研究,UVA从NIH招募了Lee博士。除了白血病治疗之外,他还在寻求开发新型的T细胞治疗方法用于挽救致命的儿科脑癌。在UVA,他加入了一个世界级的研究团队,探索免疫治疗的潜力,以提高身体抵御疾病的能力。他说:“你将会看到更多的CAR T细胞治疗法出自UVA。” (生物谷 Bioon.com)
参考资料:
Teen first in Virginia to receive cancer gene therapy in clinical trial
本文中,小编对多篇文章进行整理,让我们一起关注近期全球基因疗法的研究进展。
近日,Spark Therapeutics传来喜讯。美国FDA的一个独立专家小组在经过仔细的审评后,以16:0的投票,对其在研基因疗法Luxturna表示一致认可。这也意味着首款能矫正人类基因缺陷的疗法离我们更近一步。美国FDA将在2018年1月12日前就这款新药能否上市做出批复。
罹患遗传性视网膜病变(IRD)的患者是这款创新疗法的最大受益者,25岁的艾莉森·科罗纳(Allison Corona)就是其中之一。这名年轻的姑娘不幸患有莱伯先天性黑蒙症(Leber congenital amaurosis),很难分清颜色,日常生活中也只能看见人的大致轮廓。辨识对方表情这样简单的任务,对艾莉森来说是个奢望。她说,她的生活缺失了很大一部分。
艾莉森患上的是一种遗传病,背后的根本原因在于关键基因的突变。这些基因对于视网膜的发育和功能有着重要作用,一旦无法正常工作,就会影响到人的视力,导致失明。由于这种疾病的根源在于基因本身,大部分只能“治标”的药物对其无能为力。
doi:10.1073/pnas.1701589114
大部分永久性失明的症状产生都是由于视网膜中数一百万计的光感受体细胞(类似于数码相机的像素点)的缺失导致的。然而,视网膜中那些残余的、对光线敏感度不高的视觉神经细胞则处于正常状态。最近,来自牛津大学的Samantha de Silva等人通过病毒转染的方式在患有“视网膜色素变性(一类常见的导致青少年失明的原因)”的小鼠眼部残余的视神经细胞中表达光感蛋白(melanopsin),从而使得小鼠的视力得到了部分的恢复。
研究者们对这些接受转基因治疗的小鼠进行了长达一年的观察,结果显示,小鼠的视力能够在较长的时间范围内维持正常水平(即小鼠能够对环境中的事物进行辨别)。这类表达有melanopsin的细胞则能够对光线产生反应,以及能够向大脑传送视觉信号。虽然此前牛津大学的研究者们已经通过向患者眼部移植电子视网膜进行治疗,但这种基因疗法显然更加简单。
在这项两年多随访的试验中, 17例脑性肾上腺脑白质营养不良(cALD)的患者使用蓝鸟生物(Bluebird)的单剂量基因疗法Lenti-D治疗, 15例患者的病情得以稳定。
这项发表在《新英格兰医学》杂志上的试验结果表明, Lenti-D可能会是cALD的第一个根治疗法。
cALD是一种罕见病,是肾上腺脑白质营养不良(ALD)中较为严重的一种。据估计全球每2.1万男就有1人患ALD,患ALD的男性中有40%为脑性cALD。
而肾上腺脑白质营养不良(ALD)是一种遗传病,ALD患者因为ABCD1基因的突变导致丧失了肾上腺脑白质营养不良蛋白(ALDP)功能。因为ALDP是超长链脂肪酸(VLCFAs)分解的关键蛋白质,这个蛋白的功能丧失导致血液和所有组织中VLCFAs的有毒性积累,以肾上腺和神经系统的影响最大。
【4】“电子基因疗法”治疗心脏病
新闻阅读:Electric genes hope to fix a broken heart
最近,科学家们开发出了一种新型的”电子基因”疗法,有望为心脏疾病提供革命性的治疗方案。
心脏病是欧洲范围内致死率最高的疾病。仅仅2013年就有190万人因心血管疾病死亡,占据当年死亡总人数的37.5%。
存在较高心脏节律紊乱风险的人群往往会通过手术的方式移植一个心脏除颤器。然而,如果心脏本身就能够检测并且修复自身的紊乱症状的话又当如何呢?这就是来自荷兰Leiden大学医学中心的心脏专家D?niel Pijnappels博士致力于解决的问题。

Voyager Therapeutics公司宣布了评估VY-AADC01治疗晚期帕金森病的1b期临床试验的积极结果。证明了一次性施用这一基因疗法可以对患者运动功能的多项测量起到持久的改善作用。
帕金森病是一种慢性进展性的神经退行性疾病,是由于制造多巴胺的神经元丧失造成的,表现为震颤、运动缓慢、僵硬、姿势不稳定等,发展到晚期甚至引起摔倒、无法迈步、语言和吞咽困难等,需要人照顾日常生活。它影响了全球约700万至1000万人。但目前还没有可以有效延缓或逆转疾病进程的治疗。左旋多巴是标准治疗方法。早期帕金森病患者通常可以通过左旋多巴较好地控制病情,但随着疾病进展,患者对治疗的响应也变得越来越差。据估计,约有15%的帕金森病患者有运动能力波动,并且经左旋多巴治疗不能很好的控制。患者会经历更长时间的运动能力降低(也叫“关闭”期),药物提供的有效时间(也叫“开启”期)会变短。患者急需一种可以有效延缓疾病进程,并缓解症状的疗法。
【6】新疗法:科学家将一种基因工程病毒注入肿瘤以此破坏肿瘤生长!
桑福德健康是美国第一个使用基因工程病毒进行临床试验的网站,旨在破坏耐药性肿瘤。
I期免疫治疗试验适用于18岁及以上患有不符合标准治疗的转移性实体瘤。该治疗将肿瘤溶解性(破坏坏死)的病毒 – 水泡性口炎病毒(VSV)注射入肿瘤。病毒被设计成在癌细胞中生长,破坏这些肿瘤,然后传播到其他癌症部位。在这个过程中,它向该区域招募免疫系统,目的是引发免疫反应。
该病毒,通常称为VSV,可以感染牛,但很少引起人类严重感染。
病毒通过添加两个基因进行遗传改变。第一个基因是人类干扰素β基因,它是一种天然的抗病毒蛋白质。这可以保护正常的健康细胞免受感染,同时仍能使病毒对抗癌细胞。
第二个基因为甲状腺中发现的NIS蛋白质,这使得研究人员可以在病毒传播到肿瘤部位时跟踪病毒。 Vyriad是明尼苏达州罗彻斯特的一家生物制药公司,开发了该技术,由梅奥诊所分子医学教授,溶瘤病毒治疗专家Stephen Russell博士领导。
【7】Cell Stem Cell:重磅!科学家开发出新型经皮肤移植的基因疗法 或能有效治疗多种人类疾病
DOI:10.1016/j.stem.2017.06.016
近日,一项发表在Cell Stem Cell杂志上的一篇研究报告中,来自芝加哥大学的研究人员通过研究克服了限制基因疗法的瓶颈,文章中,研究人员阐明了如何利用皮肤移植的方法来促进基因疗法治疗多种人类疾病。
研究者Xiaoyang Wu博士表示,经过皮肤移植的基因疗法或能帮助有效治疗两种常见的疾病:2型糖尿病和肥胖症;这项研究中,研究人员设计出了具有完整免疫系统的小鼠—小鼠皮肤移植模型,这个平台或能支持在小鼠甚至在人类机体中进行安全和可持久的基因疗法;研究者表示,工程化的皮肤移植或能在完整免疫系统的野生型小鼠中存活时间较长,而且皮肤移植的成功率能够达到80%以上。
研究人员重点对糖尿病进行了相关研究,首先他们插入了编码胰高血糖素样肽1(GLP1)的基因,这种激素能够刺激胰腺分泌胰岛素,额外的胰岛素则会从血液中移除过量的葡萄糖,从而抑制疾病并发症的出现,GLP1也能够减缓胃排空的时间并且降低机体食欲。随后研究人员利用CRISPR工具对GLP1基因进行了修饰,当研究者插入能够延长血液中激素半衰期的突变后,就能够将修饰后的基因同抗体片段融合以便这些抗体能够在血液中循环较长时间。
【8】Nat Commun:基因疗法治愈哺乳动物肌营养不良症
英法合作团队在25日出版的《自然·通讯》杂志发表论文称,他们以狗为动物试验模型开发的基因疗法,成功治好了杜氏肌营养不良症(DMD),为下一步开展人类临床试验铺平了道路,向治愈人类DMD患者迈出重要一步。
DMD患儿均为男性。在新出生的男婴中,每5000人就有一人会患上此病。这些患儿在几岁时就会表现出肌无力症状,如行走缓慢、跑步时容易跌倒、上楼和下蹲困难、走路呈典型鸭步等;一般到15岁之前,会恶化到无法自己行走,依靠轮椅生活;随后各种肌无力、呼吸及心脏问题相继出现,病人很少能活到40岁。
科学家们认为,DMD由一种与抗肌萎缩蛋白有关的基因变异引起,这些基因变异会影响抗肌萎缩蛋白的生成,进而影响肌肉的健康和功能。新研究中,法国南特大学和英国伦敦大学的科学家合作,研发出一种新型基因转移疗法,成功恢复了实验狗体内抗肌萎缩蛋白的表达。

近日,在顶尖学术刊物《细胞》的子刊《Cell Stem Cell》中,来自芝加哥大学的Xiaoyang Wu教授团队发表了他们的一项新发现——将干细胞技术、CRISPR基因编辑技术、与皮肤移植技术相结合,一款基因疗法有望对肥胖症与2型糖尿病这两种常见疾病进行治疗。
自上世纪70年代以来,科学家们就学会了如何从烧伤患者身上分离出皮肤干细胞,在实验室中进行培育,并移植到患者的烧伤部位,进行治疗。这给Wu教授的团队带来了启示。如果我们在这些皮肤细胞中引入能治病的基因,是否就能把皮肤改造成人体的药厂,随时生产能治疗疾病的药物呢?
研究人员决定以小鼠糖尿病为模型检验这个想法。选择糖尿病有几个原因。首先,它的病理与皮肤无关,因此不大可能受皮肤移植的影响。其次,我们知道,用一些简单的蛋白质,就能对糖尿病进行治疗,这便于基因疗法的开发。
日前,位于美国马里兰州(Maryland)的再生医学公司TissueGene宣布,该公司在亚洲(包括韩国)的合作伙伴Kolon Life Science已经从韩国食品医药品安全部(MFDS)获得了Invossa的上市许可,它也是全球首个上市的针对退行性关节炎的细胞和基因疗法。
骨关节炎(osteoarthritis)是最常见的关节炎类型,它产生的主要原因是关节中软骨层受到破坏和耗损,导致软骨下面的骨骼相互摩擦。这导致患者关节疼痛、肿胀和活动范围减小。随着病情的发展,关节可能会变形或长出骨刺。关节腔内浮游的骨骼和软骨碎片可能导致更多疼痛和损伤。目前治疗骨关节炎的常见方法包括口服消炎止痛药,向关节中注射类固醇或透明质酸(hyaluronic acid),以及关节置换手术。这些疗法大多只能暂时减轻疼痛,而关节置换术价格不菲,并且伴随着手术带来的风险。

【11】Cell:重磅!科学家开发出基于CRISPR的新技术 或有望开发更为安全的基因编辑疗法
doi:10.1016/j.cell.2017.05.044
日前,一项刊登在国际著名杂志Cell上的一篇研究报告中,来自美国德克萨斯大学(The University of Texas)的研究人员通过研究利用CRISPR开发出了新型的基因编辑疗法来治疗危及生命的疾病,比如癌症、HIV和亨廷顿氏症等。
如今科学家们能够利用基因魔剪—CRISPR来对几乎任何有机体的遗传代码进行编辑,基于CRISPR的基因编辑技术对人类健康有着巨大的影响,目前已经有一系列利用CRISPR技术对人类细胞进行的试验正在进行之中,但这种方法似乎并不完美;从理论上来讲,基因编辑的工作原理就类似于利用一种自动纠正功能俩修复文档中重复出现的错误,但寻找并且编辑基因的CRISPR蛋白有时候却会靶向作用错误的基因,这样其就会将拼写正确的单次修正为拼写错误的单词,然而对错误的基因进行编辑还会产生新的问题,比如促进健康细胞发生癌变。
文章中,研究人员开发了一种新方法,其能够通过个体的完整基因组来快速检测CRISPR分子,从而预见除了CRISPR的靶点外其是否还能够同其它DNA片段相互作用,这种新方法或许就能够帮助临床医生为患者制定个体化的基因疗法,同时还能够保证疗法的安全性和有效性。Ilya Finkelstein教授说道,你和我之间或许会出现大约100万个点的差异,由于这种遗传多样性的存在,对人类基因的编辑似乎总是一种需要进行定制化的疗法。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!



相关新闻阅读:
2017年7月份4篇Nature、1篇Science、1篇Blood、2篇Cell及其子刊关注CRISPR/Cas重大突破

衰老是人类无法逃避的命运,寻找不老药也成了千百年来人们追逐的梦想。我们相信,青春的秘诀或许就写在我们的DNA里。这样一来,我们就能够解释,为什么有些人总是要老得慢一点。
自DNA的双螺旋结构得到解析以来,分子生物学取得了堪称飞跃的发展。如今,各种用来分析基因的工具终于让我们得以一窥生命密码的奥秘,从中寻找长生的线索。中科院蔡时青教授就是投身这一领域的专家,今日,他的团队发表了一项重量级的研究,找到了两条能够调控衰老速率的基因。这项研究发表在了顶尖学术刊物《自然》上。
在研究中,科学家们指出在过去的30多年里,我们对于长寿的调控机理有了广泛的了解。我们知道衰老无法避免,绝大部分人在衰老的过程中,身体机能总是逐渐衰退。然而,有一些人却会“一夜白头”,在短期内出现身体机能的断崖式滑坡;另一些人却能极好地将身体机能维持在一个健康水平,直至去世。这当然与生活、饮食习惯有关。但这种现象是否也受基因的调控呢?
先前的研究证实了这一假设,而且结果令人震惊——“长生”与“不老”这两件事,之间竟然没有关联!一些全基因组水平上做的分析表明,那些让人长寿的遗传变异,和让老人维持健康的遗传变异,两者之间的联系很少。这或许能解释为何有些老人身体就像年轻时那样,依旧非常健康。
蔡时青教授的团队想要弄清背后的生物学机理。在研究中,他们选择线虫作为模式生物,这有着几重原因。首先,线虫是抗衰老领域的经典模型,我们对它的寿命调控机制有着很深的理解;其次,线虫也存在人群内观察到的现象——部分个体的机能(如性能力、摄食能力、以及运动能力)衰退速率极为缓慢。研究人员们相信,如果能阐明线虫“不老”的秘密,或许就能为人类的抗衰老带来启迪。
研究发现,两条基因上的DNA多态性会影响线虫的生理机能,其中一条叫做rgba-1,编码一种多肽;另一条叫做npr-28,编码一个G蛋白偶联受体。它们都会影响到雄性的性能力衰退,暗示这两条基因在衰老过程中扮演的关键角色。
有趣的是,RGBA-1多肽还能与NPR-28受体相结合,激活下游通路。这条通路也因此对抗衰老有重要意义。那么,这条通路的具体作用机理是什么样的呢?通过进一步分析,蔡时青教授团队发现,源于神经胶质的RGBA-1 所激活的NPR-28能作用于5-羟色胺能神经元神经元和多巴胺能神经元,起到加速老化的作用。这一通路也涉及到基于SIR-2.1激活的线粒体未折叠蛋白反应,从而调控衰老。
总结来说,蔡时青教授团队发现在胶质神经元中,神经肽介导的信号通路能调控线虫的衰老速度。至于类似的通路是否也同样影响了人类寿命,则还需要更多的研究来确定。
如果我们能根据这项研究开发出“不老药”,延缓人们的衰老,那将是一件极有意义的事。目前,全球人口正在快速老龄化,随之而来的是猛涨的社会医疗支出。在人类活得更久的同时,还能让人类活得更健康,这就是蔡时青教授团队这项研究的潜在意义。(生物谷Bioon.com)