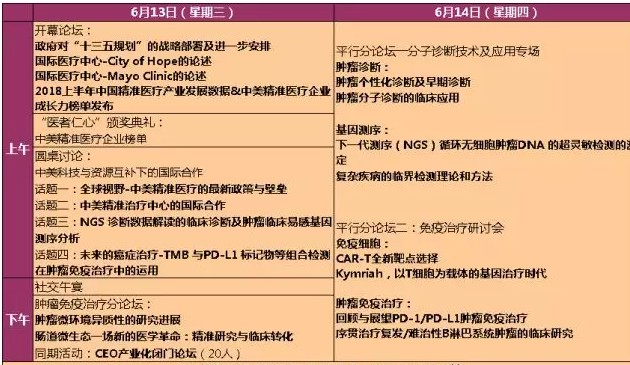
CRISPR-Cas9以基因定位的简单性、灵活性和准确性,叩响了辅助生殖技术的大门,如何看待、接纳和扶持这一新兴技术考验国人乃至全人类的智慧。图/视觉中国
本文转载自《财经》杂志(文/孟励 张翠莲)。
任何关于人类胚胎CRISPR基因编辑的消息都受到媒体的广泛报道,学术界的热度也丝毫不弱,世界范围内的科学家现在已经发表了八篇人类胚胎中的基因编辑的相关研究报告,其中五篇发表在过去三个月。
2017年下半年更是密集。8月2日、9月23日、10月5日,美、中、英的学者各自在《Nature》《Protein&Cell1》和《Nature》上发表论文,引起了更多的讨论,因为它代表了CRISPR在纠正致病突变基因和人类胚胎中精准基因功能调控的方法学上又迈出了一步。
但是,这距离我们的最终目标,即通过基因编辑来精准且彻底地纠正致病突变基因,理解人类胚胎基因调控还有多远,三篇文章提出了更新的问题。在我们考虑对生殖系细胞进行基因编辑的临床应用之前,还需要更多、更严谨且周密的实验。
作为生殖生物学工作者,我们有能力了解本领域的最新研究结果,同时,我们也有义务尽可能公开、准确地进行讨论基因编辑对于辅助生殖技术/医学的推动及其未来的应用前景。
CRISPR-Cas9的优势和局限
引起基因编辑的真正革命,是通过引入CRISPR-Cas系统,其中,一种核酸酶Cas9起了主要作用。
在普通的基因治疗中,患病细胞和组织中的基因可以通过两种方法进行修正:体内编辑和离体编辑。体内编辑治疗涉及将基因编辑试剂,如可编程核酸酶和供体模板直接转移到人体中。相比之下,在离体治疗中,将靶细胞群体从体内移出,使用可编程核酸酶修饰,然后移植回原宿主体,从而防止由免疫排斥引起的并发症。
辅助生殖技术中固有的体外受精、早期胚胎培养和发育,有6天-7天的过程,均发生在体外的离体环境。CRISPR-Cas9基因编辑在辅助生殖技术中的潜在的技术碰撞与融合,无疑将充满无限空间供人类憧憬与遐想。不过,将基因编辑技术前所未有地引入人类胚胎的安全性值得特别关注。尽管这些妙处令人垂涎,但其系统固有的局限性也清晰可见。首先是脱靶效应。
将基因编辑技术前所未有地引入人类胚胎的安全性值得特别关注。因为所有基因编辑工具都是可编程的核酸酶,如果设计的核酸酶一旦脱靶,有可能另外一个基因被诱发突变,导致可能与靶基因突变预期的结果混淆的效应或表型,这样的意外的脱靶突变可能导致细胞癌变或丧失功能。当使用培养的细胞而不是胚胎时,脱靶事件不太成问题,因为筛除脱靶诱发的突变细胞系是可行的。
然而,辅助生殖技术的对象就是生殖细胞或胚胎,其遗传修饰是永久性的,而且会遗传给下一代。因此,目前正在进行的多项研究工作都致力于减少脱靶效应。
第二是嵌合体问题。当使用基因编辑技术时,出现嵌合体和不完全的基因组靶向编辑是相当普遍的,因为大多数CRISPR基因编辑系统更适用处于细胞分裂时期的细胞进行基因组修饰。CRISPR-Cas9基因编辑系统应用于辅助生殖技术领域同样伴随着脱靶效应及胚胎细胞的嵌合体问题,这样可能会影响到移植胚胎的基因表达及婴儿的健康。
生殖系基因编辑后的临床风险评估复杂且困难。总体看,在胚胎移植和随后的怀孕阶段,使用羊膜穿刺或绒毛活检的临床管理可以进一步检测基因编辑结果。因此,进行基因编辑的有利之处将可能大于风险。而事实上,由于内细胞团中可能存在的染色体嵌合,生殖医学可能无法百分之百防止某些遗传疾病在后代发生。以至于出生后,儿童期或成年期后可能仍然受到遗传疾病影响。
基因编辑技术的临床应用
世界范围内大约六分之一的夫妇会遇到与不孕相关的问题。基因编辑可以帮助挽救突变胚胎,增加移植的健康胚胎数量,最终提高妊娠率为目的。遗憾的是,我们还不太清楚调节人类胚胎细胞的机制,着床前胚胎正常发育调控的分子机制对辅助生殖技术的影响。
发育生物学家对控制小鼠胚胎着床前发育的基因和机制进行了深入的了解,然而,由于小鼠基因组与人类基因组相比序列上有显著差异,二者胚胎着床前发育和多能性之间也有显著差异,同时越来越多的研究使我们意识到,通过胚胎着床前小鼠发育的遗传研究产生的丰富知识并不容易直接应用到人类胚胎。
最近一个英国研究团队用CRISPR-Cas9介导的基因编辑,研究人类胚胎发育过程中发育多能性转录因子OCT4基因的功能,同时通过导向RNA靶向诱导人类胚胎干细胞的小鼠受精卵显微注射来诱导OCT4基因突变,来确定OCT4基因发育过程中的功能。结果显示,小鼠胚胎保持了其源于共同祖先的基因表达,并且胚胎可以发育到囊胚。这表明,OCT4基因功能丧失在人和小鼠胚胎中具有不同的后果。
世界范围内有超过1万种单基因遗传疾病,这是由DNA中单个基因的单一错误引起的。如β-地中海贫血、镰状细胞病和1型脊髓性肌萎缩等。目前辅助生殖移植前,基因诊断(PGD)技术已经可成功预防这些遗传疾病,成为防止常染色体显性遗传疾病的唯一方法。
PGD于1989年首次被引入生殖医学。严格意义上讲,PGD不是辅助生殖技术。它只是一个诊断程序,可以诊断特定胚胎是否携带单个突变基因而已,而非纠正胚胎携带遗传变异基因的治疗手段。
例如,在亨廷顿病和型神经纤维瘤病携带者中,即便准父母只有一方携带该常染色体显性突变基因,其后代也有50%的发病几率。一种更极端的情况是,当准父母中一方携带常染色体显性突变基因为纯合子时,传播给后代的风险高达100%,因此借助于辅助生殖技术无法获得无突变的胚胎。
PGD无效的另一种情况是准父母双方含常染色体隐性突变基因均为纯合子,意味着它们都携带两个等位致病基因。在这种情况下,基因编辑可作为PGD的替代方案,为一些准父母辅助生殖技术的新选项,如在胚胎移植前,对精子、卵子,或试管受精产生的胚胎均可以进行突变基因的修复。最后,基因编辑技术可以对携带线粒体基因突变卵母细胞和胚胎的线粒体DNA突变通过基因编辑来纠正线粒体基因突变。对此,PGD作为遗传基因的诊断技术则完全束手无策。
美国哈佛大学David R. Liu团队2016在《自然》发表了具划时代意义的纠正基因突变的替代方法。新方法不需要诱导双链DNA断裂即可纠正基因组DNA中的点突变,暨“碱基编辑” 技术,可以直接、不可逆地将单一DNA碱基转换为另一个碱基,且不需要DNA主链切割或供体模板。2017年10月25日Broad研究所教授、华人学者David Liu在《自然》上发表了第七代 “碱基编辑器” , 即腺嘌呤碱基编辑系统(ABE)。该系统只要通过对DNA的碱基进行原子重排,无需使DNA断裂,就能完成基因的精准编辑,促进遗传疾病的研究和治疗。在矫正单碱基突变方面,它比CRISPR-Cas9系统更为有效,也更“干净”。排除了能引起任何随机插入和删除等突变的可能性,在全基因组里的脱靶效应也要好于CRISPR-Cas9技术。
9月23日中山大学的一个研究团队发表在《Protein&Cell1》上的论文显示,他们成功地将“碱基编辑”技术精确地应用于纠正人类胚胎中的β-地中海贫血,证明了在人编辑系统体细胞和克隆移胚胎(模拟纯合突变疾病胚胎)中治愈遗传疾病的可行性。
当PGD需要选择胚胎时,CRISPR更类似于治疗,是预防性的“先发制人”的治疗方法。
作为选择性技术的PGD(目前)和治疗性技术的CRISPR(可能在未来)是两种可以实现类似目的的技术:在这两种情况下,这些技术增加了父母遗传相关后代不受特定遗传条件影响的机会。
未来展望
CRISPR-Cas9可通过去除和替代有缺陷的基因,例如血友病、癌症、1型糖尿病,来治疗和预防疾病。这种干预措施不仅可以改善患者的生活质量和持续时间,而且还可以挽救家庭,减缓政府和医疗机构所承受的巨额药物、康复服务等的经济负担。
据经济学家估计,2016年到2024年,全球植入前遗传学诊断(PGD)市场年均复合增长率为6.2%-6.3%。中国对胚胎进行遗传学筛查和诊断潜在市场约80亿-100亿元。可见基因编辑对PGD的潜在替代作用、研发和市场扩张,必将为未来几年的市场提供发展空间和广阔的经济前景。
对于变异基因携带者夫妇或个人,将变异基因传播给下一代风险是他们不得不正视的挑战。世界范围内,由于地域、文化、宗教、法律,乃至国情的差异,这一群体在避免将变异基因传播给下一代方面,可以有多样化的选择。
俄勒冈美国国家灵长类研究中心Shoukrat Mitalipov团队最近在《自然》上发表他们的研究结果。他们认为,基因编辑可能对植入前遗传学诊断有补充作用来纠正人类胚胎中的遗传突变。科学家们能够在72%的胚胎中成功纠正突变的基因。研究人员假设,可能有一种以前未知的细胞分子生物学机制参与CRISPR纠正突变的基因,用来自卵母细胞的基因的“健康”DNA替代携带该突变的基因。如果此假设存在,这一基因编辑纠正突变基因后留给子代的基因组将无“非自然”成分。因为这种形式的遗传编辑可以留下处于自然遗传状态的野生型基因,将会更容易被公众接受。
然而,通过基因编辑虽可实现避免缺陷婴儿出生,增进人类健康等积极作用,但同时也对生命、人格尊严构成挑战。因而严格行业内监管与质量控制,是政府职能部门面临的新挑战。目前尚不能清楚地概述基因编辑技术应用于辅助生殖技术相关的所有潜在的监管问题,但主要应当着眼于安全性、有效性和质量控制。美国食品和药品监督管理局(FDA)和欧洲药品管理局(EMA) 发布的基因和细胞治疗的质量控制相关指导可资借鉴。
从安全角度看,在人类基因编辑应用于辅助生殖技术或生殖系细胞基因编辑之前,所需的最低要求应该是,定义广泛接受的人类基因编辑方法的定义,测定和监测非目标诱变的最低标准;关于人类基因编辑造成脱靶突变产生的可能影响共识,制定可接受脱靶突变的最大阈值;关于可接受的基因编辑类型对于其潜在的意想不到的后果的共识。
应依据该技术应用的不同类型明确监管的权威机构,并需完善操作环节的技术规范。
在2015年初,中国科学家率先使用CRISPR-Cas9对人类不能正常发育到期受精卵进行基因编辑,刺激了许多科学家和组织澄清他们对使用编辑方法的立场,导致世界范围内对基因编辑技术已经表达了各种各样的关切。英国和瑞典都准许从事人类胚胎基因组编,但不包括植入胚胎的实验。在英国,人类受精和胚胎管理局(HFEA)批准了伦敦弗朗西斯克里克研究所的发育生物学家凯西•尼亚坎(Kathy Niakan)在健康人体胚胎中使用CRISPR-Cas9的应用。
美国国家科学院(NAS)和美国国家医学研究院(NAM)的立场是,如果基因编辑目的是治疗或预防严重的遗传疾病,而且基因编辑该程序被证明是安全的,那么使用诸如CRISPR-Cas9的基因编辑技术来纠正生殖系细胞严重的遗传基因突变则可以接受。
2017年8月3日,在美国人类遗传学杂志联合具有遗传学专业知识的11个团体和国际组织发表了联合立场声明,阐述了人类生殖系细胞基因编辑问题的三个关键立场:第一,在科学、伦理和政策的诸多问题尚未有答案或取得共识的情况下,目前,以怀孕为目的进行生殖系细胞基因编辑是不合适的。
第二,为了基因编辑应用于未来临床服务,当下只要有效监督并得到捐助者的知情同意,没有理由禁止人类胚胎和配子的体外生殖系细胞基因编辑,也不应该禁止公共资金对此类研究项目资助。
第三是人类生殖系细胞基因编辑的未来临床应用不应该进行,除非存在(a)令人信服的医学理由,(b)支持其应用于临床的证据基础,(c)道德上的理由,以及(d)公开透明的程序征得利益攸关方的意见。
与此同时,基因编辑治疗引起了国际制药公司的极大兴趣,2017年10月12日美国一家致力于挑战遗传疾病基因治疗公司Spark Therapeutics宣布,FDA和基因治疗咨询委员会一致推荐批准LUXTURNA(voretigene neparvovec)用于治疗由确认的双侧RPE65介导的遗传性视网膜引起的视力丧失患者疾病(IRD)。这是首款研究性的潜在具有一次性基因编辑治疗的药物。
在CRISPR-Cas9基因编辑时代,我们可能会期待更多这样的突破性决策,因为CRISPR - Cas9以基因定位的简单性、灵活性和准确性,叩响了辅助生殖技术的大门,如何看待、接纳和扶持这一新兴技术考验国人乃至全人类的智慧。
(孟励为美国路易斯威尔大学生育中心主任、河南省人民医院特聘教授,张翠莲为河南省人民医院生殖医学中心主任,编辑:王小)
(本文首刊于2017年12月4日出版的《财经》杂志)
 基因君官网
基因君官网