2017年10月27日/生物谷BIOON/—CRISPR/Cas系统是目前发现存在于大多数细菌与所有的古菌中的一种免疫系统,被用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。在CRISPR/Cas系统中,CRISPR是规律间隔性成簇短回文重复序列(clustered regularly interspaced short palindromic repeats)的简称,涉及细菌基因组中的独特DNA区域,也是储存病毒DNA片段从而允许细胞能够识别任何试图再次感染它的病毒的地方,CRISPR经转录产生的RNA序列(被称作crRNA)识别入侵性病毒的遗传物质。Cas是CRISPR相关蛋白(CRISPR-associated proteins, Cas)的简称,Cas蛋白像一把分子剪刀那样切割细菌基因组上的靶DNA。
然而,目前得到广泛应用的CRISPR/Cas9系统经常会发生脱靶效应,导致科学家们不想要的结果。作为CRISPR/Cas9系统的一种潜在的对手,CRISPR-Cpf1系统是一类新型的CRISPR-Cas系统,作为基因编辑的新工具,它进一步扩大了基因编辑靶位点的选择范围,同时几乎没有脱靶效应,已广泛引起人们的关注。
与过去的CRISPR/Cas9基因编辑系统相比,新的CRISPR/Cpf1基因编辑系统拥有五大优势:(1)只需一个协助RNA分子。Cas9需要2个RNA分子协助,Cpf1(也称作Cas12a)只需要一个RNA分子;(2)Cpf1酶分子量比Cas9小,进入细胞更容易,编辑成功率会提高;(3)Cpf1系统不同的识别序列令其基因编辑效果更好;(4)剪切位置与Cas9不同,选择余地更大:(5)产生黏性末端,便于新DNA序列插入。
基于此,小编针对近年来CRISPR-Cpf1系统研究取得的进展,进行一番梳理,以飨读者。
1.Nature:重大发现!史上最简单的CRISPR/Cpf1系统可切割DNA和RNA
doi:10.1038/nature17945
在一项新的研究中,来自德国马克斯普朗克感染生物学研究所、亥姆霍兹传染病研究中心和瑞典优密欧大学(Umeå University)的研究人员描述了酶Cas9的一种潜在替代者—来自土拉热弗朗西丝菌(Francisella novicida)的CRISPR结合蛋白Cpf1—的特征:Cpf1表现出双重切割活性:不仅切割DNA,而且也切割RNA。与CRISPR-Cas9不同的是,Cpf1能够独自地对crRNA前体(pre-crRNA,编者注:CRISPR DNA片段经转录而形成的CRISPR RNA前体)进行加工,然后利用加工后产生的crRNA特异性地靶向和切割DNA,因而也就不需要来自宿主细胞的核糖核酸酶(RNase)和tracrRNA,这是人们迄今为止发现的一种最简单的CRISPR免疫系统。这一发现可能给科学家们提供一种新的序列特异性基因组编辑方法,更为重要的是,还可能便于一次对多种靶位点进行编辑,即所谓的多重编辑。相关研究结果于2016年4月20日在线发表在Nature期刊上,论文标题为“The CRISPR-associated DNA-cleaving enzyme Cpf1 also processes precursor CRISPR RNA”。论文通信作者为来自马克斯普朗克感染生物学研究所的Emmanuelle Charpentier。
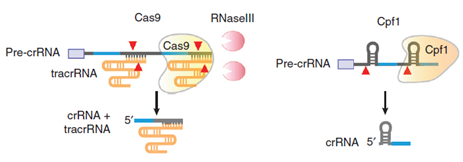
CRISPR-Cas是细菌免疫系统的一部分,被用来抵抗病毒感染。在CRISPR-Cas9系统中,酶Cas9在病毒DNA靶位点上进行切割,其中这种靶位点是这样确定的:一种被称作CRISPR RNA(crRNA)的RNA分子利用它的一部分序列与另一种被称作tracrRNA的RNA分子通过碱基配对结合在一起,形成嵌合RNA(tracrRNA/crRNA),然后,借助crRNA的另一部分序列与靶DNA位点进行碱基配对,以这种方式,这种嵌合RNA就能够引导Cas9结合到这个靶位点上并进行切割,也因此这种嵌合RNA也被称作向导RNA(guide RNA, gRNA)。细菌就利用这种工作机制阻止病毒感染。
如今,研究人员发现发现一些细菌的免疫防御系统在结构上要比CRISPR-Cas9更加简单。除了Cas9之外,这些细菌利用酶Cpf1切割外源DNA。这项研究证实Cpf1能够切割RNA和DNA。Cpf1首先移除crRNA前体的部分序列,辅助后者产生成熟的crRNA。因此,诸如RNase III之类的其他酶是不需要的。成熟的crRNA然后引导Cpf1结合到DNA的靶序列上。
因此,Cpf1具有双重功能:它对crRNA进行加工让后者能够发挥功能,然后在特异性的序列上切割靶DNA。此外,不同于Cas9,Cpf1并不需要tracrRNA分子的帮助结合到靶序列上。因此,它在结构上比CRISPR-Cas9更加简单。Charpentier解释道,“CRISPR-Cpf1是一种即插即用的系统,不再需要其他的组分。相反,在自然环境中,CRISPR-Cas9系统需要其他的助手来加以激活。”
2.Cell:第二代基因编辑神器诞生,CRISPR/Cpf1让一切皆有可能!
doi:10.1016/j.cell.2015.09.038
1987年,科学家首次描述了CRISPR序列;2010和2011年,研究人员相继发现了该序列的自然生物学功能;2013年,张锋等科学家首次报道了CRISPR-Cas9系统在哺乳动物基因组编辑中的应用。张锋此前发表过大量Cell,Nature,Science文章,是基因编辑领域的超级新星,也是未来诺贝尔奖有力的争夺者。
2015年9月22日,发表在《细胞》杂志上的一项研究中,CRISPR技术先驱、Broad研究所合成生物学家张锋领导的研究小组找到一种让该技术更简单、更精准的方法。一种叫做Cpf1的蛋白可能将克服CRISPR-Cas9系统应用中的一些限制。虽然CRISPR-Cas9系统适用于让基因失去功能,但是对于真正实现用一个DNA序列的替换另一个还很困难。
尽管CRISPR比之前的基因编辑方法要简单得多,但是张锋认为仍有改进的余地。他和他的团队搜索了整个细菌王国,找到了一种替代实验室中常用Cas9酶的选择。今年4月,相关论文发表在《自然》杂志上,他们在金黄色葡萄球菌中发现了一个更小版本的Cas9。小的型号让Cas9酶更容易进入成熟细胞,这类细胞是一些潜在疗法的关键“目的地”。
虽然研究小组此次发现的Cpf1蛋白与Cas9相比有很多不同,但是也在一些细菌中与CRISPR共同存在。科学家们评估了来自16种不同细菌的Cpf1酶,最终发现有2种Cpf1能够剪切人类DNA。与Cas9相比,Cpf1有以下四大优势:
第一, 大小不同。Cas9剪切DNA需要两个小RNA分子,而Cpf1只需要一个。Cpf1酶比标准的SpCas9要小,更容易进入组织和细胞。
第二, 剪切方式不同。Cas9是在同一个位置同时剪切DNA分子的双链,最后形成的是分子生物学家常称的平末端;而Cpf1剪切后形成是两个不同长度的链,被称之为黏性末端。平末端通常不容易处理。张锋说:“粘性末端让DNA插入更可控。”
第三, 剪切位置不同。Cpf1剪切时离识别位点很远,这让研究人员在编辑位置的选择上有了更多的选项。
第四, Cpf1系统在目标位置的选择上提供了灵活性。像Cas9一样,Cpf1复合物首先必须连接一个叫做PAM的短序列,目标位置必须是与天然存在的PAM序列相邻。与Cas9相比,Cpf1复合物识别的PAM序列是非常不同的。
3.Nucleic Acids Res:上海生科院在Cpf1蛋白切割机理方面取得新进展
doi:10.1093/nar/gkx018
The CCTL (Cpf1-assisted Cutting and Taq DNA ligase-assisted Ligation) method for efficient editing of large DNA constructs in vitro
1月11日,国际学术期刊《核酸研究》(Nucleic Acids Research)在线发表了中国科学院上海生命科学研究院植物生理生态研究所赵国屏研究组题为The CCTL (Cpf1-assisted Cutting and Taq DNA ligase-assisted Ligation) method for efficient editing of large DNA constructs in vitro 的研究论文。该工作鉴定了Cpf1蛋白的精确切割位点,并基于该切割特性开发新的DNA无缝拼接方法。
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)是存在于原核生物中的获得性免疫系统,CRISPR相关蛋白Cas9已广泛应用于基因组编辑和许多其他应用当中。Cpf1蛋白隶属于II类type V CRISPR系统。相比于Cas9蛋白,Cpf1蛋白具有类似的基因组编辑效率,但具有较低的脱靶效应,在基因治疗应用中具有巨大的潜力。不同于Cas9,Cpf1由单个crRNA指导,并利用富含T的protospacer相邻基序(PAM)序列切割双链DNA(dsDNA)靶标,形成5-nt粘性末端。Cpf1的切割特性使得其成为有效的体外DNA拼接工具,并且最近的研究中报道了基于Cpf1消化和T4DNA连接酶介导的连接建立的DNA拼接标准C-Brick。
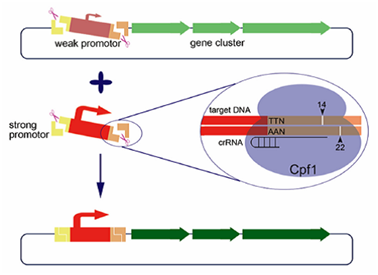
在该研究中,研究人员发现,Cpf1切割靶标DNA并不像之前报道的那样,只切割靶标DNA互补链的23位和非互补链的18位,而是在非互补链的14位到18位形成多个切割位点。除此之外,该文研究人员还发现Cpf1的切割位点受到crRNA spacer序列长度的影响。当spacer序列长度大于等于20的时候,Cpf1倾向于切割非互补链的18位,而当spacer序列长度小于20的时候,Cpf1倾向于切割非互补链的14位。基于Cpf1在较短spacer长度的crRNA介导下,可以特异切割靶标DNA的14位与22位,形成8-nt的长黏性末端的特性,结合Taq DNA连接酶高精度的连接特性,研究人员将其开发为一个大DNA片段体外无缝编辑的新工具。在应用实例中,研究人员成功将30kb的放线紫红素合成基因簇内部调控基因actII-orf4 的启动子进行了原位的替换。经过反应条件的优化,替换的阳性率达到70%以上。该方法为大片段体外编辑提供了一个高效工具。
4.Nat Commun:上海生科院建立高效谷氨酸棒杆菌CRISPR-Cpf1基因组编辑系统
doi:10.1038/ncomms15179
5月4日,《自然-通讯》(Nature Communications)发表了中国科学院上海生命科学研究院植物生理生态研究所合成生物学重点实验室杨晟研究组题为CRISPR-Cpf1 assisted genome editing of Corynebacterium glutamicum 的研究成果,发现弗兰西斯菌来源的Cas效应蛋白(FnCpf1)与谷氨酸棒杆菌适配,而SpCas9则表现出对谷氨酸棒杆菌的毒性,并建立了高效的谷氨酸棒杆菌CRISPR-Cpf1基因组编辑系统。
CRISPR-Cas是当前最强有力的基因组编辑技术。基于化脓链球菌来源的Cas效应蛋白(SpCas9)最初被开发为人类细胞的基因组编辑工具,随后被适配到各个物种细胞中,被认为是“战无不胜攻无不克”的Cas效应蛋白。但在谷氨酸棒杆菌这一最重要的氨基酸生产菌株中,SpCas9却难以适配应用。
杨晟研究组开发的这套CRISPR-Cpf1基因组编辑方法,结合单链重组系统实现了基因组精细修改,最高效率达到100%;亦可实现大片段缺失和插入,将原先每轮一周的基因组编辑操作缩短到3天。以L-脯氨酸合成代谢关键酶γ-谷氨酰激酶的149位甘氨酸为例,应用CRISPR-Cpf1基因组编辑系统对其实施原位饱和点突变,可成功筛选获得抗L-脯氨酸反馈抑制的高产菌株。
5. Nature:新型基因编辑Cpf1/CRISPR的RNA复合物被中国学者破译
doi:10.1038/nature17944
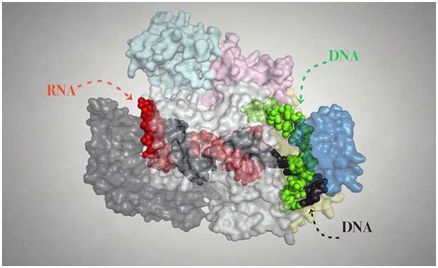
来自哈尔滨工业大学、清华大学的研究人员报告称,他们获得了Cpf1/CRISPR RNA复合物的晶体结构。这一重要的研究成果发布在4月20日的《自然》(Nature)杂志上。
在这篇Nature文章中,作者们报告称获得了结合CRISPR RNA (crRNA)的毛螺科菌(Lachnospiraceae bacterium) ND2006 Cpf1 (LbCpf1)的晶体结构,分辨率达到2.38埃(Å)。他们发现LbCpf1具有一种三角形体系结构,中心有一个大的正电荷通道。被LbCpf1的寡核苷酸结合结构域所识别,crRNA采用了一种高度扭曲的构象,广泛的分子内互作和(Mg(H2O)6)2+离子对这一构象起稳定作用。LbCpf1的寡核苷酸结合结构域还包含一个环凸(looped out)螺旋结构域,其对于LbCpf1底物结合至关重要。结合crRNA或缺乏向导序列的crRNA均可诱导LbCpf1显著的构象改变,但不能诱导LbCpf1低聚化。
新研究揭示出了crRNA的识别机制,提供了crRNA引导LbCpf1底物结合的一些新见解,为设计改造LbCpf1提高基因编辑的效率和特异性建立了一个框架。
6. Mol Plant:逆境中心利用CRISPR/Cpf1系统简单高效实现水稻多基因定点编辑
doi: 10.1016/j.molp.2017.03.001
近年来,科学家发现并改造出Cpf1 (CRISPR from Prevotella and Francisella 1)系统,研究表明该系统能克服CRISPR/Cas9的上述局限,它不需要tracrRNA的辅助,并且Cpf1蛋白兼具DNA剪切酶和RNA修剪酶的功能,不但能靶向切割DNA双链,而且能把相应的非成熟型CrRNA(pre-crRNA)加工剪切成成熟型CrRNA。
3月18日,Molecular Plant杂志在线发表了中国科学院上海生命科学研究院植物逆境生物学研究中心朱健康课题组题为“Multiplex Gene Editing in Rice using the CRISPR-Cpf1 System”的研究论文。
该工作利用Francisella novicida Cpf1 (FnCpf1)和 Lachnospiraceae bacterium ND2006 Cpf1 (LbCpf1)对水稻进行单位点和多位点基因敲除的测试,研究表明上述两个Cpf1只需一条非常短的20-21bp的直接重复序列(direct repeats, DR)加上22-24bp的靶位点识别序列(guide)即可实现单基因敲除,更重要的是,把多个DR-guide单元直接串联,只需要一个启动子驱动即可简单高效地实现多基因敲除。该研究利用4个DR-guide单元组成的CrRNA短阵列分别对水稻RLK和CYP81A家族的四个基因进行编辑,各位点的敲除效率达到40-75%。该系统简单、高效地在水稻中实现了多基因定点编辑,拓展了CRISPR系统在植物中的应用,为水稻基因组定点编辑提供了一个新利器。
7. Nat Biotechnol:证实CRISPR/Cpf1基因组编辑几乎没有脱靶效应
2016年6月6日,doi:10.1038/nbt.3609
作为CRISPR基因组编辑的新工具,Cpf1因其不同于Cas9的性质而引起人们的广泛关注。它只需要单个RNA,即crRNA(CRISPR RNA),因而组装更加简单;它的交错切割模式可能促进利用所需的序列替换现有的DNA序列;它识别富含胸腺嘧啶的DNA序列,而且相对于Cas9识别的富含鸟嘌呤的序列,人们很少探讨这种序列。总之,Cpf1有望扩大CRISPR基因组编辑靶位点的范围,同时具有更好的编辑效率。
尽管Cpf1有巨大潜力成为一种强大的基因组编辑工具,但是人们很少证实这种新的工具如何特异性地找到它的靶位点。在一项新的研究中,来自韩国基础科学研究所(IBS)基因组编辑中心的研究人员证实作为一种高度特异性的可编程工具,Cpf1适合用于精确的基因组编辑。相关研究结果于2016年6月6日在线发表在Nature Biotechnology期刊上,论文标题为“Genome-wide analysis reveals specificities of Cpf1 endonucleases in human cells”。
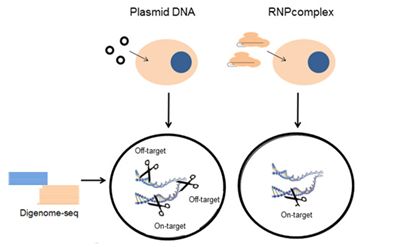
研究人员使用了两种类型的Cpf1家族蛋白(AsCpf1和LbCpf),这是因为它们是同类蛋白中编辑效率最高的,并开展Digenome-seq测试:他们设计出的一种测试方法以便在全基因组中鉴定出Cpf1能够进行切割的靶位点(on-target site)和脱靶位点(off-target site)。不含细胞的基因组DNA是从人细胞中分离出的,然后利用事先组装的重组Cpf1核糖核蛋白(RNP,编者注:由crRNA和Cpf1进行组装而形成)对该基因组DNA进行切割,随后进行全基因组测序。通过对对应于体外靶切割位点和脱靶切割位点的测序序列片段进行比对,就可通过计算鉴定出这些位点。
基因组分析表明Cpf1是高度特异性的,与Cas9相比,只有更少的脱靶切割位点(对LbCpf1而言是6个,对AsCpf1而言是12个),而Cas9能够切割人基因组上的90多个位点。特别地,在大多数体外脱靶切割位点中,代表脱靶效应的核苷酸插入或删除(insertion or deletion, indel)发生率低于0.1%,远低于对应的靶位点上的indel发生率,这提示着这两种Cpf1蛋白几乎没有脱靶效应。
8.Sci Adv:重磅!研究人员使用CRISPR-Cpf1治疗杜氏肌营养不良
2017年4月12日,doi:10.1126/sciadv.1602814
德州大学西南医学研究中心研究员利用新的基因编辑酶CRISPR-Cpf1在实验室了人类细胞和老鼠体内的杜氏肌营养不良。该研究组过去使用原有的基因编辑系统CRISPR-Cas9纠正患有此病的老鼠模型和人类细胞内的杜氏肌缺陷。在目前的研究中,他们使用一种新的基因编辑系统,用于修复老鼠模型和人类细胞中的缺陷。
“我们研究了最常见的导致杜氏肌营养不良的患者细胞。我们在体外对它们进行纠正,以恢复细胞内缺失的抗肌营养不良蛋白。这项研究提供给了我们CRISPR工具箱中一个很有潜力的工具,” Wellstone肌肉萎缩联合研究中心、Hamon再生科学和医学中心主任、分子生物学主席Eric Olson博士说。该研究发表于Science Advances杂志。
CRISPR-Cpf1在很多关键方面不同于CRISPR-Cas9。Cpf1比Cas9酶小很多,这就使之更容易包装到病毒内,因此也更加容易进入肌细胞。与Cas9 相比,它也能识别不同的DNA序列。就其实用性而言,它提供了更大的灵活性。“有一些基因很难用Cas9编辑,但是更容易用Cpf1修饰。因为这两种蛋白质有不同的生化性质,能识别不同的DNA序列,所以这些特性能为基因编辑创造更多的选择,”先天性心脏缺陷研究杰出教授Olson博士说。
“通过敲除突变区域或精确修复突变基因,CRISPR-Cpf1介导的基因编辑不仅纠正了杜氏肌萎缩症突变,而且还改善了肌肉收缩能力和强度,”分子生物学教授、Hamon再生科学和医学研究中心副主任、Rhonda Bassel的合著者Duby博士说。
9. Nat Biotechnol:张锋再发CRISPR新突破!“魔剪”可实现同时编辑4个基因
2016年12月5日doi:10.1038/nbt.3737
12月5日,Nature Biotechnology杂志在线发表了题为“Multiplex gene editing by CRISPR–Cpf1 using a single crRNA array”的研究成果。CRISPR先驱张锋以及Wageningen大学的John van der Oost是这篇论文的共同通讯作者。
近几年,CIRSPR技术飞速发展,除了“元老”CIRSPR/Cas9系统,科学家们还找到了一些新“选手”。2015年9月,张锋研究组在Cell杂志上发表的一篇论文中首次提出了新型基因编辑系统CRISPR/Cpf1。Broad研究所Eric Lander教授称,该研究证明了Cpf1在编辑人类基因组中非凡强大的功能。
在这项新研究中,科学家们发现,CRISPR/Cpf1系统能够克服Cas9靶向多个基因位点的限制。研究表明,Cpf1加工自身CRISPR RNA (crRNA)的能力可用于简化多重基因组编辑。使用单个定制的CRISPR阵列(array),研究人员实现了在哺乳动物细胞中同时编辑多达4个基因,在小鼠大脑中同时编辑3个基因。
10. Cell & Cell Res:解析出Cpf1-crRNA-靶DNA三元复合物的晶体结构
doi:10.1016/j.cell.2016.04.003; doi:10.1038/cr.2016.88
为了阐述Cpf1如何识别和剪切DNA,MIT的张峰研究组和东京大学Osamu Nureki教授、中国科学院生物物理研究所的高璞研究组与纪念斯隆-凯特琳癌症中心的研究人员先后解析了AsCpf1-crRNA-DNA三元复合物晶体结构。
Cpf1和Cas9的核糖核蛋白三元复合物具有相似的整体结构。AsCpf1与Cas9同样采用二裂片结构,外观呈蟹钳状,分为识别叶 (Recognition lobe,REC) 和核酸酶叶 (Nuclease lobe,NUC)。但不同的是,Cas9核酸酶叶包含RuvC和HNH两个核酸酶结构域,分别负责切割非靶向和靶向DNA链,产生平末端;而AsCpf1的NUC叶没有HNH结构域,由RuvC结构域和一个推定的新的核酸酶结构域 (Nuc) 组成,分别负责切割非靶向及靶向DNA链,产生黏性末端。RuvC剪切非靶向DNA链是Nuc剪切靶向DNA链的先决条件。
另外,Cpf1-crRNA二元复合物和Cpf1-crRNA-DNA三元复合物的结构的比较也揭示了Cpf1与Cas9不同的DNA识别机制。
首先,sgRNA和crRNA上靠近PAM序列的区域均存在一段“种子序列”,可与靶DNA序列互补配对,对于Cas9和Cpf1识别和切割DNA至关重要。由于sgRNA和crRNA在二元复合体中呈现不同的构象,“种子序列”在Cas9-sgRNA二元复合体中形成有序的A型结构,而在Cpf1-crRNA二元复合体中是无序的,在Cpf1-crRNA-DNA三元复合体中才转变为有序的A型结构。
其次,PAM互作裂缝在Cas9-sgRNA二元复合体中也已预先形成,是Cas9识别目标DNA的另一个关键结构,但在Cpf1-crRNA二元复合体中还未形成,目标DNA的结合诱导Cpf1内部结构重排,多个结构域发生空间位移,PAM互作裂口经历一个“从开到关”的构象改变,以容纳有序的A型种子序列和靶DNA在正电荷通道内形成异源双链核酸分子。
Cpf1识别目标DNA时种子序列“从无序到有序”和PAM互作裂缝“从开到关”的构象变化,可能有利于降低其基因编辑的脱靶效应。
11. Nat Biotechnol:张峰研究组扩展CRISPR/Cpf1 的靶点选择范围
doi: 10.1038/nbt.3900
6月5日,Nature Biotechnology杂志在线发表张峰研究团队题为“Engineered Cpf1 variants with altered PAM specificities” 研究论文,通过突变AsCpf1和LbCpf1的方法,扩大了靶点选择范围。
CRISPR/cpf1自被发现以来,已经在不同物种中得到应用,但其靶点选择仅限于PAM为TTTV 的DNA序列,研究人员通过筛选突变体的方式扩大了PAM位点的选择范围,例如 AsCpf1突变S542R/K607R 和 S542R/K548V/N552R后可以分别识别PAM为 TYCV 和TATV的DNA序列,并且提高了活性。全基因组范围脱靶分析表明这些突变体对其高特异性并没有影响,LbCpf1同样的突变位点表现出相同的结果。
12. Nat Chem Biol:突破!科学家成功优化CRISPR-Cpf1技术使其更加高效地编辑人类基因组
doi:10.1038/nchembio.2410
近日,一项刊登在国际杂志Nature Chemical Biology上的研究报告中,来自斯克里普斯研究所的研究人员通过研究改善了当前最先进的基因编辑技术,使其能够更加精准地靶向切割并且粘贴人类和动物细胞中的基因,同时研究者还扩展了CRISPR-Cpf1基因编辑系统使其能够用来研究以及帮助抵御人类疾病。
文章中,研究人员通过将导向RNAs和“复用”能力合并,改善了CRISPR-Cpf1基因编辑系统的作用效率;研究者Guocai Zhong说道,这种系统能够简单、明显改善同时对多个基因或单个基因多个位点的编辑能力,这或许对于靶向作用多个疾病相关的基因或疾病相关基因的多个位点非常有帮助。
研究者Farzan指出,效率是非常重要的,如果你能够修饰肝脏中的25个细胞,似乎是无意义的,但如果能够对肝脏中一半的细胞进行修饰,那么这或许具有重大意义。当然如果该系统还能够帮助修复肌肉细胞中基因的话,或许就能够帮助恢复患者的肌肉功能。目前Cas9和Cpf1是最常用的两种分子剪刀,研究者Farzan重点对Cpf1进行关注,因为其能够更加精确地对哺乳动物细胞进行作用,Cpf1分子来自两种类型的细菌:拉克诺螺旋菌科细菌和嗜酸菌属细菌,这些分子的关键特性就是能够对RNAs进行引导,但目前研究人员并不清楚这些分子如何同哺乳动物细胞所产生的RNA发生作用,文章中,研究者通过将萤火虫发光基因编辑到细胞的染色体中进行深入研究,随后他们发现,这种修饰后的CRISPR-Cpf1系统能够像预期一样发挥作用。
13. Nat Commun:利用CRISPR/Cpf1改进大豆油中的脂肪含量
doi:10.1038/ncomms14406
在一项新的研究中,来自韩国基础科学研究所(Institute for Basic Science, IBS)基因组工程中心的研究人员利用新的CRISPR-Cpf1技术成功地对改变大豆油中的脂肪含量的两个基因进行编辑。CRISPR-Cpf1是一种更为广泛使用的基因编辑工具CRISPR-Cas9的替代性方法。这种新的植物基因编辑方法对大豆和野生烟草基因进行编辑取得的结果于2017年2月16日在线发表在Nature Communications期刊上,论文标题为”CRISPR/Cpf1-mediated DNA-free plant genome editing”。
IBS研究人员设计CRISPR-Cpf1复合物对大豆中的两个FAD2基因进行切割。这两个基因是将油酸(一种脂肪酸)转化多不饱和亚油酸(另一种脂肪酸)的通路的一部分。通过让这两个FAD2基因发生突变,大豆种子中的油酸比例增加了,这导致更加健康的脂肪含量产生。
IBS研究人员也证实CRISPR-Cpf1并不能够切割大豆基因组中的非靶标位点。这些结果证实CRISPR-Cpf1是一种高度有效的技术。再者,这种方法是100%的不含有DNA(DNA-free)。它通过化学合成crRNA而无需导入外源DNA。这消除了外源DNA(用作RNA合成的模板)残留的风险。
IBS研究人员也发现相比于CRISPR-Cas9,CRISPR-Cpf1具有至少三种益处:CRISPR-Cpf1技术具有更短的crRNA,因此能够化学合成这种RNA;CRISPR-Cpf1在靶基因上产生更大的序列删除(7个碱基对),因而让这种基因完全失去作用;Cpf1的切割类型可能有助优化基因编辑过程。
14. Nature:从结构上揭示CRISPR-Cpf1的DNA靶向机制
doi:10.1038/nature22398
图片来自University of Copenhagen。
在一项新的研究中,来自丹麦哥本哈根大学的研究人员发现了一种新的被称作Cpf1的分子剪刀如何让DNA解链,并对它进行切割。这个CRISPR-Cas家族成员表现出较高的准确性,能够像全球定位系统(GPS)那样发挥作用以便鉴定出基因组中的靶位点。Cpf1的高精准度将会改进这种技术在修复基因损伤、其他医学应用和生物技术应用上的使用。
这些研究人员成功地可视化观察和描述了Cpf1的工作方式。这种蛋白属于Cas家族,能够切割双链DNA,因而允许启动这种基因组修饰过程。相关研究结果发表在2017年6月22日的Nature期刊上,论文标题为”Structure of the Cpf1 endonuclease R-loop complex after target DNA cleavage”。论文通信作者为哥本哈根大学研究员Guillermo Montoya和Stefano Stella。
Montoya说,”我们利用X射线照射Cpf1蛋白晶体,能够在原子分辨率上观察到它的结构,从而能够让我们观察它的所有组分。X射线衍射是被用来解析生物分子结构的主要生物物理学技术之一。”
“Cpf1的主要优势在于它的高度特异性和DNA切割方式,这是因为利用这种新的分子剪刀能够产生交错末端,而不是Cas9产生的平端断裂。这些交错末端有利于DNA序列插入。”
15.Cell:张锋发表综述详细介绍第二类CRISPR-Cas系统
doi:10.1016/j.cell.2016.12.038
近期张锋教授也与另外两位学者在Cell杂志上发表了题为“SnapShot: Class 2 CRISPR-Cas Systems”的特写文章,介绍了新一代CRISPR基因组编辑系统:Class 2 CRISPR-Cas Systems。
2015年,张锋及其同事们就报告称发现了一种不同的CRISPR系统,具有潜力实现更简单、更精确的基因组工程操作。这个新系统是通过在不同类型的细菌中搜寻了成百上千种的CRISPR系统,寻找具有有用特性的酶,结果来自氨基酸球菌属(Acidaminococcus)和毛螺菌科(Lachnospiraceae)的Cpf1酶成为新的候选物。
这一新发现的Cpf1系统有几个重要的方面不同于以往描述的Cas9,在生物通最先报道的张锋Cell:新一代CRISPR基因组编辑系统这篇文章中就提到:Cpf1系统更简单一些,它只需要一条RNA。Cpf1酶也比标准SpCas9要小,使得它更易于传送至细胞和组织内;Cpf1以一种不同于Cas9的方式切割DNA。当Cas9复合物切割DNA时,它切割的是同一位点的两条链,留下的“平端”(blunt ends)在重新连接时往往会发生突变。采用Cpf1复合物生成的两条链切口是偏移的,在裸露端留下了短悬端(overhang)。这预计有助于精确插入,使得研究人员能够更有效及精确地整合一段DNA;Cpf1切口远离识别位点,这意味着即便在切割位点靶基因突变,仍然可以进行再度切割,提供了多次机会来校正编辑;Cpf1系统为选择靶位点提供了新的灵活性。像Cas9一样,Cpf1复合物必须首选附着PAM,短序列,选择的靶点靠近自然存在的PAM序列。Cpf1系统识别的PAM序列与Cas9截然不同。这在靶向某些基因组如疟原虫及人类基因组时可能是个优势。
文章指出,第二类CRISPR-Cas系统基于不同的效应蛋白家族,可以分为3种类型和9种亚型,其中譬如Cas9和Cas12a(Cpf1)已成功地用于基因组工程。在此前的研究中,张锋研究组也采用了一种新生物信息学方法来发现暂时被命名为C2c1、C2c2和C2c3的新蛋白,他们开发出一系列的计算方法来搜索NIH基因组数据库,鉴别新的CRISPR-Cas系统。
16.Nat Biotechnol:在体内利用电穿孔运送CRISPR/Cpf1实现靶向突变
doi:10.1038/nbt.3596
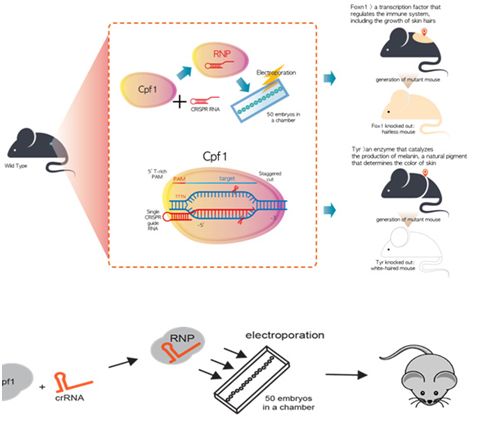
Figure 1a:CRISPR/Cpf1介导的突变小鼠培育,利用CRISPR/Cpf1破坏Foxn1基因或Tyrosinase基因的功能。这些突变分别导致无毛的小鼠和白毛的小鼠。Figure 1b:通过电穿孔将Cpf1 RNP运送到小鼠胚胎中的示意图。
作为CRISPR基因组编辑的新工具,Cpf1因其不同于Cas9的性质而引起人们的广泛关注。它只需要单个RNA,即crRNA(CRISPR RNA),因而组装更加简单;它的交错切割模式可能促进利用所需的序列替换现有的DNA序列;它识别富含胸腺嘧啶的DNA序列,而且相对于Cas9识别的富含鸟嘌呤的序列,人们很少探讨这种序列。总之,Cpf1有望扩大CRISPR基因组编辑靶位点的范围,同时具有更好的编辑效率。
在一项新的研究中,来自IBS基因组编辑中心的一个研究团队成功地将Cpf1核糖核蛋白(RNP,编者注:由crRNA和Cpf1进行组装而形成)介导的突变引入小鼠胚胎中,培育出突变小鼠。他们选择发生突变的靶基因为Foxn1(一种调节免疫系统的转录因子,可促进皮肤毛发生长)和Tyrosinase(编码酪氨酸酶,该酶催化黑色素产生,其中黑色素是天然色素,能够确定皮肤的颜色)。相关研究结果于2016年6月6日在线发表在Nature Biotechnology期刊上,论文标题为“Targeted mutagenesis in mice by electroporation of Cpf1 ribonucleoproteins”。
论文第一作者HUR K Junho说,“这些数据表明将Cpf1 RNP运送到小鼠胚胎中导致靶基因发生突变而破坏它们的功能,它们的突变率分别为64%和33%。我们将突变的小鼠胚胎移植到代孕母小鼠体内,获得携带特定突变的小鼠。这些突变分别导致无毛发的小鼠和白发小鼠产生。”
Hur补充道,“为了研究Cpf1是否有脱靶效应,我们对从一只Foxn1基因发生突变的小鼠和它的野生型近亲小鼠体内分离出的基因组DNA进行全基因组测序。序列分析表明没有脱靶突变发生。对其他突变小鼠的DNA进行靶向深度测序(targeted deep sequencing)也显示没有发生脱靶突变。”
在这项研究中,研究人员采用电脉冲将Cpf1 RNP同时渗透进多达50个小鼠胚胎中。这种新的电穿孔技术运送用于基因组编辑的Cpf1 RNP到小鼠胚胎中,产生突变小鼠。相比于常规的微注射技术,这种电穿孔方法很容易开展、快速和具有可扩展性。(生物谷 Bioon.com)
 基因君官网
基因君官网