


台湾“中研院”生物医学研究所2日发布最新研究成果,称发现癌细胞中过度表现的致癌基因paraspeckle Component 1(PSPC1)会促使癌细胞增生、侵袭、转移。未来若能抑制这一基因的表现,便能减低癌细胞生长、扩散,有助于研发新治癌药物。
据悉,相关研究论文已于日前发表在《自然细胞生物学》杂志上。
记者从“中研院”当日召开的记者会上了解到,癌症病患死亡主因之一是癌化肿瘤细胞的侵袭和转移,而此前研究已发现,转化生长因子-β1(TGF-β1)的信息传递在癌转移的机制上扮演重要角色。但由于该因子既能抑制正常细胞增生,也会促进癌细胞增生、侵袭和转移,科学界并不清楚其在癌症不同阶段发挥的作用。
为找出细胞癌化的关键因子,该机构的相关研究团队利用全基因体分析肺癌、乳癌、肝癌、前列腺癌等恶性肿瘤,寻找肿瘤组织中有基因套数变异、表现异常与病患存活率相关的基因。
研究发现,六至七成恶性肿瘤组织中都有PSPC1基因的过度表现并主导癌细胞内TGF-β1发挥癌转移作用。当细胞表现低量PSPC1时,TGF-β1抑制细胞增生,但当PSPC1过度表现时,则会制造出有利于癌细胞的生长环境,造成恶化和转移。此外,癌症病人的低存活率也与PSPC1过度表现相关。因此,若能抑制PSPC1表现,便可降低癌细胞生长、扩散的几率。
论文作者表示,该研究成果对肿瘤细胞癌化进程提出新观点,PSPC1可以作为新的用药标靶,有助新药研发。(生物谷Bioon.com)

据英国《独立报》官网近日报道,英国科学家发现了首个只出现于雄性体内的基因UTY。研究人员称,在人类和实验鼠身上进行的研究表明,UTY可帮助人类对抗包括白血病在内的多种癌症。这项研究将改变人们对Y染色体的理解,并可能带来新的急性骨髓性白血病(AML)疗法。
女性有两条X染色体,而男性有一条X染色体和一条Y染色体。X、Y染色体共享许多基因,但只有少数基因(包括UTY)仅在Y染色体上被发现。科学家一直认为,Y染色体只携带使胚胎发育为雄性而非雌性胎儿的遗传信息。
维康基金桑格研究院和剑桥大学的研究人员在最新一期《自然·遗传学》上撰文指出,UTY似乎提供了对抗AML的额外保护层。
他们研究了人类和小鼠身上的X染色体基因UTX,试图了解其在AML中发挥何种作用。结果发现,UTX的丧失会加速AML的恶化,因为健康的UTX基因在协调细胞蛋白质和基因表达中发挥关键作用。他们还发现,UTY会保护缺乏UTX的雄性老鼠对抗AML的恶化,因为它可以执行UTX在预防细胞疯长中所发挥的作用。而且,UTY的抑癌作用对其他几种人类癌症也有效。
论文主要作者、桑格研究所的玛尔歌泽塔·格兹达德卡博士说:“以前有人认为,Y染色体的唯一功能是制造男性性特征,但我们的研究表明,Y染色体也可以对抗AML和其他癌症。”
研究人员表示,目前AML患者的生存率仍然很低,新研究有助科学家更全面地了解有关AML发病和恶化的遗传基因,了解这一过程对于开发针对AML的靶向药物至关重要。(生物谷Bioon.com)

今日,致力于发现和开发视网膜神经退行性疾病和中枢神经系统疾病创新基因疗法的生物医药公司GenSight Biologics报告了其3期临床试验REVERSE的额外结果。该研究评估了单次玻璃体内注射GS010(rAAV2/2-ND4)在37名受试者中的安全性和有效性,这些人在研究开始前的6-12个月由于11778-ND4莱伯遗传性视神经病变(Leber Hereditary Optic Neuropathy,LHON)而引起视力丧失。
LHON是一种罕见的母系遗传的线粒体遗传病,表现为视网膜神经节细胞变性,导致不可逆的视力丧失,甚至失明。该疾病主要影响青少年和年轻人。LHON患者通常会突然出现中心视力丧失,然后另一只眼睛受损。它是一种对称性疾病,功能性视觉恢复差。97%的患者会在不到1年的时间里丧失双眼视力,25%的患者的双眼视力会同时丧失。据估计,LHON在美国和欧洲每年约造成1400至1500名新患者失明。他们急需有效的治疗来缓解疾病,提高生活质量。
由GenSight带来的GS010通过利用其线粒体靶向序列(MTS)专有技术平台,来治疗LHON。该平台来自于巴黎研究所Institut de la Vision的研究工作,它使用腺相关病毒(AAV)载体,来特异性解决线粒体内部的缺陷。相关基因会被转移到待表达的细胞中,产生功能性蛋白质,然后通过特定的核苷酸序列穿梭至线粒体,以恢复缺失或缺陷的线粒体功能。
该研究于4月份发表的顶线结果显示,其抵达了由光谱域光学相干层析成像(SD-OCT)参数定义的次要终点。具体为从基线到第48周时测量的神经节细胞层黄斑体积变化和视网膜神经纤维层颞象限厚度改变。这些结果表明,GS010对与LHON相关的解剖结构有直接的生物学和生理学影响。
现在进一步的分析表明,尽管一些次要终点没有显示出显着或有意义的变化,但与对照组(sham-treated eyes)相比,由Pelli-Robson低视力测试确定的对比敏感度在GS010治疗的眼睛中几乎增加了一倍。治疗组在开始时的平均对比敏感度低于对照组(0.25 LogCS vs. 0.35 LogCs)。但在第48周,治疗组的对比敏感度平均增加+0.20 LogCS,而对照组保持稳定(平均+0.08 LogCS)。
此外,事后分析(post hoc analyses)趋势表明,GS010可能对疾病程度相对较低的患者的视敏度(visual acuity)具有较大的积极影响:
入组时有较好视力的患者倾向于有更好的临床结果
视力丧失少于9个月的患者倾向于有更好的临床结果
入组时年龄较小(<21岁)的受试者倾向于有更好的临床结果
“REVERSE的结果整体表明,这种疗法可能为我们的受试者提供有意义的双侧视力改善,这是不能从该疾病的自然史中预期到的。我们计划对REVERSE的患者进行随访,监测他们在随后一年中的双侧持续改善情况,”GenSight首席医学官Barrett Katz博士表示:“与对照组相比,GS010治疗的眼睛更有可能实现20/200或更好的视力。另外,趋势表明LHON早期阶段的受试者可能获益更大。我们热切期待RESCUE试验的数据。”
“虽然大多数受试者观察到的具有临床意义的双眼视力改善仍有待进一步解释,但对于患者及其家属来说,这无疑是一个美妙的结果,”GenSight首席执行官Bernard Gilly博士评论道:“我们现在将与监管部门讨论全面的结果,以便能够在确定的时间表内使GS010的上市与现有的3期计划相一致。”(生物谷Bioon.com)
2018年6月25日/生物谷BIOON/—在一项新的研究中,来自比利时鲁汶大学(VIB-KU Leuven)Stein Aerts教授及其团队首次在果蝇衰老过程中绘制出每个脑细胞的基因表达图谱。由此产生的“细胞图谱”为大脑在衰老过程中的运作提供了前所未有的见解。这种细胞图谱被认为是开发有助于更好地理解人类疾病发展的技术而迈出重要的第一步。相关研究结果于2018年6月14日在线发表在Cell期刊上,论文标题为“A Single-Cell Transcriptome Atlas of the Aging Drosophila Brain”。
果蝇的大脑由大约10万个细胞组成,尽管它比人脑小得多,但它包含数百种不同类型的神经元和其他形成复杂网络的细胞,非常像人类大脑。

Aerts解释道,“为了真正理解大脑的运作,即使对像果蝇一样小的有机体,我们也需要放大观察每个细胞。所有的器官和组织都由许多不同的细胞组成,这些细胞彼此之间进行沟通来执行它们的特定功能。尽管它们具有相同的DNA,但它们都表达一组不同的基因,因此为了理解真正发生了什么,我们需要知道哪些细胞在做什么和什么时候做。”
通过利用果蝇作为模型生物,这些研究人员直面这一挑战,立即开始研究最复杂的器官—大脑。
作为Aerts团队的一名成员,Kristofer Davie说,这不是一件容易的事情:“果蝇大脑中有大约15000个基因和大约10万个细胞。因此快速计算显示我们研究10亿多个数据点,并随着时间的推移分析它们并绘制图谱。”
分析这些海量数据的唯一方法是获得人工智能的一点帮助。基于从来自不同年龄的果蝇的脑细胞收集的信息,这些研究人员使用机器学习方法来准确地预测细胞的年龄。
与人类大脑类似的是,果蝇大脑具有不同的负责睡眠、记忆、嗅觉等功能的细胞。这些研究人员对80多种不同的细胞类型簇(cell type cluster)进行了分门别类,并且有趣的是,他们也发现并非所有脑细胞都以相同的方式衰老。
绘制数千个细胞的基因表达谱是一项艰巨的工作,那么是什么促进这些研究人员完成他们的使命?Aerts解释道,“细胞不断地改变它们的作用:随着它们的衰老,它们对环境变化和疾病作出的反应也发生变化。最高目标就是实时评估患者组织和细胞的分子状态,从而允许对任何疾病进行早期诊断并进行有效的个性化治疗。但是要实现这一目标,我们需要开发模型和工具以便了解细胞发生的动态变化。”
因此绘制衰老的果蝇大脑图谱是一个重要的技术壮举。Aerts团队在世界上首次在这个细节层次上绘制出整个有机体大脑的图谱。
Aerts说,“我们已通过一个独特的在线分析平台免费提供我们所有的果蝇大脑数据,其他科学家也能够在这个平台上存储他们的数据。”他与使用单细胞技术研究果蝇不同器官的国际同事一道创立了果蝇细胞图谱联盟(Fly Cell Atlas consortium)。“对于生物医学研究来说,这是一个非常激动人心的时刻。通过在单细胞分辨率下研究基因表达,我们发现了很多我们几乎无法跟上的信息。”(生物谷 Bioon.com)
参考资料:
Kristofer Davie9, Jasper Janssens9, Duygu Koldere et al. A Single-Cell Transcriptome Atlas of the Aging Drosophila Brain. Cell, Published online: June 14, 2018, doi:10.1016/j.cell.2018.05.057

膀胱癌是美国第六常见的癌症,根据美国癌症学会(ACS)的统计,2017年美国约有79000人被诊断为膀胱癌,将近17000人死于这种疾病。在过去几年中,逐渐形成了根据基因表达模式对膀胱癌进行分类的趋势。已知一种称为p53样膀胱癌(p53-like bladder cancer)的基因表达模式与侵袭性的肌肉浸润性疾病相关,但人们尚不清楚该亚型对患者预后有何影响。现在,纽约西奈山卫生系统(Mount Sinai Health System in New York)的研究者通过算法模型,确定了两种生物标志物,它们有可能帮助肿瘤学家预测p53样膀胱癌患者的预后,并对其进行针对性治疗。相关论文发表在近期的《Oncogene》上。
据ACS统计,肌肉浸润性膀胱癌的5年生存率最高为63%。患者对常规治疗(如化疗)的反应可能差异很大,因此需要有新的疗法来治疗这种疾病。近年来,使用免疫检查点抑制剂的免疫疗法成为膀胱癌治疗的重大进展,但是一些患者变得耐药。去年,罗氏(Roche)发现一种名为TGF-β的蛋白质与患者对PD-L1抑制剂Tecentriq的反应相关,如果将Tecentriq与抗TGF-β化合物联用,可以提高其有效性。
这次来自西奈山团队的研究确定了两种基于microRNA活性的p53样膀胱癌生物标志物。p53样膀胱癌的命名来自与其相关的活性基因特征。它通常特别具有侵略性,并且对标准化疗耐药,但个体预后可能会有很大差异。microRNA则是一种调节基因表达的遗传物质。研究者利用他们之前开发的计算模型“ActMiR”开展研究,它能根据基因表达的变化确定microRNA的活性。研究者用ActMiR分析了癌症基因组图谱(Cancer Genomic Atlas)中的膀胱癌数据,从中发现了两种microRNA,它们在p53样膀胱癌中有抑癌的作用,其中一种与患者更好的存活率相关。在用ActMiR分析膀胱癌数据之前,西奈山团队已经用多种类型乳腺癌的数据作过验证。
虽然现在还处于早期阶段,西奈山的研究者相信这个研究结果暗示了靶向microRNA有潜力成为膀胱癌新疗法。其他研究者也在探索调控microRNA这个策略,比如伦敦帝国理工学院(Imperial College London)的研究者就在研究可以控制乳腺癌和肺癌的细胞迁移和生长的microRNA。
西奈山的研究者表示还需要做更多的研究,来确定这次发现的两种生物标志物对于p53样膀胱癌患者个体化治疗的意义。“我们的算法不仅让我们深入了解了这种难以捉摸的膀胱癌的潜在细胞机制,而且还揭示了microRNA作为治疗靶点的潜力,”西奈山遗传和基因组学教授朱军博士评论说。(生物谷Bioon.com)

2018年7月29日/生物谷BIOON/—DNA结合转录因子(TF)是真核基因表达的典型调节因子。针对转录因子的早期研究揭示出它们的结构良好的DNA结合结构域(DNA binding domain, DBD)并鉴定出转录所需的功能上至关重要的激活结构域(activation domain, AD)。后来很明显的是,许多激活结构域包含着固有无序化的低复杂度序列结构域(low-complexity sequence domain, LCD),但LCD如何激活转录仍然是不清楚的。尽管已知LCD的转录激活需要与结合伴侣(binding partner)选择性地相互作用,但直接测量体内的选择性LCD-LCD识别并揭示其作用机制一直充满着挑战。
传统的生物化学重建和遗传学研究已鉴定出很多在转录调控中起着至关重要的分子参与者。然而,弱的动态的蛋白-蛋白相互作用促进活细胞中的基因激活的机制一直是未知的。活细胞单分子成像取得的进展为研究体内转录开辟了新的前沿。
在一项新的研究中,Shasha Chong等人使用合成Lac操纵子(Lac operator, LacO)阵列和内源性GGAA微卫星位点来研究活细胞内的诸如EWS/FLI1、TAF15和Sp1之类的转录因子中的LCD-LCD相互作用。为了探测转录因子中的 LCD在靶基因组位点上的动态行为,这些研究人员将CRISPR-Cas9基因组编辑、诱导突变、基因激活、细胞转化分析和包括荧光相关光谱、光漂白后荧光恢复技术、晶格光片照明显微镜、三维DNA荧光原位杂交和活细胞单粒子追踪在内的各种高分辨率成像方法组合在一起。
活细胞单分子成像结果显示转录因子中的多个LCD之间存在的相互作用,从而在合成DNA阵列和内源性基因组位点上形成局部的高聚集中心(high-concentration hub)。转录因子LCD高聚集中心让DNA结合保持稳定、招募RNA聚合酶II(RNA Pol II)并激活转录。高聚集中心中的LCD-LCD相互作用是高度动态的(几秒到几分钟),对结合伴侣具有选择性,对己二醇破坏的敏感性具有较大的差别。这些发现表明在生理条件下,在转录因子和RNA Pol II复合物之间发生快速的可逆的和选择性的多价LCD-LCD相互作用,从而激活转录。这些研究人员观察到在广泛的核内转录因子浓度下形成功能性的转录因子LCD高聚集中心。虽然他们检测到明显的液-液相分离和过度的LCD表达,但在没有可检测到的相分离的情况下,在内源性染色体位点上,在转录因子的生理水平下,就可观察到具有转录能力的转录因子 LCD高聚集中心。此外,尤文氏肉瘤细胞中的诱导突变、基因表达和细胞转化测定揭示了LCD-LCD相互作用、反式激活能力和致癌潜力之间的功能关联性。
在活细胞中使用各种成像方法为体外研究提供了强有力的补充,并对LCD相互作用的性质及其在基因调控中的作用提供新的认识。这些研究人员提出反式激活结构域通过动态变化的多价的特异性的LCD-LCD相互作用形成局部的高聚集中心而发挥作用。转录因子之间发生的较弱的动态的瞬时接触似乎也可能在基因表达的致病性调节异常(即尤文氏肉瘤中的EWS/FLI1)中起作用,这提示着LCD-LCD相互作用可能代表一类新的可行性药物靶标。虽然他们研究了转录因子中的一小部分LCD,但是发现的关于导致LCD-LCD相互作用的动态变化和机制的原理可能适用于其他种类的蛋白和在许多细胞类型中发生的生物分子相互作用。
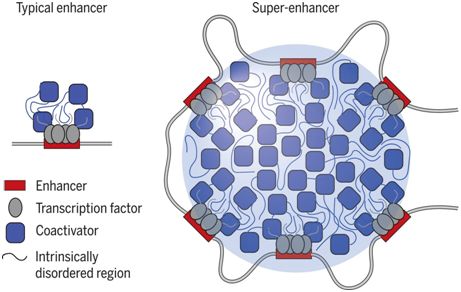
超级增强子(super-enhancer, SE)是一类协同性地组装高度密集的转录装置(transcriptional apparatus, 也译作转录复合物)从而促进在细胞身份中起着突出作用的基因稳健表达的增强子。在另一项新的研究中,Benjamin R. Sabari等人证实超级增强子富集的转录辅激活因子BRD4和MED1在表现出液体状凝集物性质而且会被干扰凝集物的化学物破坏的超级增强子上形成核斑点(nuclear puncta)。BRD4和MED1的固有无序区域(intrinsically disordered region, IDR)能够形成相分离的液滴,并且MED1-IDR液滴能够让转录装置区室化并且在核提取物中让转录装置聚集。这些结果支持这样的观点,即转录辅激活因子在超级增强子上形成相分离的凝集物,从而让转录装置区室化和聚集,这提示着转录辅激活因子IDR在这个过程中发挥作用,并提供对涉及控制关键的细胞身份基因的机制提供新的认识。
在第三项新的研究中,Won-Ki Cho等人利用活细胞超分辨率和光片显微镜,研究了转录中介辅激活因子(Mediator coactivator)和RNA聚合酶II的结构和动态变化。转录中介辅激活因子和RNA聚合酶II各自在活的胚胎干细胞中形成小的瞬时的聚集物和较大的稳定的聚集物,这些聚集物可与染色质结合,具有相分离的聚集物的性质,并且对转录抑制剂是敏感的。他们提出在大的或聚集的增强子元件上由转录因子招募的较大的转录中介辅激活因子聚合物在体内的转录凝集物中与较大的RNA聚合酶II聚集物相互作用。(生物谷 Bioon.com)
参考资料:
Shasha Chong1,2, Claire Dugast-Darzacq1,3, Zhe Liu et al. Imaging dynamic and selective low-complexity domain interactions that control gene transcription. Science, 27 Jul 2018, 361(6400):eaar2555, doi:10.1126/science.aar2555.
Benjamin R. Sabari1,*, Alessandra Dall’Agnese1,*, Ann Boija et al. Coactivator condensation at super-enhancers links phase separation and gene control. Science, 27 Jul 2018, 361(6400):eaar3958, doi:10.1126/science.aar3958.
Won-Ki Cho1,*, Jan-Hendrik Spille1,*, Micca Hecht et al. Mediator and RNA polymerase II clusters associate in transcription-dependent condensates. Science, 27 Jul 2018, 361(6400):412-415, doi:10.1126/science.aar4199.
Aaron J. Plys1,2, Robert E. Kingston. Dynamic condensates activate transcription. Science, 27 Jul 2018, 361(6400):329-330, doi:10.1126/science.aau4795.

Spark Therapeutics今日宣布,12名甲型血友病患者在接受基因疗法SPK-8011治疗后,缓解率达到97%。
甲型血友病是一种遗传性血液凝固疾病,可导致不受控制的出血。在美国,约有2万人被诊断为甲型血友病,全世界有32万甲型血友病患者。这些人缺乏或没有足够的凝血蛋白——因子VIII。出血通常发生在关节中,可引起明显的疼痛,并可导致慢性肿胀、畸形、活动能力下降和长期关节损伤。这些患者急需有效疗法来缓解病情,提高生活质量。
Spark研发的SPK-8011是一种使用Spark200衣壳且含有密码子优化的人源因子VIII基因的新型生物工程腺相关病毒(AAV)载体。它可以更有效地转导人肝细胞,并表达密码子优化的B结构域缺失的因子VIII基因,内源性产生因子VIII,用于治疗甲型血友病。
在一项1/2期临床试验中,12名患者接受了不同剂量的一次性SPK-8011治疗。其中,2例剂量为5×10^11载体基因组(vg)/体重(kg),3例剂量为1×10^12 vg/kg,7例剂量为2×10^12 vg/kg。在所有参与者中,在所有三种剂量下,从给药后4周开始,患者的年出血率(ABR)降低了97%,年输注率(AIR)降低了97%。前两名参与者的随访期已经超过一年,在因子VIII活性水平达到平稳期后持续了66周。在给药后12-30周进行的随访中,5名接受2×10^12vg/kg剂量的患者的因子VIII水平在16%至49%之间。基于给药12周后的平均因子VIII水平,这5名患者的平均因子VIII活性为30%。他们的总体ABR降低了100%,总体AIR降低了100%。另外,有证据表明三个剂量组中的平均因子VIII活性水平呈剂量依赖性增加。
“SPK-8011的临床数据和安全性非常令人鼓舞,没有观察到出现因子VIII抑制剂。转氨酶升高超过正常上限仅在3名参与者中观察到,没有转氨酶持续升高的证据。我们相信,根据观察到的免疫反应的节奏和程度,预防性类固醇疗法将抑制这些反应,并且使所有SPK-8011剂量为2×10^12 vg/kg的参与者的因子VIII长期表达超过12%。我们计划实施这种预防性的类固醇管理方法,“Spark总裁兼研发负责人Katherine High博士说:“这些早期数据进一步支持了因子活性水平超过12%对患者预后造成的巨大影响,使我们更接近消除自发性出血的目标,使甲型血友病患者不再需要定期输注。”
基于到目前为止的总体结果,Spark打算在今年第四季度启动3期试运行研究。在试运行研究完成后,3期参与者将接受2×10^12 vg/kg的SPK-8011。
我们期待这款基因疗法能为甲型血友病患者带来长久的疾病缓解。(生物谷Bioon.com)