

2018年8月30日讯 /生物谷BIOON /——昆士兰科技大学(Queensland University of Technology, QUT)澳大利亚转化基因组学中心(Australian Translational Genomics Centre,ATGC)的研究人员已经使用先进的DNA测序技术对100个血癌病人进行了基因突变检测,这些测试为医生提供了大量关于预后和大部分病人对治疗可能产生的反应的重要信息。

图片来源:https://pixabay.com/
这项研究于去年7月启动,QUT的研究人员与昆士兰病理学与麦德龙南方医院及卫生服务中心共同建立了ATGC,试图将研究进行临床转化,使癌症病人获益并实行个性化治疗。其首个遗传学诊断服务是为昆士兰的癌症病人提供全外显子测序,这是一种综合的下一代DNA测序技术。
QUT遗传学系主任和ATGC主任、资深教授Matt Brown表示在完成100名血癌病人的测序后,研究人员对结果进行了分析。这项研究由QUT副教授、ATGC首席生物统计学家Paul Leo领导,这项研究发现对于75%的病人而言,找到的基因突变将告诉医生病人将对治疗作出怎样的响应,从而允许个性化治疗以改善病人预后,避免不必要的无效操作。
此外,他表示被测试的血癌病人中有60%的病人体内找到的基因突变是现有标准遗传学检测无法检测到的。Brown教授表示这些结果表明采用下一代DNA测序对血癌病人进行遗传学测试将有助于他们的治疗,他还表示很高兴看到这些研究成果能够帮助病人。
“昆士兰已经有针对血癌病人的很好的临床服务,而我们的测试将给这些专业的临床医生一些指导,可以帮助他们决定被测试的3/4的人的最佳治疗方法。我们希望看到全州人民都可以接受并这项测试从中获益。”他说道。(生物谷Bioon.com)
参考资料:
Blood cancer patients benefit from breakthrough genetic testing service.

《科学》杂志发表了一篇哈佛和斯坦福大学科学家有关未经治疗转移肿瘤中驱动基因变异情况的分析(DOI: 10.1126/science. aat7171)。作者从20位实体瘤患者(包括乳腺癌、结肠癌、前列腺癌、胰腺癌等)提取了115个样品、包括76个未经治疗的转移肿瘤样品。结果发现肿瘤患者的转移肿瘤组织中驱动基因变异情况基本一致、同质性很高。那些在不同肿瘤样品变异不同的驱动基因根据特征也很可能并无增长优势。作者根据肿瘤转移和驱动基因变异动力学建立了一个数学模型解释这些观察。这些发现说明转移肿瘤变异测定并不一定需要多位置取样、一线治疗也可能相对简单,当然一线疗法失败、肿瘤进展后可能是完全不同的情况。
药源解析
肿瘤异质性是治疗的核心障碍之一,虽然精准疗法有些进展但也增加了肿瘤诊断和治疗的复杂性。细胞每次分裂都会产生一定变异,肿瘤细胞分裂更快所以变异更多,肿瘤基因组更不稳定也加快变异。同一病人的不同肿瘤位点、甚至同一肿瘤位点不同肿瘤细胞的变异情况都可能非常不同。今年早期的一个工作发现一位肿瘤患者的一个克隆有40%变异在该患者肿瘤的其它克隆没有发生,这令肿瘤的精准治疗非常困难。
但是多数这些变异发生在非驱动基因、多数发生在驱动基因的变异也没有增长优势。根据Cancer Genome Atlas现有299种公认肿瘤驱动基因,今天这项研究发现这些未经治疗转移肿瘤组织中平均有4.5个变异驱动基因。有些变异基因在所有样品中都存在(称作干线,trunk),有些变异基因只在部分样品中发现(称作支线,branch)。这个工作发现的干线变异基因有38%在肿瘤体细胞变异目录(COSMIC)中至少出现一次,而只有16%的支线变异在此目录中至少出现一次、与旁观者变异类似。干线变异占COSMIC目录中变异基因的0.32%,而支线变异只占0.0016%。这些都说明干线变异基因更经常出现在不同肿瘤中、更可能有增长优势。另外干线变异基因多是高影响(high impact)变异也说明更可能有功能性后果。
作者建立了一个数学模型解释这些发现,参数包括肿瘤细胞分裂/死亡速度、转移速率、转移后获得新的功能性突变几率。根据已有数据这个模型预测多数转移肿瘤都是原发肿瘤原班人马在新组织的复制,转移肿瘤都是mini me。即使新的驱动基因变异能够增加增长优势从肿瘤的角度看也不值得等待这些变异的出现,如同三个人可以开始斗地主就不会傻等第四个人凑麻将局了。当然也有特例如原发肿瘤的某个新变异克隆转移速度超快、或原发肿瘤增长速度超慢等。除了这个数学模型其它因素也可解释转移肿瘤的同质性,如新组织的TME对驱动基因变异并不友好、原发肿瘤随着资源紧张而增长减速、原发肿瘤变异基因已经覆盖主要肿瘤增长生物通路不需新变异帮忙等。
这个工作表明至少未经治疗的转移肿瘤武功没有想象中那么深不可测,虽然山头很多但大哥都是一个。这令精准治疗的准备相对简单、一次取样即可,理论上治疗也不需多种不同策略、因为贼头功夫都是一个师傅教的。但是应答并非肿瘤治疗的瓶颈,复发是更严重的问题。可以想象第一次围剿之后各个山头的土匪将异质性大增,令后续治疗复杂程度增加、病人康复可能下降。这些肿瘤也当然有一些共同练门,如20%左右的晚期实体瘤要生存就得给PD-1交保护费。发现这样靶点是现在制药业最重要的工作之一。(生物谷Bioon.com)
2018年9月19日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自犹他大学的科学家们通过研究发现,核小体会抑制CRISPR/Cas9的切割效率,文章中,研究人员描述了如何在酵母样本中检测相关的基因编辑技术以及他们的研究发现。
图片来源: Janet Iwasa (University of Utah, Salt Lake City)
“基因魔剪”CRISPR/Cas9能够利用导向RNA来寻找并且切割DNA片段,但当靶向片段是核小体的一部分会发生什么呢?此前研究人员通过研究发现,在这种情况下,似乎CRISPR/Cas9的切割效率会被降低;这项研究中,研究人员通过对这种情况进行体内试验发现,此前的研究结果是正确的,即利用CRISPR/Cas9切割核小体或许会降低其作用效率。
DNA链虽然很小,但如果其拉伸的话大概有六英尺长,正因为如此,细胞就拥有了如何将DNA包装到细胞核中的特殊机制,这一机制包括将DNA链缠绕在特定的蛋白质上,而诸如卷成的束状结构称之为核小体,逻辑表明,编辑DNA链的技术可能会因为可获取性的问题而遇到困难。其他研究人员也考虑到了这种问题的可能性,但他们在试管中研究过,或者在非核小体的已知链上做过相关的研究,这项研究中,研究人员就想通过研究来阐明CRISPR/Cas9在编辑核小体部分链上是否像编辑其它DNA链那么有效。
文章中,研究人员利用CRISPR/Cas9技术对活酵母中不同的导向RNAs进行编辑,这就能够实现对不同靶点的编辑。研究者表示,相比非核小体的区域而言,当对核小体区域进行编辑时,CRISPR/Cas9的编辑效率会发生降低;当研究人员对诸如锌指等基因编辑技术进行监测时,他们并未发现任何差异,后期研究人员或将进行更为深入的研究来改善CRISPR/Cas9对核小体区域进行基因编辑的效率。(生物谷Bioon.com)
原始出处:
Robert M. Yarrington, Surbhi Verma, Shaina Schwartz, et al. Nucleosomes inhibit target cleavage by CRISPR-Cas9 in vivo, Proceedings of the National Academy of Sciences (2018). DOI:10.1073/pnas.1810062115
2018年10月3日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Nucleic Acids Research上的研究报告中,来自东芬兰大学的研究人员通过研究发现,抗生素环丙沙星或对细胞中线粒体基因组有着显著的影响。抗生素通过抵御机体细菌或真菌的感染挽救了很多人的生命,但如今科学家们发现了抗生素或许也存在一些副作用,与大多数药物一样,许多抗生素也会对机体的新陈代谢产生不良影响,甚至会让患者或多或少出现一些严重症状。

图片来源:UEF/RAIJA TÖRRÖNEN
环丙沙星是一种氟喹诺酮类抗生素,氟喹诺酮类抗生素通常是广谱类抗生素,其常用于呼吸道、尿道和耳部感染,虽然这类药物的耐受性较好,但一些服用氟喹诺酮类抗生素的患者仍然会出现严重的健康问题,比如肌腱断裂、永久性的神经损伤或抑郁症等,其背后的原因目前研究人员并不清楚。
这项研究中,研究人员调查了抗生素环丙沙星对细胞中线粒体的影响效应,线粒体是一种重要的细胞器,其主要负责产生机体所需的能量;线粒体拥有小型环状基因组,而该基因组的功能需要拓扑异构酶来维持,拓扑异构酶能够调节DNA的拓扑结构,比如其能通过切割和重新连接DNA序列从而解开基因组结点和过度缠绕。而环丙沙星能够抑制拓扑异构酶的促旋酶,从而诱发细胞死亡,同时其也会抑制宿主自身细胞的2型拓扑异构酶的功能。
研究者Steffi Goffart说道,我们注意到,2型拓扑异构酶对于线粒体基因组的复制尤为重要,因为其能够通过移除一些正向的扭曲来调节线粒体小型DNA分子的缠绕过程。而环丙沙星能够通过改变线粒体DNA的拓扑结构来阻断线粒体基因组的维持和转录功能,从而损伤线粒体的能量产生,阻断细胞生长和分化;对线粒体DNA所造成的剧烈影响似乎就会造成患者所经历的严重副作用,因此研究人员提醒患者在使用诸如环丙沙星等氟喹诺酮类抗生素进行治疗时一定需要谨慎。(生物谷Bioon.com)
原始出处:
Hangas A, Aasumets K, Kekäläinen NJ,et al. Ciprofloxacin impairs mitochondrial DNA replication initiation through inhibition of Topoisomerase 2. Nucleic Acids Res. 2018 Aug 31. doi: 10.1093/nar/gky793
从1957年世界上第一例骨髓移植技术成功救治一位重症联合免疫缺陷患者到现在,干细胞技术的发展已经长达半个世纪之久,在这几十年的研究中,科学家们一次次地见证了奇迹的诞生,干细胞治疗也逐步由实验室研究走向临床试验,大家期待的“干细胞治疗新时代”即将到来。据不完全统计,如今干细胞已经能够治疗以及正处于临床试验阶段的疾病达到140种。全世界已经保存了200多万份干细胞,并进行了数万例干细胞移植术,国际上已有10几个干细胞产品上市。随着近年年来科学家们研究的不断深入,他们开始使用干细胞疗法治疗多种人类疾病,比如癌症、糖尿病、神经变性疾病、脊髓损伤以及多发性硬化症等。如今越来越多的临床案例表明,干细胞技术对人类医疗发展有着划时代的意义,世界各国纷纷将干细胞列为在人类健康领域提高国际竞争力的战略性新兴产业。
图片来源:singularityhub.com
在干细胞疗法飞速发展时,又有一种新型技术因能表现出强大的治疗潜力而进入大家的视野,那就是基因编辑技术,基因编辑技术是一种能对目标基因进行“编辑”,实现对特定DNA片段的敲除、掺入的一种技术;未来科学家们对人体基因进行有效编辑有望治疗一系列人类疾病。此前科学家们仅能通过物理、化学诱变和同源重组等方式对目标DNA进行编辑,然而这些方法靶向位点较为随机,且耗时耗力。在过去几年里研究人员开发出了锌指核酸酶(Zinc-finger nucleases, ZFN)和转录激活因子样效应因子核酸酶(transcription activator-like effector nucleases, TALEN)两种技术,这两种特殊的序列特异性核酸酶技术能够实现高效定点的基因组编辑功能, 其在基因治疗等领域展示出了巨大的潜力,曾经一度成为科学家们所使用的主流基因编辑技术,然而随着ZFN和TALEN技术的广泛应用,其所带来的问题不断出现,主要表现为操作繁琐、周期较长、脱靶率较高等缺陷,这无疑严重制约着基因编辑技术在人类疾病治疗领域的发展。
2013年,随着CRISPR/Cas9基因编辑技术的问世,立刻掀起了全球科学家的研究高潮,该技术被认为是继ZFN和TALEN之后的第三代基因编辑技术。CRISPR/Cas9系统包括两个元件,分别是Cas9内切酶和guide RNA(gRNA),gRNA引导Cas9蛋白在靶位点进行切割,形成 DNA双链断裂(DSB),该技术能够帮助研究人员快速而精确地对核苷酸序列进行编辑,不仅操作较为简单方便,而且成本也较低。未来CRISPR/Cas9技术的另一个诱人的应用就是通过对机体体细胞基因组进行编辑,来治疗多种人类遗传性疾病,而通过纠正诱发疾病的突变就有可能逆转患者疾病的症状。近年来,科学家们利用CRISPR/Cas9基因编辑技术在治疗多种疾病上取得了重要的研究进展,2018年2月,刊登在国际杂志Science Advances上的一篇研究报告中,科学家们通过研究利用CRISPR/Cas9技术对杜氏肌营养不良(DMD)症患者机体的多能干细胞进行改造产生了健康的心肌,有望治疗杜氏肌营养不良症患者[1];同一个月,刊登在Cell杂志上的两篇研究报告中,来自怀特黑德生物医学研究所的研究人员利用一种基于CRISPR/Cas9的技术成功治疗了脆性X染色体综合征[2];2018年4月,一项刊登在国际杂志Nature Genetics上的研究报告中,来自斯坦福大学的科学家们将CRISPR基因编辑技术同DNA条形码技术结合有效地对癌症的进展进行了追踪,这种组合性的方法对于未来研究人员进行癌症药物检测非常重要[3]。
随着研究的深入,科学家们开始对干细胞进行基因编辑,而该技术也是近年来出现的一项新兴技术,其在治疗多种人类疾病上有着巨大的潜力,但同时其安全性也引起了很多人的担忧,比如就有人会担心基因编辑会降低干细胞的稳定性,促进其发生突变,随着科学家们多项研究成果的刊登,渐渐地打消了人们的顾虑。那么近些年来,科学家们在干细胞基因编辑领域到底取得了哪些重要成果呢?此前,来自英国桑格研究所和剑桥大学的研究人员首次结合基因编辑技术对患者机体自身诱导干细胞(induced stem cell)的基因突变进行编辑,修正了一种代谢性肝病患者细胞中的基因突变,这一研究进展开或能帮助重新调整患者自身的细胞,从而成功治疗遗传病[4]。过去10年里诞生了两种非常有用的生物学工具,第一个就是人类诱导多能干细胞(iPSCs),而第二项工具就是CRISPR-Cas9系统,将两种工具相结合,即利用CRISPR编辑人类诱导多能干细胞就能帮助科学家们研究特殊疾病背景下的基因功能,或者能够有效纠正病人细胞中的遗传缺陷。尽管CRISPR-Cas9和人类iPSCs已经成为研究者在实验室中老生常谈的话题了,但对两者进行统一却并不容易,想要研究基因功能的科学家如今正在发现,在培养基中很难维持人类ipsCs,而且也很难利用CRISPR进行操作。
图片来源:commons.wikimedia.org
当利用CRISPR-Cas9切割基因时,两个主要的分子途径就会开启来进行DNA修复,而且最终会确定随后编辑作用的保真性,这两个修复通路同时会发生,用作基因敲除的非同源性末端接合(NHEJ)能够在DNA中产生小型的插入位点或剔除位点来阻断基因的功能;另外一种名为同源性直接修复(HDR)的作用则会基于供体的长链DNA来产生精确的核苷酸改变。目前研究者Hockemeyer及其同事正在开发新型策略来使得同源性直接修复发挥主要作用,比如应用特殊的化学物或利用来自不同物种的Cas9酶等。而研究者Conklin等人开发出了一种快速的数字PCR技术,其能够对HDR和NHEJ的修复率进行定量,在包括人类ipsCs的多个细胞类型中,上述两种修复率并没有互相关联,这就表明,相比单单测定一种修复率而言,同时测定两种修复率是非常明智的,尤其是当目标是HDR的时候[5]。
2017年1月,一项刊登在Science Translational Medicine杂志上的研究报告中,来自美国国家过敏症和传染病研究所等机构的研究人员研究人员利用基因编辑工具成功修复了源自X连锁慢性肉芽肿病患者体内造血干细胞中的一种缺陷基因。当移植到小鼠体内后,这些经过修复的造血干细胞产生功能正常的白细胞,这就提示着这一策略可能潜在能被用来治疗X连锁慢性肉芽肿病患者[6]。随后2017年4月27日发表在Stem Cell Reports杂志上的一篇研究报告中,来自华盛顿大学的研究人员实现了成功利用CRISPR编辑干细胞来抵抗关节炎的目标;文章中研究人员利用新型基因编辑技术改造小鼠的干细胞,使其能够抵抗关节炎等慢性疾病导致的炎症。这些经过改造的干细胞(SMART细胞,干细胞经修饰用于自主再生疗法)能产生制造一种抗炎性生物制剂药物的软骨细胞,在理想情况下这些软骨细胞能够替换关节炎性软骨,保护关节和其它组织免受慢性炎症中诱发的损伤[7]。
如今研究人员利用基因编辑技术在生殖干细胞领域也取得了重要的研究成果,来自中科院上海生命科学研究院的李劲松博士长期从事于体细胞重编程与胚胎发育相关领域的研究,2012年,他们建立了只携带精子来源遗传物质的小鼠孤雄单倍体胚胎干细胞,并证明这一细胞能代替精子在注入卵母细胞后能支持胚胎发育产生健康的半克隆小鼠(半克隆技术)。然而单倍体细胞的“受精”能力随着细胞的传代逐渐丢失,特别是经过基因编辑后,这些细胞再注入卵子中很难获得健康半克隆小鼠。最近,李劲松团队通过将调控雄性印记基因H19和Gtl2表达的H19-DMR和IG-DMR敲除后获得了能稳定产生半克隆小鼠的“人造精子”,这一研究突破将不断推动科学家们在生殖医学领域的研究进展。
图片来源:anderst03norma.wikidot.com
2017年3月,刊登在国际杂志Oncotarget上的一篇研究报告中,来自中国中南大学的科学家们发表了他们在基因编辑干细胞抑制肿瘤生长研究领域的新进展,文章中,研究人员尝试建立高效稳定表达抗癌因子的病人特异性的人诱导多能干细胞,从而诱导分化为间充质干细胞,用于肿瘤的自体化基因治疗,这项研究成果首次证明通过非病毒基因打靶病人特异性人诱导多能干细胞获得自体间充质干细胞用于癌症治疗的可行性,展示了基因编辑人诱导多能干细胞在肿瘤自体化基因治疗领域的临床应用前景[8]。同年7月刊登在国际杂志Cell Research上的一篇研究报告中,来自中科院生物物理所刘光慧等研究人员成功实现了通过单碱基基因编辑重塑超级干细胞的目的,文章中,研究人员利用基因编辑改写了人类基因组遗传密码中的单个碱基,首次在实验室中获得了遗传增强的“超级”干细胞(Genetically Enhanced Stem cells,GES细胞)。这种GES细胞能够对细胞衰老和致瘤性转化产生双重抵抗作用,因此为开展安全有效的干细胞治疗提供了可能的解决途径。这一发现对间充质干细胞的临床转化治疗具有重要的价值,同时也很好地证实了利用基因编辑技术可以促进干细胞在再生医学中的应用,为干细胞研究提供了值得借鉴的新方法[9]。
2018年3月,来自日本京都大学等处的研究人员通过研究开发了一种新型的基因编辑方法,其能够以较高的准确度修饰人类基因组中单个DNA碱基,这种新方法的特殊之处在于其能够指导细胞自身的修复机制,从而就能为研究疾病相关的突变提供一对基因匹配的细胞。目前研究人员正在利用胚胎干细胞进行人类糖尿病临床试验,但需要对患者进行慢性的免疫抑制,对患者自身的ips细胞进行基因修正或许能够帮助产生健康的胰腺细胞,同时还能降低患者移植后出现的排斥反应和概率。最后研究者Woltjen表示,我们的目标就是能开发出改善对疾病发病机制理解的新型基因编辑技术,最终开发出根治疾病的新型疗法,我们相信,MhAX技术在目前多种人类疾病研究中将具有更为广泛的适用性[10]。4月份,来自浙江大学的研究人员通过研究建立了对人多能干细胞进行更高效和精准的基因编辑技术体系—CRISPR-Cpf1技术,研究人员表示,CRISPR-Cpf1基因编辑系统能与小分子药物进行组合,实现对人多能干细胞进行更加简单、高效和精准的基因编辑,从而更好地应用于基础生物学研究、疾病模型构建、药物筛选和临床转化[11]。同一个月,发表在PLOS Pathogens杂志上的一篇研究报告中,来自国外的研究人员通过研究表示,利用基因编辑的干细胞或许有望消除HIV,文章中,研究者表示,使用基因编辑的骨髓干细胞可以显著降低感染猴/人免疫缺陷病毒(SHIV)的猪尾猕猴休眠的“病毒水库”的大小[12]。
2018年5月刊登在Nature Cell Biology杂志上的一篇研究报告中,科学家们利用基因编辑技术以及人源胚胎干细胞技术绘制出了人类基因组的蓝图,揭示了基因对人体健康以及疾病发生的作用。研究人员通过生成180000种不同的突变,对人类基因组中的所有基因功能进行了分析。其中,他们构建出了一种仅存在一对染色体的新型胚胎干细胞,并使用了CRISPR-CAS9技术进行大规模突变体的筛选[13]。此前一项发表在Cell Stem Cell杂志上的研究报告中,来自美国斯坦福大学等机构的科学家们成功利用CRISPR修饰表观基因组产生了诱导性多能干细胞,文章中,研究者发现,一种能够激活而不是切割DNA的CRISPR形式能够将胚胎小鼠细胞转化为诱导性多能干细胞[14]。2018年6月,刊登在国际著名杂志Cell上的一篇研究报告中,来自美国的科学家们利用CRISPR/Cas9技术成功改造造血干细胞,促进CAR-T细胞疗法有效治疗急性髓性白血病,文章中,研究者开发出了一种新方法,能利用CAR-T细胞来治疗急性髓性白血病(AML),为了能治疗这种白血病,目前研究人员会靶向作用健康细胞中表达的一种名为CD33的特殊蛋白,这种疗法并不能在不造成患者其它正常骨髓损伤的情况下来成功攻击癌症,而本文研究中研究者所开发的新方法则利用基因编辑工具CRISPR/Cas9来移除健康造血干细胞中的CD33分子,从而攻击携带该分子的癌变细胞[15]。
近年来,科学家们在干细胞基因编辑领域取得了大量的研究进展,相信未来通过科学家们更为深入的研究必将能开发出更多有效治疗多种人类疾病的新型干细胞基因编辑手段;近年来,在国家政策的大力支持下,我国干细胞产业发展迅猛,如今已经形成了全产业链模式,预计到2021年,我国干细胞相关市场规模将接近1500亿元。然而与国外相比,我国干细胞发展的步伐还需加快,除了聚焦干细胞及转化研究的重大基础科学问题和瓶颈性关键技术,我们还要争取在优势重点领域取得科学理论和核心技术的原创性突破,推动干细胞研究成果向临床应用的转化,整体提升我国干细胞及转化医学领域技术水平。为此,生物谷将于2018年11月9日至2018年11月10日在北京举办第十届干细胞国际研讨会,本届干细胞国际研讨会在秉承此前干细胞临床与转化的会议经验基础上,我们围绕干细胞重编程与再生医学、干细胞临床研究即干细胞商业化等多个领域,邀请国内外知名专家学者、业界翘楚、临床医生一道进行深入讨论,促进合作交流。同时本次研讨会特别设立“青年千人”论坛,为海内外优秀青年学者搭建学术交流平台。
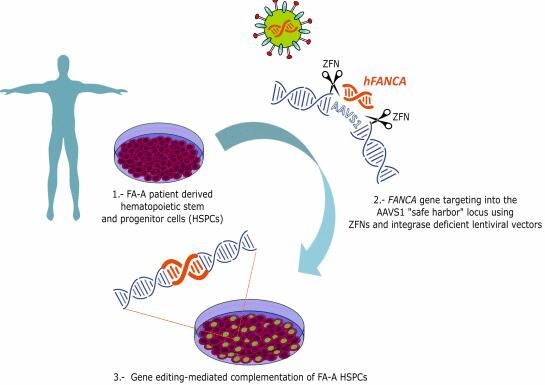
图片来源:embomolmed.embopress.org
本次干细胞国际研讨会已邀请中科院广州生物与健康研究院裴端卿教授、仁济医院的管阳太主任、浙江大学遗传学研究所徐鹏飞研究员、乔治城大学刘学锋教授等知名干细胞领域研究者,届时我们将会在干细胞基因编辑、多能性、干细胞与多种疾病关联等领域进行深入交流探讨,裴端卿教授主要研究主要研究领域为干细胞的多能性维持与体细胞重编程,细胞内蛋白与膜运送机制,其代表性学术成果发表在Nature,PNAS, JBC 等国际期刊上,共计50多篇研究论文,引用达2000余次。2017年,裴端卿教授和舒晓东教授通过联合研究,报道了关于调控人胚胎干细胞向肝系细胞分化的机理,相关研究成果为多能干细胞分化提供细胞生物学的机理,为解决干细胞在再生医学运用中打开一扇新门窗;与此同时,在统一体细胞重编程与干细胞分化这两个看似相反过程的机理研究中迈出一大步,促进细胞命运调控理论体系的建立[16]。2017年10月,裴端卿教授以及来自加州理工学院等处的多位学者在Cell Stem Cell杂志上刊登了一篇题为“Human Embryo Editing: Opportunities and Importance of Transnational Cooperation”的研究报告,论述了科学界通过组织人类基因编辑委员会和国际学术峰会为人类基因编辑,尤其是可遗传的胚胎基因编辑提供详细的指导意见的努力,并着重描述了人类胚胎基因编辑对于胚胎发育等基础研究的重要推动作用,以及国际学术合作对人类胚胎基因编辑的潜在临床应用的重要意义[17]。2018年4月,裴端卿教授在Cell Stem Cell发表最新研究研究成果,文章中研究者表示,他们开发了简单、高效、标准化制备干细胞的方法,即一种名为化合物诱导干细胞多能性的技术(CIP,Chemical Induction of Pluripotency),该技术能为诱导多能干细胞的研究和优化制备途径提供了全新的科学视角和解决方案[18]。
其他已邀请的嘉宾也在干细胞研究领域取得了多项成果和项目,比如2018年5月,由仁济医院神经内科科主任管阳太牵头的干细胞多中心临床研究项目《脐带源间充质干细胞治疗视神经脊髓炎谱系疾病的前瞻性多中心随机对照研究》按照《干细胞临床研究管理办法(试行)》的规定完成了国家卫健委备案。仁济医院神经内科牵头开展的临床研究是首个将人脐带源间充质干细胞(hUC-MSC )治疗视神经脊髓炎谱系疾病(NMOSD)的大型多中心临床试验,探讨人脐带源间充质干细胞治疗NMOSD的安全性和有效性,为该新疗法在临床治疗应用提供循证医学证据。
2018年11月9-10日,我们将相聚北京召开第十届干细胞国际研讨会,会议上我们将围绕干细胞重编程、干细胞临床研究、干细胞规模化制备,监管等多个领域,与国内外知名专家学者、业界翘楚、临床医生一同深入讨论,促进合作交流,快来参会吧!
参考资料:
【1】Chengzu Long, Hui Li, Malte Tiburcy, et al. Correction of diverse muscular dystrophy mutations in human engineered heart muscle by single-site genome editing. Science Advances 31 Jan 2018: Vol. 4, no. 1, eaap9004 DOI: 10.1126/sciadv.aap9004
【2】X. Shawn Liu, Hao Wu, Marine Krzisch et al. Rescue of Fragile X Syndrome Neurons by DNA Methylation Editing of the FMR1 Gene. Cell, Published online: February 15, 2018, doi:10.1016/j.cell.2018.01.012
X. Shawn Liu, Hao Wu, Xiong Ji et al. Editing DNA Methylation in the Mammalian Genome. Cell, 22 September 2016, 167(1):233-247, doi:10.1016/j.cell.2016.08.056
【3】Zoe N. Rogers, Christopher D. McFarland, Ian P. Winters, et al. Mapping the in vivo fitness landscape of lung adenocarcinoma tumor suppression in mice. Nature Genetics (2018) doi:10.1038/s41588-018-0083-2
【4】Yusa K, Rashid ST, Strick-Marchand H, et al. Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells. Nature. 2011 Oct 12;478(7369):391-4. doi: 10.1038/nature10424
【5】Yuichiro Miyaoka,Jennifer R. Berman,Samantha B. Cooper, et al. Systematic quantification of HDR and NHEJ reveals effects of locus, nuclease, and cell type on genome-editing. Sci Rep. 2016; 6: 23549.doi:10.1038/srep23549.
【6】Suk See De Ravin, Linhong Li, Xiaolin Wu, et al. CRISPR-Cas9 gene repair of hematopoietic stem cells from patients with X-linked chronic granulomatous disease. Science Translational Medicine 11 Jan 2017:Vol. 9, Issue 372, eaah3480 DOI: 10.1126/scitranslmed.aah3480
【7】Jonathan M. Brunger, Ananya Zutshi, Vincent P. Willard et al. Genome Engineering of Stem Cells for Autonomously Regulated, Closed-Loop Delivery of Biologic Drugs. Stem Cell Reports, Published Online: 27 April 2017, doi:10.1016/j.stemcr.2017.03.022
【8】Bo Liu,Fei Chen,Yong Wu, et al.Enhanced tumor growth inhibition by mesenchymal stem cells derived from iPSCs with targeted integration of interleukin24 into rDNA loci. Oncotarget. 2017; 8:40791-40803. doi: 10.18632/oncotarget.16584.
【9】Jiping Yang, Jingyi Li, Keiichiro Suzuki, et al. Genetic enhancement in cultured human adult stem cells conferred by a single nucleotide recoding. Cell Research volume 27, pages 1178–1181 (2017) doi:10.1038/cr.2017.86.
【10】Shin-Il Kim, Tomoko Matsumoto, Harunobu Kagawa, et al. Microhomology-assisted scarless genome editing in human ipsCs. Nature Communications (2018) doi:10.1038/s41467-018-03044-y
【11】Ma X, Chen X, Jin Y,et al. Small molecules promote CRISPR-Cpf1-mediated genome editing in human pluripotent stem cells. Nat Commun. 2018 Apr 3;9(1):1303. doi: 10.1038/s41467-018-03760-5.
【12】Peterson CW, Wang J, Deleage C, Reddy S, Kaur J, Polacino P, et al. (2018) Differential impact of transplantation on peripheral and tissue-associated viral reservoirs: Implications for HIV gene therapy. PLoS Pathog 14(4): e1006956. doi.org/10.1371/journal.ppat.1006956
【13】Atilgan Yilmaz, Mordecai Peretz, Aviram Aharony, Ido Sagi, Nissim Benvenisty. Defining essential genes for human pluripotent stem cells by CRISPR–Cas9 screening in haploid cells. Nature Cell Biology, 2018; DOI: 10.1038/s41556-018-0088-1
【14】Peng Liu, Meng Chen, Yanxia Liu et al. CRISPR-Based Chromatin Remodeling of the Endogenous Oct4 or Sox2 Locus Enables Reprogramming to Pluripotency. Cell Stem Cell, Available online 18 January 2018, doi:10.1016/j.stem.2017.12.001
【15】Miriam Y. Kim, Kyung-Rok Yu, Saad S. Kenderian, et al. Genetic Inactivation of CD33 in Hematopoietic Stem Cells to Enable CAR T Cell Immunotherapy for Acute Myeloid Leukemia. Cell (2018) doi:10.1016/j.cell.2018.05.013
【16】Qiuhong Li, Andrew P. Hutchins, et al. A sequential EMT-MET mechanism drives the differentiation of human embryonic stem cells towards hepatocytes. Nature Communications volume 8, Article number: 15166 (2017) doi:10.1038/ncomms15166.
【17】Duanqing Pei,David W. Beier,Ephrat Levy-Lahad, et al. Human Embryo Editing: Opportunities and Importance of Transnational Cooperation. Cell Stem Cell, OCTOBER 05, 2017, doi:10.1016/j.stem.2017.09.010.
【18】Shangtao Cao,Shengyong Yu,Dongwei Li,et al. Chromatin Accessibility Dynamics during Chemical Induction of Pluripotency. Cell Stem Cell,APRIL 05, 2018. doi:10.1016/j.stem.2018.03.005
2018年10月24日 讯 /生物谷BIOON/ –近日,一项刊登在国际杂志Cell上的研究报告中,来自西奈山医院的科学家们通过研究开发了一种能同时分析成百上千个基因功能的新型技术,该技术的分辨率能达到单细胞水平,其依赖于一种使用新型蛋白质的条形码技术。
图片来源:CC0 Public Domain
自从21世纪初期首次对人类基因组进行测序后,科学家们揭示了一组超过2万个蛋白质的编码基因,然而研究人员并不能确定单个基因的功能,如果相关的研究数据,我们在理解人类基因组工作机制上将会受到很大限制,这无疑也会影响科学家们预测、预防、治疗甚至治疗多种人类疾病的进程。2012年和2013年,研究人员建立了一种编辑基因的新方法,那就是CRISPR,研究者能利用这种基因编辑技术来阐明基因的功能,如今CRISPR技术已经席卷了整个科学界,但研究者在使用该技术来研究成千上万个基因的功能上仍然面临着诸多挑战。
这项研究中,研究人员就开发了一种新技术,其能以一种前所未有的规模来分析基因组,这或许就能够解决当前科学家们所面临的基因组学研究上的挑战。这种新工具能够利用名为表位的合成蛋白来贴上条形码并且追踪不同的CRISPRs,这种蛋白质条形码被称为优先代码(pro-code),其能够使得数百个CRISPRs一起来敲除大量基因。
当前有很多技术能够聚合CRISPRs,这些方法在很大程度上依赖于DNA作为条形码,并且只允许对基因功能进行较低分辨率的研究;而通过这种优先代码技术,研究人员就能够提供一种新方法来帮助科学家们深入理解基因的功能和生物学效应。文章中,研究人员利用优先代码技术搜寻了免疫系统保护机体抵御癌症所需要的基因,随后他们利用CRISPRs来靶向剔除推测的免疫调节基因,并将其与优先代码配对,随后将这种优先代码/CRISPRs (Pro-Code/CRISPR)文库引入到乳腺癌细胞中,这些肿瘤就会受到识别癌细胞的杀伤性T细胞的攻击和挑战,很多癌细胞就会被T细胞快速消灭,但有些癌细胞却会产生一定的耐受性。
研究者表示,这种优先代码技术能够帮助确定哪些基因会在耐药细胞中丢失,以及这些基因在敏感癌细胞中所扮演的未知角色;此外,本文研究中,研究人员还鉴别出了免疫检查点PD-L1的一种负向调节子,PD-L1是临床上癌症免疫疗法的主要作用靶点。
最后研究者Brian Brown说道,目前在理解人类基因组上我们还有大量工作要做,我们并不清楚大部分基因的工作机制以及其之间的具体关联;这种“优先代码”技术或许能够加速后基因组时代的研究,即对人类基因组进行注释,相关研究结果也能够帮助发现致病基因,从而促进研究人员开发新型靶向性疗法。(生物谷Bioon.com)
原始出处:
Aleksandra Wroblewska,Maxime Dhainaut,Benjamin Ben-Zvi,et al. Protein Barcodes Enable High-Dimensional Single-Cell CRISPR Screens. Protein Barcodes Enable High-Dimensional Single-Cell CRISPR Screens, Cell (2018). DOI: 10.1016/j.cell.2018.09.022

10万年前的一天,尼安德特人第一次遇见一群与他们看上去并不相同的“伙伴”——现代人。虽然双方的初次见面发生了什么也许已无从考证,但之后的数万年间,他们相处得似乎不错。
因为一项针对当今东亚人和欧洲人携带的尼安德特人DNA片段的研究显示,尼安德特人与解剖学意义上的现代人的祖先曾在多个时间点发生过基因交流。
“解剖学意义上的现代人在走出非洲后的3万多年里,与尼安德特人曾在地理位置上相互重叠。在这一时期,尼安德特人与现代人进行了杂交,今天非非洲人携带的尼安德特人部分基因组证明了这一点。”该研究通讯作者、美国宾夕法尼亚州天普大学生物学系的Joshua G. Schraiber告诉《中国科学报》记者,“但这种融合并非只发生了一次,实际上,人类与尼安德特人之间的相互作用比以前所认为的更长期、更复杂。”
有一个“幽灵”
尼安德特人是远古分布在欧洲大陆的最主要古人类,也是与现代人在进化学上最近的亲族。早在25万年前,尼安德特人就已出现在欧洲和亚洲,而且,他们独占了欧亚大陆,直到现代人的到来,并最终将他们取代。
德国莱比锡马普学会进化人类学研究所Sergi Castellano团队曾发现,西伯利亚阿尔泰山脉东部尼安德特人的祖先和现代人的祖先相遇及繁衍的时间可能发生于约10万年前。但约3万年前,尼安德特人完全消失。
考古学家认为,现代人从非洲向外扩散时,在欧亚大陆西部遇到尼安德特人,并假定现代人与尼安德特人只发生过一次基因交流。这些遭遇事件在当今非非洲人族群的基因组中留下了印记:该族群约2%的基因组中有尼安德特人成分。
但是,让Schraiber感到困惑的是,东亚人携带的尼安德特人基因比例比欧洲人高出12%~20%。
“为了找出答案,我们探索了能解释这一结果的各种人口模型,包括单一混合、多次混合,以及存在一个‘幽灵’人群(‘稀释’假说)。”他说。
Schraiber提到,可能有一些人居住在东非或北非,因此没有遇到尼安德特人。当他们后来在非洲扩散并为现代欧洲基因库作出贡献时,这些人可能稀释了现代欧洲人基因中的尼安德特人成分。“我们没有这个群体的任何直接样本,这就是为什么他们是一个‘幽灵’。”他告诉记者。
但“幽灵”可能并不存在。“我们的证据表明他们(尼安德特人与现代人)只是多次相遇。”Schraiber说。
多次见面
Schraiber等人首先认识到尼安德特人DNA在现代人中的分布规律应该能告诉人们一些有关杂交过程的信息。特别是尼安德特人的DNA以大块或碎片的形式出现在现代人身上。于是,他们观察了这些碎片在欧洲人和东亚人之间出现的频率。
Schraiber和同事Fernando Villanea运用一个大型现代人基因组数据集,对东亚与欧洲血统个体中源自尼安德特人DNA的图谱进行了不对称性分析。随后基于不同的基因交流次数,他们对解剖学上的现代人基因组中的尼安德特人DNA贡献进行了模拟,并通过机器学习方法,用多种参数对这些复杂模型进行探索。
结果显示,对现代人基因组中观察到的源自尼安德特人DNA的图谱的最佳解释是,尼安德特人与东亚和欧洲人群之间发生过不止一次,而是多次基因交流。相关论文近日刊登于《自然—生态与演化》。
当然,这里也可能存在“另一个人”的干扰。
丹尼索瓦人是生活在距今数万年前的另一个古人类种群,现代人祖先曾与他们共同生活并发生混血。由于丹尼索瓦人和尼安德特人的血缘关系相对较近,一些丹尼索瓦人的基因碎片可能被意外地归类为尼安德特人。“我们认为,在一定程度上,这是真实的,但它只代表了我们在分析中使用的尼安德特人基因碎片的很小一部分,不太可能对结果产生巨大影响。”Schraiber说。
但是,虽然该研究的模型支持多重、特定人群的混合,“我认为你不应该太照字面意思理解我们的模型—— 我们认为混合在孤立的群体中是即时发生的,但它可能远没有那么分散”。Schraiber说。
“致命”接触
约3万年前,尼安德特人逐渐灭绝,进而被现代人的祖先取代。
有研究显示,这可能是因为在漫长的演化过程中,来自尼安德特人的基因不适应现代人生存方式,从而在自然选择中被淘汰了。而且,尼安德特人小脑较小,对环境变化的适应能力较差。
“尼安德特人的低基因多样性表明,可能在很长一段时间里,他们的人口规模较小,而环境挑战也对他们产生了影响。”Schraiber说,“此外,尼安德特人的DNA样本显示,其中一些可能是有益的,但其中大部分可能是中性或对我们有害。”
换句话说,这些接触对尼安德特人和现代人都产生了不利影响。一方面,尼安德特人最终灭绝,另一方面,有研究发现源自尼安德特人的遗传变异与包括心脏病、动脉壁增厚在内的12种疾病患病风险的增加显着相关。
“历史上的基因交流事件通常会产生双重影响。”加利福尼亚大学默塞德分校考古学家Mark Aldenderfer在接受《中国科学报》记者采访时表示,“例如,过去500年里,欧洲人曾通过两种方式影响安第斯人的基因:欧洲人带来的流行病杀死了许多安第斯人,降低了现代安第斯人基因的多样性;但一些幸存者出现了对天花等欧洲疾病耐受的基因,而且这种选择在当地的现代人群中依然存在。”
无论如何,目前仍有很多悬而未决的问题。Schraiber表示,这项研究清楚地表明了人们应该寻找什么:如果我们找到大约6万到4万年前更古老的人类DNA,应该能够看到多重混合的直接证据。(生物谷Bioon.com)
2018年12月15日/生物谷BIOON/—在一项重要的新研究中,来自美国加州大学旧金山分校的研究人员证实CRISPR疗法可以在不切割DNA的情况下减少体内的脂肪。他们利用一种经过修饰的CRISPR版本提高某些基因的活性,从而阻止携带着导致极端体重增加易于发生的基因突变的小鼠出现重度肥胖。重要的是,他们实现了持久的体重控制,而无需对小鼠基因组进行一次基因编辑。相关研究结果于2018年12月13日在线发表在Science期刊上,论文标题为“CRISPR-mediated activation of a promoter or enhancer rescues obesity caused by haploinsufficiency”。
单拷贝突变导致许多人类疾病
尽管人类基因组包含每个基因的两个拷贝,一个拷贝来自父亲,另一个拷贝来自母亲,但是科学家们已知道在至少660个基因中,仅一个拷贝发生突变就能够导致疾病,其中的一些疾病甚至是毁灭性的。重度肥胖就是这样的一种疾病。在这项新的研究中,这些研究人员利用重度肥胖作为一种模型,旨在开发新的治疗方法来自治疗这些由单拷贝突变引发的疾病。
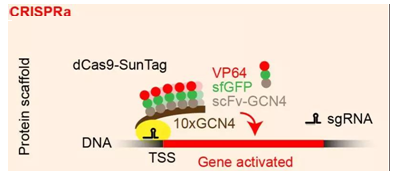
基因SIM1或MC4R—两个在调节饥饿和饱腹感中起着至关重要作用的基因—的单个拷贝发生突变在重度肥胖患者中是经常观察到的。当这些基因的两个拷贝都起作用时,人们通常能够控制他们的食物摄入。但是基因突变能够让其中的一个拷贝失去功能,这迫使人体完全依赖于单个正常的基因拷贝,然而这个正常的基因拷贝本身无法足够地发出饱食信号,这就使得受到影响的个人具有无休止的食欲。结果就是他们无法控制他们的食物摄入并最终导致重度肥胖。但是,CRISPR技术取得的最新进展可能提供一种治疗方案。
论文通讯作者、加州大学旧金山分校生物工程与治疗科学教授Nadav Ahituv博士说,“我们认为如果我们能够增加现有的一个功能性基因拷贝的表达剂量,我们就可能阻止携带单拷贝突变的个人患上许多人类疾病。我们能够通过使用在加州大学旧金山分校开发的一种基于CRISPR的新技术来实现这一目标。”
利用CRISPRa激活抑制食欲的基因
在这项新的研究中所涉及的这种技术是一种称为CRISPR介导激活(CRISPR-mediated activation, CRISPRa)的技术。它是由加州大学旧金山分校细胞与分子药理学教授Jonathan Weissman博士及其团队开发出来的,它与常规CRISPR的不同之处在于它不会对宿主基因组进行切割。它保持了常规CRISPR的引导系统,这种引导系统经编程后能够靶向特定的DNA序列,但是将与一串短肽(即SunTag array)融合在一起的没有切割活性的Cas9(dCas9)替换常规CRISPR中的有切割活性的Cas9。当CRISPRa找到其靶DNA序列时,这一串短肽能够在细胞中招募转录激活因子,从而促进特定基因表达,但是没有发生基因编辑。
在认识到它的潜力后,这些研究人员构建出靶向调节SIM1或MC4R活性的序列的CRISPRa系统。他们在经过基因改造后仅有SIM1或MC4R的一个功能性拷贝的小鼠中,利用一种病毒运送系统将这些CRISPRa构造体导入到小鼠的大脑饥饿控制区域中。
接受CRISPRa构造体注射的小鼠比没有接受CRISPRa构造体注射的小鼠产生更多的SIM1或MC4R,而且,产生的SIM1或MC4R数量与具有这些基因的两个功能性拷贝的小鼠在正常情形下产生的数量相当。最为重要的是,增加的表达剂量足以阻止这些小鼠变得肥胖。
论文第一作者、Ahituv实验室研究员Navneet Matharu博士说,“这些结果是激动人心的。缺失一个SIM1基因拷贝的小鼠在4周龄时接受了CRISPRa注射,并且像正常小鼠那样保持健康的体重。未接受CRISPRa注射的小鼠不能停止进食。它们在6周龄时开始体重增加,而且到10周大时,摄入普通饮食的它们出现重度肥胖。”
接受CRISPRa治疗的小鼠在体重上要比未治疗的小鼠减轻30%至40%。这种效果也是持久性的。这些研究人员对这些小鼠进行了10个月的监测—这是小鼠正常寿命的一小部分—并且发现那些接受CRISPRa单次治疗的小鼠在监测期间保持了健康的体重。
Matharu说,“这些结果表明,CRISPRa可能用于提高因一个基因拷贝缺失引起的疾病中的基因表达剂量,从而为某些形式的肥胖以及数百种其他疾病提供一种潜在的治疗方法。”
CRISPRa能够克服基因编辑的局限性
这些研究人员认为,通过使用CRISPR对这些小鼠的基因组进行编辑,也可能取得类似的结果,但是他们认为相比于这种常规的基因编辑技术,CRISPRa具有许多优势。
论文共同作者、加州大学旧金山分校糖尿病研究主任Christian Vaisse博士说,“出于治疗目的,CRISPRa可能优于常规CRISPR。它解决了许多与对基因组进行永久性修饰相关的问题,并且它有潜力治疗多种不能选择基因编辑加以治疗的遗传疾病。”
尽管常规CRISPR靶向特定的DNA序列,但是人们已观察到它存在脱靶效应。对常规CRISPR而言,这可能无意中导致基因组发生永久性变化,从而产生潜在有害的结果。然而,与CRISPRa相关的脱靶效应不太可能具有破坏性,这是因为它没有导致永久性变化。事实上,这项新的研究表明利用CRISPRa靶向启动子和增强子—控制基因何时何地开启的非编码DNA序列—似乎能够阻止脱靶效应,同时将所需的效果限制在感兴趣的特定组织中。
这些研究人员还指出CRISPRa可能用于治疗其他类型的遗传疾病。就目前而言,由所谓的“微缺失(microdeletion)”—这一术语指的是较大的横跨上百万个核苷酸和多个基因的染色体片段缺失—引起的疾病对常规CRISPR来说因缺口太大而无法加以修复。在这种情况下,CRISPRa可能通过增加染色体上未受影响的基因拷贝的活性来补偿这种微缺失。他们表示,在基因完全丧失(即一个基因的两个拷贝都失去活性)的情况下,CRISPRa还可能激活另一个具有相似功能的基因来补偿这个缺失的基因。
Ahituv说,“尽管这项新的研究着重关注肥胖,但是我们认为我们的系统可能用于仅一个基因拷贝的缺失就能够导致疾病的任何情形。我们的方法展示了它在治疗多种疾病上具有巨大的治疗潜力,而且我们能够在不对基因组进行任何编辑的情况下实现这些益处。”(生物谷 Bioon.com)
参考资料:
Navneet Matharu et al. CRISPR-mediated activation of a promoter or enhancer rescues obesity caused by haploinsufficiency. Science, 2018, doi:10.1126/science.aau0629.
2019年1月8日 讯 /生物谷BIOON/ –多个基因的突变与帕金森疾病直接相关,但目前研究人员并不清楚这些基因突变是如何影响个体患上帕金森疾病的;近日,一项刊登在国际杂志The Journal of Cell Biology上的研究报告中,来自耶鲁大学的科学家们通过研究重点对一种诱发家族性帕金森疾病的基因突变进行研究,他们发现,该基因能够编码一种特殊蛋白,而该蛋白能控制脂质在细胞器膜之间的转移。

图片来源:Yale University
文章中,研究者调查了VPS13蛋白的关键角色,VPS13蛋白的功能障碍在多种类型神经性疾病发生过程中扮演着重要作用,包括帕金森疾病等。研究者发现,VPS13蛋白能从细胞膜中提取脂质,并将其藏匿于“防水腔体”(waterproof cavity)中,随后再转移到附近的膜结构上。VPS13蛋白家族成员位于细胞中细胞器彼此相互靠近的位点,即所谓的接触点(contact sites),其能够作为不同细胞器之间的纽带,使脂质的传递更加有效。
VPS13蛋白家族成员能在细胞内的不同位点发挥作用,同时与多种不同的神经性障碍发生直接相关,与帕金森疾病相关的VPS13C蛋白就能够作用于内质网与溶酶体之间的接触面,此外,另外一种与亨廷顿样综合征(舞蹈病-棘状红细胞增多症,ChAc)相关的VPS13A蛋白也能作用于内质网和线粒体之间的接触面。
其它的帕金森疾病基因也会编码溶酶体内系统的特殊蛋白,这或许就能帮助研究人员鉴别出不同基因突变所诱发的帕金森疾病之间共有的细胞机制,同时也有助于开发治疗帕金森疾病的新型疗法。(生物谷Bioon.com)
原始出处:
Nikit Kumar, Marianna Leonzino, William Hancock-Cerutti, et al. VPS13A and VPS13C are lipid transport proteins differentially localized at ER contact sites, The Journal of Cell Biology (2018). DOI: 10.1083/jcb.201807019