

日前,Sangamo Therapeutics公司和辉瑞公司公布了双方联合开发的A型血友病基因疗法SB-525在1/2期临床试验中获得的最新结果。试验结果表明,SB-525能够剂量依赖性提高凝血因子VIII的水平,并且具有良好的安全性和耐受性。FDA同时授予SB-525再生医学先进疗法(RMAT)认定。基于这些积极结果,两家公司计划将SB-525推入注册性临床试验,辉瑞公司将接手这一疗法的后期临床开发和生产。
A型血友病是一种由于遗传原因导致凝血因子VIII缺失的血液疾病。它是最常见的血友病类型,主要影响男性,大约在4000-5000名新生儿中就会出现一例患者。由于凝血因子的缺失导致患者血液不能正常凝结,很多患者会经常出现自发性出血事件。目前,对严重A型血友病患者的标准治疗方法是每周三次的预防性凝血因子VIII静脉注射。但是即便如此,仍然有很多患者会出现自发性出血事件。
SB-525是一款使用AAV6病毒载体携带表达人类凝血因子VIII的转基因的基因疗法。这一疗法的病毒载体设计旨在优化病毒载体的成产效率和肝脏特异性凝血因子VIII蛋白的表达。
在这项1/2期临床试验中,10名患者接受了递增剂量SB-525的治疗,其中4名患者接受了3e13 vg/kg的最高剂量。四名接受最高剂量SB-525治疗的患者的随访时间分别为24、19、6、和4周。头两名接受最高剂量治疗患者(患者7和8)的因子VIII水平已经达到正常区域,后两名患者(患者9和10)的因子VIII上升速度与前两名患者相当,其中患者9的因子VIII水平在接受治疗7周后已经达到正常区域。
而且,所有接受最高剂量SB-525治疗的患者在接受治疗后没有出现出血事件,而且在最初使用预防性因子VIII之后不再需要因子VIII替代疗法。
“SB-525表现出的疗效、安全性、和耐受性给我们很大鼓舞,我们开始准备将这一疗法推进至注册性研究。与监管机构的交流和FDA授予的RMAT认定也给予我们信心,“辉瑞罕见病研究部高级副总裁兼首席科学官Seng Cheng博士说:”如果因子VIII水平能够得到维持,患者能够继续避免因子VIII替代疗法,并且不出现出血事件,我们相信这款基因疗法将具有革新治疗A型血友病模式的潜力。“(生物谷Bioon.com)

菊属植物种类繁多,又含多种栽培种,兼具观赏和药用价值,且染色体组结构从2n=18到8n=72之间,十分复杂,多年来难以攻破。
中药所所长陈士林研究员、副研究员宋驰博士等利用ONT平台解析了可能代表栽培菊属祖先基因组的二倍体菊花脑基因组,分析表明其演化受重复序列爆发和近期WGD事件的驱动,该基因组复制事件在约38.8个百万年前将菊属和向日葵分化开来;菊花脑观赏及药用性状的变异与包含旁系同源基因组复制事件的基因组家族扩张有关。
那么究竟菊花基因组的任督二脉是怎样被打通的?
赏菊入门之基因组组装
提取菊花脑()DNA并在ONT平台生成总数据量105.2 Gb,经base calling后99.5Gb的数据被用于后续分析,同时采用二代数据进行序列校正及混合组装,最终获得24,051条contig序列,contigN50为130.7 kb,组装基因组大小2.53 Gb,覆盖了预估基因组的~82%。
赏菊小径之基因注释
研究利用来自不同组织的转录本来验证和构建基因模型,以此来预测菊花脑基因组中蛋白质编码基因的含量。除去非功能注释后,共有56,870个蛋白质编码基因组被发现。在菊科中,菊花脑的基因数量与向日葵(52,232)和加拿大莴苣(44,592)较为类似。对ncRNA基因的注释发现了2,076个tRNA基因、55个rRNA基因、1,504个snRNA基因及579 个microRNA基因。
赏花大道之LTR反转录转座子的重复含量及爆发
赏菊图鉴之基因组进化及基因家族扩张
为了研究菊花基因家族与不同性状之间的关系,研究者比较了菊花脑与其他14种植物的基因组。利用这些植物的预测蛋白质组,共鉴定出由418,703个基因组成的39,414个同源基因家族,其中包括161,163个核心基因,隶属于15种植物中共有的5,278个基因家族,其中11,372个基因家族共存于4种菊科植物中(Fig.1)。
研究发现菊花脑中拥有8,009个特异基因,隶属于1,939个基因家族。此外,基因家族进化分析表明,菊花脑中的1,965个基因家族发生了扩张,1,777个基因家族中发生了收缩(Fig.2)。对菊花脑中扩张的基因家族进行功能注释,发现这些基因功能集中在转移酶活性和萜烯合酶活性等方面,表明这些基因可能与次级代谢产物的生产有关。
研究者进一步分析了菊花进化过程中的WGD事件,使用重复基因的Ks值计算复制事件的发生时间,并在~0.1处发现了一个峰,表明最近的WGD事件发生在大约580万年前(Fig.3)。
赏菊攻略之关键基因一瞥
研究者还绘制出与重要生物学特征基础通路相关基因的完整编目并分析了和黄酮类化合物,注释了参与黄酮类化合物合成的基因,最后,更萜类生物合成相关基因的多样化。研究鉴定出了类萜合成酶(TS)基因和多个细胞色素P450依赖的加氧酶(CYP)基因,令人惊讶的是,除了那些已经在其他已测序的真双子叶植物中鉴定出的TS/CYP组合之外,研究者还在菊花中发现了新的组合,如TPS-a/CYP99和TPS-g/CYP79/CYP76等。(生物谷Bioon.com)
小编推荐会议 2019(第三届)微流控芯片前沿研讨会
http://meeting.bioon.com/2019MICROFLUID?__token=liaodefeng
2019年8月24日讯/生物谷BIOON/—尼曼-皮克病(Niemann-Pick disease, NPD)又称为鞘沉积病(sphingolipidoses),是一种溶酶体贮积症,其特征在于神经变性和早期死亡。它是一种先天性糖脂代谢性疾病,影响着身体的多个系统,严重程度也各不相同。根据致病基因和疾病症状和患者体征,人们将NPD主要分为4种类型:A型(NPD-A),B型(NPD-B),C1型(NPD-C1)和C2型(NPD-C2)。
NPD-A是一个由编码酸性鞘磷脂酶(ASM)的基因发生功能丧失性突变引起的,其中酸性鞘磷脂酶颗可将鞘磷脂水解成神经酰胺。患者出现精神发育迟滞,早期运动技能明显丧失,认知能力下降和早逝。
NPD-A患儿生存率很低,通常在3个月时,出现肝脾肿大,并发育不良。少数患儿,在1岁之前发育正常,然后逐渐丧失思维能力和运动能力,患儿通常会出现广泛的肺损伤——间质性肺病,从而引起反复发作性肺部感染,最终导致呼吸衰竭。
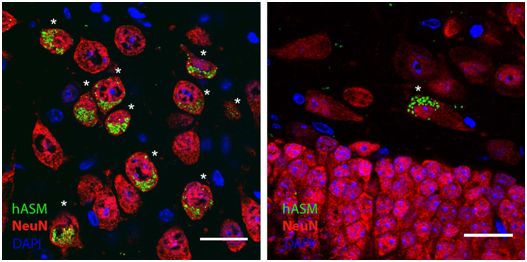
基因替代疗法已经证实可有效治疗其他的单基因神经疾病。如今,在一项新的研究中,来自西班牙和美国的研究人员在非人灵长类动物中评估了注射编码人酸性鞘磷脂酶(hASM)的腺相关病毒载体血清型9(AAV9-hASM)到小脑延髓池(cerebellomedullary cistern)中的安全性。他们也在这种疾病的小鼠模型(ASM-KO小鼠,即ASM基因敲除小鼠)中评估了它的治疗益处。相关研究结果发表在2019年8月21日的Science Translational Medicine期刊上,论文标题为“Adeno-associated viral vector serotype 9–based gene therapy for Niemann-Pick disease type A”。
这些研究人员发现在非人灵长类动物的小脑延髓池中注射AAV9-hASM会导致大脑和脊髓细胞中的hASM基因广泛表达,而且没有表现出毒性迹象。
在ASM-KO小鼠模型中,这种注射导致脑脊液和不同大脑区域中的hASM表达,而且不会引发炎症反应。相反,往小脑中直接注射AAV9-hASM会引发免疫反应。
这些研究人员还确定了往小鼠的小脑延髓池中注射AAV9-hASM的最低有效治疗剂量。在注射两个月后,这种治疗阻止了ASM-KO小鼠的运动和记忆障碍、鞘磷脂(SM)积聚、溶酶体增大和神经元死亡,并且它们的存活率。
他们在来自接受小脑延髓池AAV9-hASM注射的ASM-KO小鼠模型的血浆中检测到ASM活性,同时还在这些小鼠中发现鞘磷脂水平下降和肝脏中的炎症减少。
由此可见,这些研究结果支持在未来针对小脑延髓池注射开展基于AAV9的基因治疗临床试验以便治疗NPD-A和其他的溶酶体贮积脑疾病。(生物谷 Bioon.com)
参考资料:
Lluis Samaranc et al. Adeno-associated viral vector serotype 9–based gene therapy for Niemann-Pick disease type A. Science Translational Medicine, 2019, doi:10.1126/scitranslmed.aat3738.
2019年9月10日 讯 /生物谷BIOON/ –当女性怀孕时,分娩对孩子和自身的健康都非常重要,早产是引发健康问题的主要原因,同时也是全球5岁以下儿童死亡的主要原因,相反,如果妊娠远远超过了女性的预产期的话,其分娩并发症和死产的风险也就会增加,那么是什么决定了女性何时分娩呢?截至目前,研究人员认为,分娩的时间主要由母亲的基因和环境因素所决定,然而近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自丹麦国家血清研究所等机构的科学家们通过研究发现,婴儿自身的基因或许与母亲分娩的时间之间也存在密切关联。

图片来源:CC0 Public Domain
研究者Rachel Freathy表示,本文研究结果或能帮助我们理解决定孕妇分娩时间的关键因素,尤其是我们发现,婴儿的基因或许在其中发挥着更为重要的作用。文章中,研究人员对来自8个国家20个不同队列中84689名儿童的遗传信息进行了分析,他们对所有染色体进行了分析并调查了超过750万个遗传突变,在2号染色体上的一个小型区域中,研究者发现,婴儿常见的遗传变异与其分娩时间之间存在着明显的统计学关联。
从生物学角度上看,2号染色体上的这个小区域特别有趣,因为其含有一组产生炎性细胞因子的白细胞介素-1家族基因,在分娩前的数天或数小时内,这些细胞因子就会在子宫的活化、胎膜的薄利和破裂、子宫颈的成熟和收缩中发挥着非常重要的作用。当婴儿发育完全准备出生时,其就会向母亲发出信号,研究者表示,他们似乎发现了一种新型的遗传开关,其能或多或少地提高这个信号的强度,从而影响婴儿的出生时间(稍早或稍晚)。后期研究者还需要进行更为深入的研究理解所鉴别出的遗传变异产生的效应,同时揭示引发怀孕期长短的分子机制。
早产及晚产对新生儿的健康都是有危害的,更好地理解影响女性分娩时间的生物学过程有望帮助开发新型策略来预防早产或晚产;最后研究者Mads Melbye表示,尽管本文研究结果可能并不会直接改变当今的孕妇,但从长远来看,研究人员可能会模拟生物信号机制,来有效改善孕妇的分娩时间,从而保护其和婴儿的健康。(生物谷Bioon.com)
原始出处:
Xueping Liu, Dorte Helenius, Line Skotte, et al. Variants in the fetal genome near pro-inflammatory cytokine genes on 2q13 associate with gestational duration, Nature Communications (2019). DOI:10.1038/s41467-019-11881-8

2019年10月14日讯/生物谷BIOON/—世界上许多最常见或致命的人类病原体都是RNA病毒,比如埃博拉病毒、寨卡病毒和流感病毒,并且大多数都没有美国食品药品管理局(FDA)批准的治疗方法。在一项新的研究中,来自美国麻省理工学院、哈佛大学和布罗德研究所等研究机构的研究人员将一种CRISPR RNA切割酶转变为一种经编程后检测和破坏人细胞中RNA病毒的抗病毒剂。相关研究结果于2019年10月10日在线发表在Molecular Cell期刊上,论文标题为“Programmable Inhibition and Detection of RNA Viruses Using Cas13”。
人们此前已将Cas13酶用作一种切割和编辑人类RNA的工具,并且将它用作一种检测病毒、细菌或其他靶标存在的诊断试剂。这项新的研究是首批利用Cas13或任何CRISPR系统作为体外培养的人细胞中的一种抗病毒剂的研究之一。
这些研究人员将Cas13的抗病毒活性及其诊断能力结合在一起,构建出一种有朝一日可能用于诊断和治疗病毒感染的系统。他们的系统称为CARVER(Cas13-Assisted Restriction of Viral Expression and Readout)。
这项新的研究是由布罗德研究所成员Pardis Sabeti、Sabeti实验室研究生Catherine Freije和Sabeti实验室博士后研究员Cameron Myhrvold共同领导的。
Sabeti说:“人类病毒病原体极其多样化,不断地适应它们所在的环境,即便在单一病毒种类中也是如此,这既强调了所面临的挑战,也强调了开发灵活抗病毒平台的必要性。我们的研究将CARVER确立为一种强大且可快速编程的诊断和抗病毒技术,可用于各种各样的病毒。”
病毒走开
人们迫切需要新的抗病毒方法。在过去的50年中,科学家们已制造了90种经过临床认证的抗病毒药物,但是它们仅能治疗9种疾病,而且病毒病原体经过快速进化后对现有的治疗产生抵抗力。仅有16种病毒具有FDA批准的疫苗。
为了探究新的抗病毒策略,这些研究人员着重关注了天然地靶向细菌中病毒RNA的Cas13。这种酶经编程后靶向RNA的特定序列,几乎没有限制,相对容易进入细胞,并且已在哺乳动物细胞中得到了广泛的研究。
这些研究人员首先筛选了一系列RNA病毒,以寻找Cas13能够高效靶向的病毒RNA序列。他们主要寻找既不易发生突变又最有可能在切割后让病毒失效的序列片段。
Myhrvold解释说,“从理论上讲,你可以对Cas13进行编程,使得它可以攻击病毒的几乎任何部分。但是在单个病毒种类中和不同病毒种类之间均存在着巨大的多样性,并且随着病毒的进化,它的大部分基因组会迅速变化。如果你不小心,你可能会找到最终没有效果的靶标。”
这些研究人员通过计算确定了数百个病毒种类中的数千个位点,这些位点可能是Cas13的有效靶标。
三合一系统
鉴于有了一系列潜在的病毒RNA靶标,这些研究人员随后对Cas13进行编程,具体就是以对这种酶的向导RNA(gRNA)进行基因改造,让Cas13寻找并切割这些核酸序列中的任何一个。
这些研究人员通过实验手段测试了Cas13在受到三种不同的RNA病毒—淋巴细胞脉络膜脑膜炎病毒(LCMV),甲型流感病毒(IAV)和水泡性口腔炎病毒(VSV)—中的一种病毒感染的人细胞中的活性。他们将Cas13基因和经过基因改造的gRNA引入到人细胞中,并在24小时后将这些细胞暴露于病毒中。再过24小时后,Cas13酶将体外培养的人细胞中的病毒RNA水平降低了多达40倍。
这些研究人员进一步探究了Cas13对病毒感染力的影响—换句话说,剩下的病毒中还有多少实际上可以继续感染人细胞。实验数据表明在病毒暴露8小时后,Cas13将流感病毒的感染力降低了300倍以上。
为了增加诊断组分,这些研究人员还将整合了基于Cas13的核酸检测技术SHERLOCK。由此形成的CARVER系统可以快速测量样品中剩余的病毒RNA水平。
Freije说,“我们设想Cas13作为一种研究工具,以探究人细胞中病毒生物学的许多方面。它也可能是一种临床工具,可用于诊断样本、治疗病毒感染并测量治疗的有效性,所有这些都能使得CARVER快速适应并应对新的或耐药性的病毒出现。”(生物谷 Bioon.com)
参考资料:
1.Catherine A.Freije et al. Programmable inhibition and detection of RNA viruses using Cas13. Molecular Cell, Published Online: 10 October 2019, doi:10.1016/j.molcel.2019.09.013.
2.CRISPR enzyme programmed to kill viruses in human cells
https://phys.org/news/2019-10-crispr-enzyme-viruses-human-cells.html

大豆开花是作物重要农艺性状之一,对作物产量形成、植株形态建成、驯化以及生态适应性等方面具有显着影响。大豆开花是在外部环境和内部因素共同作用下,从营养生长转变为生殖生长的结果。大豆是典型的光周期敏感短日照作物,光照是决定开花时间最重要的外界环境因素之一,短日照促进开花,长日照抑制开花,它是由光周期途径感知和传递外部信号并整合一系列内部调控基因来控制完成的。目前通过经典遗传学方法,先后已成功克隆了E1、E2、E3、E4、E6、E9、E10和J等主效基因,初步解析了大豆光周期调控开花机理;但是人们尚未能明确生物钟基因与大豆开花间的精细调控关系。
中国科学院东北地理与农业生态研究所大豆分子设计育种实验室夏正俊团队利用栽培品种与农家品种杂交制备了一个遗传群体,在12号染色上定位调控生育期的主效QTL位点qFT12-1,并通过图位克隆法成功地鉴定了调控qFT12-1的生物钟基因GmPRR7。该基因含CCT结构域,属于生物钟调控基因TOC1基因家族。表达分析表明因GmPRR7及同源基因在表达上呈明显的日节律性变化规律。在野生及栽培大豆品种间的等位变异分化表明,GmPRR7与大豆的驯化关系密切。该研究成果揭示了生物钟基因与大豆光周期反应之间的内在联系,丰富了人们对大豆光周期调控机制的认识,同时为大豆分子设计育种提供重要的分子元件。
本成果发表在国际植物期刊Frontier in Plant Science上,东北地理所博士研究生李玉秋与吉林省农业科学院董英山为共同第一作者,夏正俊为通讯作者。该研究得到国家重点研发项目(2016YFD0100201, 2016YFD0101900)、中科院先导项目及国家自然科学基金项目的资助。(生物谷Bioon.com)
2019年11月14日 讯 /生物谷BIOON/ –即将在费城举办的2019年美国心脏协会会议上,来自肯塔基大学医学院的研究人员将会报告其最新研究成果,一种特殊的基因会使得某些化合物尝起来有苦味,这或许会使得一部分人很难在饮食中添加并摄入有益机体心脏健康的蔬菜。

图片来源:Wikibooks
研究者Jennifer L. Smith表示,机体的遗传特性或会影响味觉,而味觉是选择食物的一个重要因素;如果我们真的想让患者遵循营养指南的话,我们就必须考虑到食物的味道,每个人都携带者两个拷贝的味觉基因TAS2R38,遗传了两个拷贝AVI基因突变的人群会对来自特定化合物的苦味变得并不敏感,而携带一个AVI拷贝和另一个PAV拷贝的人群则能感觉到这些化合物的苦味,然而,拥有两个PAV拷贝的人群(通常被称为味觉超常者)却会对相同的食物表现出格外苦的味觉。
当参与者品尝了测试的化合物后,可能会讨论其一天的苦涩水平,这些人群可能会发现西蓝花、包子甘蓝和白菜很苦,也可能对黑巧克力、咖啡和啤酒产生负面效应。研究者分析了来自175名参与者(平均年龄52岁,超过70%的女性)的食物频率调查问卷,结果发现,携带PAV基因的人群在摄入蔬菜水平的排名上往往靠后,而苦味的状态丝毫不影响参与者摄入的盐分、脂肪和糖类的水平。
最后研究者Smith说道,我们认为,参与者可能会摄入更多的糖分和盐分来抵消其它食物的苦味,但事实并非如此;后期我们还希望能通过更为深入的研究,利用遗传信息来找出不同人群更容易接受哪些蔬菜,并找出哪些香料对味觉超常者更有吸引力,这样就能让其更容易地摄入更多蔬菜来保持机体健康。(生物谷Bioon.com)
原始出处:
Sensitivity to bitter tastes may be why some people eat fewer vegetables
A specific gene makes certain compounds taste bitter, which may make it harder for some people to add heart-healthy vegetables to their diet, according to preliminary research to be presented at the American Heart Association’s Scientific Sessions 2019—November 16-18 in Philadelphia.
“Your genetics affect the way you taste, and taste is an important factor in food choice,” said Jennifer L. Smith, Ph.D., R.N., study author and a postdoctoral fellow in cardiovascular science at the University of Kentucky School of Medicine in Lexington. “You have to consider how things taste if you really want your patient to follow nutrition guidelines.”……