2016年11月1日/生物谷BIOON/–为了利用CRISPR-Cas9基因编辑系统切割基因,人们必需设计一种与靶基因的DNA相匹配的RNA序列。大多数基因具有上百个这样的在基因组中的活性和独特性上存在差异的序列。因此,寻找最佳的序列很难通过手工实现。一种新的“CrispRGold”程序有助科学家们鉴定出最为高效的和最为特异性的RNA序列。这种程序是由德国马克斯-德尔布吕克分子医学中心科学家Klaus Rajewsky教授领导的一个研究团队开发的。该团队也开发出一种新的已携带Cas9蛋白的模式小鼠。将这种模式小鼠和这些可靠的RNA序列结合在一起导致原代细胞中的基因高效地失活。这就使得研究人员能够发现参与免疫细胞调节的新基因。
对很多分子生物学家而言,发现这种CRISPR-Cas9基因编辑系统代表着研究上的一种新的里程碑:最终,基因组DNA能够被高效地和高精准地切割,从而能够让基因失活、修饰或重新导入。
这仅需一种将Cas9酶带到将被切割的DNA位点上的RNA片段。这种RNA片段被称作单向导RNA(sgRNA),含有长20个碱基(A、U、C或G)的与基因组靶位点互补的序列。在此之前,科学家们不得不通过手工费力地选择或者利用多种在线工具选择sgRNA。在某些情形下,人们并不确定所选的sgRNA是否将Cas9酶携带到基因组上合适的位点或者一种类似的但不是所想要的位点,以及这种sgRNA的效率是否比较高。
这种新的“CrispRGold”程序使得让特定基因失去功能变得更加简单。它寻找确定的DNA靶序列以便鉴定出进行切割的最佳位点并且提示一种在遗传物质上独特的仅运送Cas9蛋白到所需位点上的sgRNA序列然后能够切割靶基因以至于它不能够发挥功能。这种程序是基于实验数据和这些序列的独特性和其他性质而被开发出来的。
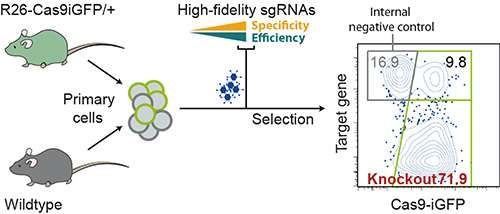
通过与Van Trung Chu博士合作,来自Rajewsky教授领导的这个团队的博士生Robin Graf在小鼠的B细胞中测试了这个系统。这些细胞不能够在体外培养非常长的时间,这是因为它们不会它们的自然环境外存活较长的时间。因此,基因在很多B细胞中必需尽可能快地失活以便研究它们的功能。Chu通过培养一种产生大量的但是具有良好数量耐受性的Cas9蛋白的转基因小鼠品系而实现这一点。
研究人员随后从这些小鼠体内分离出B细胞,将单个基因特异性的sgRNA运送到这些细胞中。Graf说,利用CrispRGold程序设计出的sgRNA在平均80%的这些细胞中高重复率地破坏这些靶基因。“在这种类型的低通量实验中,高效率和低错误率是绝对必要的。”
研究人员利用他们的新方法鉴定出许多种之前未知的参与B细胞发育的基因。Graf说,这种CrispRGold程序如今将被发布到网上,这样它能够被全世界的科学家们使用:“这种程序能够轻松地用于来自一系列有机体中的其他类型的细胞中。它也可能在临床应用中具有重要意义—它将序列独特性视为一种高度优先因素,因而使得对潜在不想要的基因的修饰最小化,这也是在基因疗法中必需不惜一切代价加以避免的。”(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷app。
Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line
Van Trung Chu, Robin Grafa,1,2, Tristan Wirtza, Timm Webera, Jeremy Favreta,b, Xun Lia, Kerstin Petscha, Ngoc Tung Trana, Michael H. Siewekea,b,c,d, Claudia Bereke, Ralf Kühna,f, and Klaus Rajewsky
 基因君官网
基因君官网