输精管(vas deferens)是一对弯曲的细管,与输尿管并列而行,后端开口于泄殖腔。输精管的主要功能是把精子从附睾输送到尿道。
作者按:
近年来由于环境及社会因素的变化,男性生殖健康问题日趋严重。不仅精子的数量在逐年减少,而且精子的质量也在逐年下降,由此带来的男性不育症发生率逐年上升。据统计,不育症困扰着全球范围内约20%的育龄夫妇,其中男性因素约占一半。
男性不育严重影响社会和谐、人口质量、家庭幸福和个人身心健康。但是,目前男性不育的致病机理尚不清楚,许多遗传因素(常染色体异常、Y染色体微缺失和基因突变等)与非遗传因素(高温、辐射、药物等)均可致病。随着社会发展和国家需要的转变,当今男科学和生殖生物学研究方向已逐渐由“生殖避孕”转变为“不孕不育”。
基于全外显子测序等高通量手段,科研工作者在男性不育症患者中筛选基因突变的研究揭示了一些重要的“靶点基因”。这将有望揭示男性不育的致病机制,并为后续的临床治疗提供理论依据。基于此,本文向大家介绍2016年度发表的几篇SCI文章,它们分别揭示了CFTR、SUN5、DNAJB13、AURKC和DNAH1基因的突变是男性不育的遗传性致病机制之一。
双侧输精管缺陷
双侧输精管缺陷是男性生殖系统的一种先天性畸形,是阻塞性无精子症的一个重要病因。80%先天性双侧输精管缺陷患者中均存在CFTR基因(囊性纤维化跨膜传导调节因子)突变,但其余20%的致病机理尚不清楚。法国Eric Bieth教授研究团队收集了12例双侧输精管缺陷患者(CFTR基因未有突变),并进行了全外显子测序。研究人员发现了ADGRD2基因的三个杂合突变(产生截短的蛋白):c.1545dupT (p.Glu516Ter),c.2845delT (p.Cys949AlafsTer81)和c.2002_2006delinsAGA (p.Leu668ArgfsTer21)。先前的研究已发现Adgrg2基因敲除雄性小鼠表现为阻塞性无精子症。因此,双侧输精管缺陷患者的临床检查需要考虑这两个关键基因(CFTR、ADGRG2)的突变筛查。
参考文献:Patat O, Pagin A, Siegfried A, Mitchell V, Chassaing N, Faguer S, Monteil L, Gaston V, Bujan L, Rigot JM, Mieusset R, Bieth E. Truncating mutations in the adhesion Gprotein-coupled receptor G2 gene ADGRG2 cause an X-linked congenital bilateral absence of vas deferens. Am J Hum Genet, 2016, 99(2):437-442.
无头精子症
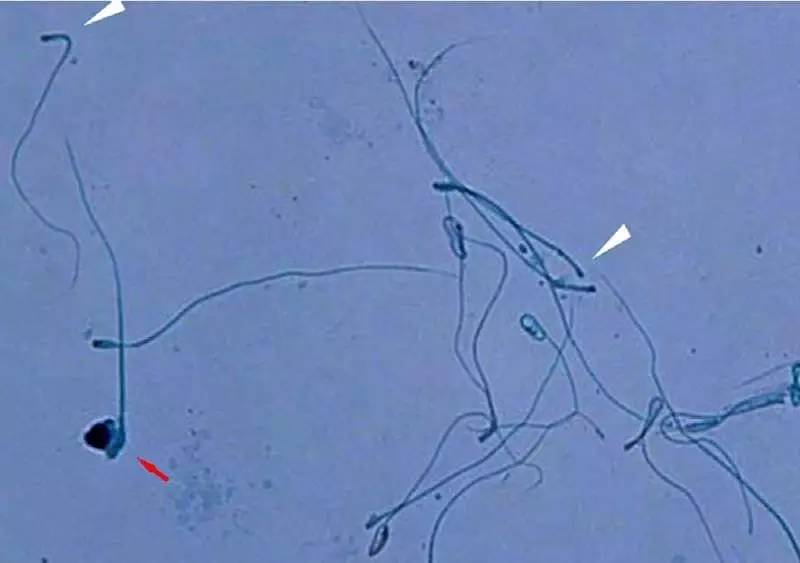
无头精子症的精子形态,白色箭头显示缺乏头部的精子。
无头精子症是畸精子不育症中的一种类型,但其遗传族源和致病突变尚不清楚。众所周知,精子头部至关重要,因为头部包含遗传物质DNA。安徽医科大学第一附属医院曹云霞教授研究团队对2例男性不育症患者进行了全外显子测序,发现了SUN5基因存在1个纯合突变p.Thr275Met和2个复合杂合突变p.Arg356Cys,p.Met162Lys。对另15例男性不育症患者的SUN5基因进行Sanger法测序,又在其中6例患者中发现了2个纯合突变和4个复合杂合突变。上述几个SUN5基因变异会导致SUN5蛋白的缺失、显着降低、截短或定位改变(SUN5本定位于精子头-尾结合部)。因此,SUN5基因的突变筛选可应用于无头精子症的临床诊断。
参考文献:Zhu F, Wang F, Yang X, Zhang J, Wu H, Zhang Z, He X, Zhou P, Gecz J, Cao Y. Biallelic SUN5 mutations cause autosomal-recessive acephalic spermatozoa syndrome. Am J Hum Genet, 2016, 99(4):942-949.
原发性纤毛运动障碍(PCD)
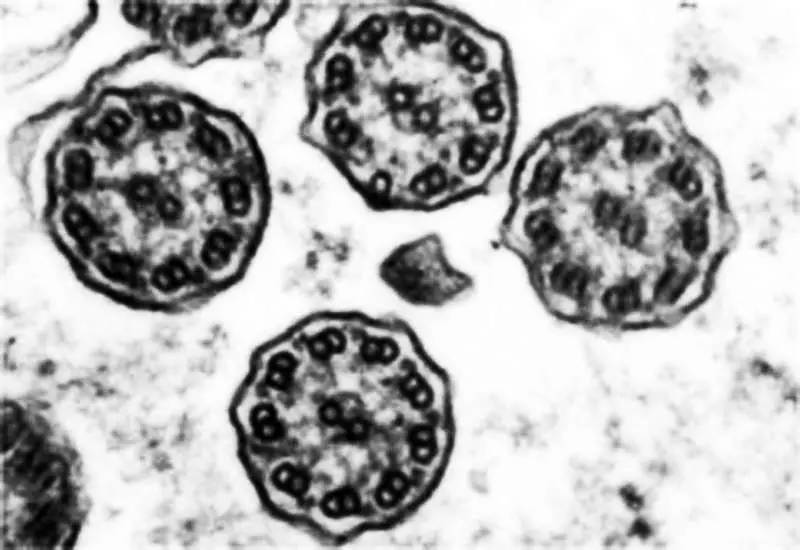
精子尾部负责精子运动,分为中段、主段和末段三各部分。主要结构是贯串于中央的轴丝。精子轴丝的结构与动物的鞭毛(或纤毛)相似,基本组成上都是9+2型,即位于中央的两条是单根的微管,四周是9条成双的微管(二联体)。
原发性纤毛运动障碍(PCD)是一类常染色体隐性遗传病。PCD患者表现为复发性呼吸道感染,多数男性患者由于精子尾部功能缺陷导致不育。法国AminataToure教授研究团队对1例PCD患者进行全外显子测序,发现了DNAJB13基因的2个纯合突变p.Met278Arg和p.Tyr24*。第一个突变导致蛋白不稳定,诱发蛋白酶体降解,导致DNAJB13蛋白在精子尾部消失。第二个突变导致剪切错误、蛋白功能破坏。因此,DNAJB13基因突变是PCD致病的遗传因素之一,DNAJB13对鞭毛和精子尾部轴丝的形成和功能发挥重要的调控功能。
参考文献:Ei Khouri E, Thomas L, Jeanson L, Bequignon E, Vallette B, Duquesnoy P, Escudier E, Coste A, Legendre M, Toure A, Amselem S. Mutations in DNAJB13, encoding an HSP40 family member, cause primary cillary dyskinesia and male infertility. Am J Hum Genet, 2016,99(2):489-500.
精子形态异常
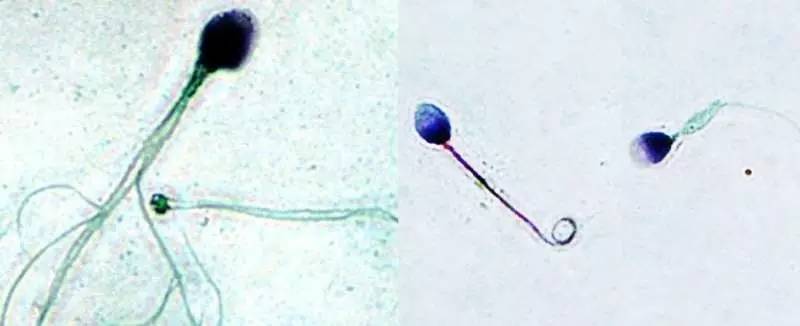
精子形态异常:大头、多尾、多核、尾部卷曲
精子形态异常是男性不育症患者精液涂片可观察到的明显缺陷之一。法国Ray PF教授团队利用全基因组微卫星扫描在14例不育症样本中筛选到AURKC基因的1个纯合单核苷酸缺失(c.144delC)。该突变导致蛋白翻译提前终止,产生缺少激酶结构域的截短蛋白。此后,来自不同国家的科研人员又报道了多个AURKC基因突变病例,活检发现患者精子形态异常:大头、多尾、多核。
法国Ray PF教授团队在18例不育症患者中发现了4种DNAH1基因纯合突变:c.11788-1G>A,c.3877G>A,c.12796T>C,c.5094+1G>A。DNAH1基因突变患者的精子尾部体现出多种形态异常:缺失、短小、打卷、弯曲或不规则。此后,RayPF教授和青岛大学医学院科研人员又分别报道了多例DNAH1基因突变。
参考文献:Coutton C, Escoffier J, Martinez G, Arnoult C, Ray PF. Teratozoospermia: spotlight onthe main genetic actors in the human. Human Reprod Update. 2016, 21(4):455-485.
结 语
尽管全球大量基础和临床研究学者积极研究男性不育的病因,但仍有超过一半的病人病因不明,这严重阻碍了后续的临床治疗。目前仅有限的检测实验用于男性不育的遗传学诊断,如染色体核型分析、Y染色体微缺失检测、精子DNA完整性检测、CFTR等少数基因突变检测。携带有未知遗传突变的男性不育患者,也可以通过辅助生殖技术(体外受精-胚胎移植IVF-ET和卵泡浆内单精子纤维注射ICSI)生育后代。这种情况下,准确的遗传学诊断就显得尤为重要,因为突变是可遗传给后代的。
笔者建议,男性不育的遗传学诊断发展应注重以下几方面:一、专业的临床化检。通过睾丸活检和精子形态检测等,将不育症患者精子发生的缺陷进行明确分类:无单倍体精子、精子畸形(头部、尾部、头尾连接的多种缺陷)等。二、高通量的测序筛选。利用全外显子测序技术等,进行不同类型不育症患者基因突变筛选,并探究突变的概率。三、基础研究转化。将基因敲除小鼠模型的基础研究应用于临床:将基因敲除小鼠精子发生缺陷的表型进行分类、基因进行汇总,在相似表型的临床患者中重点检测其基因突变。
相关会议推荐

2017(第四届)基因编辑与临床应用研讨会
会议时间:2017.6.9 -6.10 会议地点:上海
 基因君官网
基因君官网